液态芯片技术联合检测IFN-γ和IP-10诊断结核性胸腔积液
2014-07-05刘佳庆张立孙海柏吴敏杜岩青冯刘树业
刘佳庆张 立孙海柏吴 敏杜岩青冯 爽 刘树业
新技术交流
液态芯片技术联合检测IFN-γ和IP-10诊断结核性胸腔积液
刘佳庆1,2张 立1孙海柏1吴 敏1杜岩青1冯 爽1刘树业2△
目的 应用液态芯片技术联合检测胸腔积液中干扰素(IFN)-γ、IFN-γ诱导蛋白(IP)-10水平,探讨其在临床快速诊断及鉴别诊断结核性胸腔积液中的应用价值。方法选取渗透性胸腔积液患者,其中结核性胸腔积液组52例;恶性胸腔积液组38例。利用结核感染T细胞斑点试验(T-SPOT.TB)测定其对结核杆菌反应的效应T细胞数量,即斑点形成细胞数(SFCs),同时利用液态芯片技术测定其IFN-γ和IP-10水平,通过Logistic逐步回归法评估IFN-γ和IP-10联合诊断时的价值,并比较两种诊断方法的价值。结果T-SPOT.TB法诊断结核性胸腔积液的灵敏度为90.38%,特异度为84.21%,ROC曲线下面积(AUC)及95%CI为0.938(0.867~0.978);IFN-γ、IP-10联合诊断结核性胸腔积液时的灵敏度为98.08%,特异度为97.37%,AUC及95%CI为0.995(0.951~1.000)。2种诊断方法灵敏度和特异度的差异不明显;2种方法诊断一致性良好(Kappa=0.703);方法间AUC比较差异有统计学意义(Z=1.996,P<0.05),检测IFN-γ、IP-10水平联合诊断时AUC较大(AUC=0.995)。结论利用液态芯片技术同时检测IFN-γ、IP-10水平联合诊断结核性胸腔积液满足了临床快速、准确诊断及鉴别诊断结核性胸腔积液的需要。
干扰素Ⅱ型;趋化因子CXCL10;胸腔积液,恶性;结核;ROC曲线;结核感染T细胞斑点试验;液态芯片;IFN-γ诱导蛋白10
我国是结核病高负担国家,≥15岁人口中活动性肺结核患者高达499万[1]。在控制结核病各个环节中,准确诊断和早期治疗非常重要,结核感染相关的干扰素(IFN)-γ释放试验将可能成为强有力的高灵敏度和高特异度的结核诊断辅助工具[2]。本研究利用液态芯片技术联合检测胸腔积液中IFN-γ和IFN-γ诱导蛋白(IP)-10水平并与经典的结核感染T细胞斑点试验(T-SPOT.TB)方法进行比较,以寻求早期快速准确诊断结核性胸腔积液的策略。
1 对象与方法
1.1 研究对象 选取我院2012年6月—2013年6月胸腔积液患者90例。其中结核组52例,男33例,女19例,平均年龄(49.02±21.99)岁,入组标准:(1)有结核病的中毒症状,如发热、盗汗、全身乏力、食欲减退等。(2)经过抗结核治疗后,病情好转,治疗有效。(3)胸膜活检时可见结核结节。(4)纯化蛋白衍生物试验(PPD)结节大于1.5 cm×1.5 cm。(5)经肺部X线平片或CT检查证实有结核病灶。以上5项中符合3项或单项(3)均可。恶性组38例,男27例,女11例,平均年龄(52.89±20.20)岁,入组标准:均经肺穿刺活检、胸部CT、脱落细胞学或纤维支气管镜检查获得病理组织学或细胞学依据而确诊为恶性胸腔积液患者。2组人群排除标准:(1)妊娠期或哺乳期妇女。(2)年龄<16岁或>90岁。(3)正规抗结核治疗超过1周。2组年龄(t=0.854)、性别(χ2=0.279)差异均无统计学意义。
1.2 仪器和试剂 IFN-γ和IP-10联合检测试剂盒购于美国伯乐公司;Luminex 200多功能流式点阵仪购于美国Luminex公司;T-SPOT.TB试剂盒购于英国Oxford Immunotec公司。
1.3 方法 所有患者留取新鲜胸腔积液约50 mL,及时送实验室,取部分装于5 mL离心管中,以10 000×g离心10 min后取上清液1 mL放入1.5 mL离心管中,置-20℃冰箱中保存,余下胸腔积液立即利用酶联免疫斑点法(ELISPOT)检测结核感染T细胞数量(T-SPOT.TB法),以2种抗原分别刺激所得的斑点形成细胞数(SFCs)较大者为T-SPOT.TB结果,临界值为SFCs=6;利用液态悬浮芯片技术(Luminex xMAP®)同时检测IFN-γ和IP-10水平,利用ROC曲线确定临界值。具体操作严格按照试剂盒说明书和本科室标准操作规程(SOP)文件执行。
1.4 统计学方法 应用SPSS 22统计软件分析数据,对各组数据进行正态性检验,正态分布计量资料采用±s表示,2组间比较采用t检验;非正态分布计量资料采用M(P25,P75)表示,2组间比较采用Mann-Whitney U检验;阳性率的比较采用配对资料的McNemar检验;多因素分析采用Binary Logistic回归;应用Medcalc 11.4软件绘制ROC曲线,比较曲线下面积(AUC),确定临界值。P<0.05为差异有统计学意义。
2 结果
2.1 2组胸腔积液中IFN-γ、IP-10水平及SFCs比较 结核组胸腔积液中IFN-γ、IP-10水平及SFCs高于恶性组(均P<0.01),见表1。
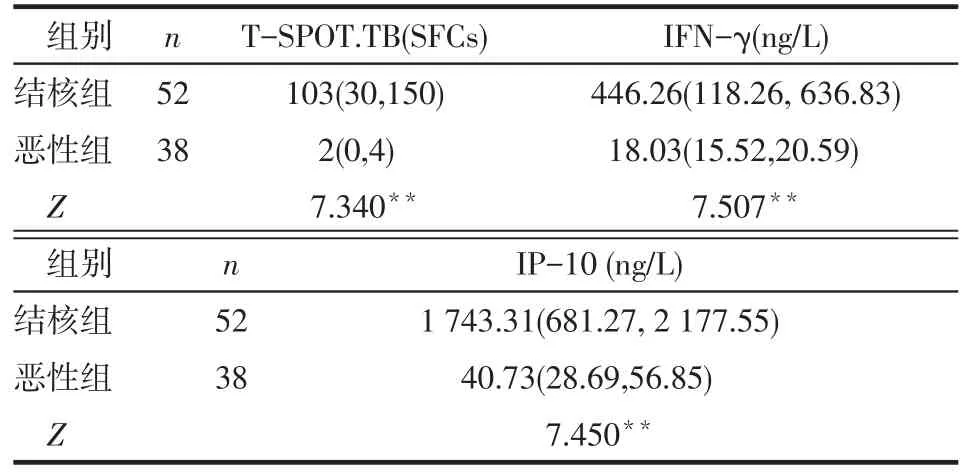
Tab.1 Comparison of pleural effusion levels of IFN-γ, IP-10 and SFCs between two groups表1 2组胸腔积液中IFN-γ、IP-10、SFCs水平比较[M(P25,P75)]
2.2 ROC曲线分析 利用ROC曲线确定IFN-γ、IP-10的诊断临界值分别为68.12、86.68 ng/L,灵敏度分别为90.38%、94.23%,特异度分别为92.11%、94.74%,AUC及95%CI分别为0.965(0.903~0.992)、0.962(0.899~0.991),见图1。

Fig.1 Comparison of ROC curves between two diagnostic tests图1 2种诊断试验ROC曲线图比较
2.3 Binary Logistic回归分析 利用Logistic逐步回归法计算出IFN-γ、IP-10联合检测时的回归方程为:Log(P)=0.018×IFN-γ+0.020×IP-10-4.558 (P为预测因子),经转换得到预测因子的方程P=1/(1+e-(0.01819×IFN-γ+0.01963×IP-10-4.558)),以P作为联合诊断指标绘制的ROC曲线见图1,灵敏度和特异度分别为98.08%、97.37%,AUC及95%CI为0.995(0.951~1.000)。
2.4 2种方法比较 T-SPOT.TB诊断结核性胸腔积液 ROC曲线见图 1,灵敏度和特异度分别为90.38%、84.21%,与IFN-γ、IP-10联合诊断时的灵敏度和特异度比较差异不明显;AUC及95%CI为0.938(0.867~0.978),与IFN-γ、IP-10联合诊断时的AUC比较,差异有统计学意义(Z=1.996,P<0.05),联合诊断时的AUC较大。2种诊断方法的诊断一致性良好(Kappa=0.703)。
3 讨论
渗出性胸腔积液在临床上以结核性和恶性最为多见,两者治疗和预后迥然不同,故正确鉴别非常重要。IFN-γ是1型辅助性T淋巴细胞亚群(Th1)的特征性细胞因子,结核菌感染后,病变部位巨噬细胞被活化,IFN-γ产生增加,进而胸腔积液中IFN-γ表达增高。IP-10由IFN-γ和(或)脂多糖(LPS)诱导产生,具有促进多种细胞因子分泌介导Th1型炎症反应及抗结核等生物学作用。
本研究发现恶性胸腔积液中IFN-γ水平显著低于结核性胸腔积液,与最近类似报道的结果[3-4]一致。但上述类似报道中IFN-γ的测定均使用传统的酶联免疫吸附测定(ELISA)法,操作繁琐,重复性差,易受自身抗体及嗜异性抗体等因素干扰,而且扩展性差,不能多指标并行检测,本研究所用的液态芯片技术改变了ELISA的分析模式,是多功能、多指标的并行分析系统,集编码微球、激光技术、流式细胞、数字信号处理等技术于一体,具有高通量、高效率的特点,在孵育时间、标本用量、检测线性范围、检测低限等方面均优于ELISA法,而且在联合指标的选择上具有非常大的灵活性,可以自行设计,随意组合多指标并行检测,节省了时间和成本。最近有研究利用ELISA方法测定胸腔积液中IFN-γ等多指标组合后诊断结核性胸腔积液,发现联合诊断时得到最高的灵敏度和特异度[5-6]。本研究选择联合检测胸腔积液中IFN-γ和IP-10水平,结果高于IFN-γ单独检测时的诊断效率,成本也显著低于IFN-γ和IP-10两种ELISA试剂的价格之和。联合检测与经典的T-SPOT.TB方法比较时,两者诊断一致性良好(Kappa=0.703),尽管灵敏度和特异度的差异不明显,但是两者AUC比较表明IFN-γ、IP-10联合诊断时对结核性胸腔积液的诊断价值更高,并且TSPOT.TB方法样本需要量大,操作繁琐,等待时间长(2 d)。另有研究表明,与T-SPOT.TB同属经典IFN-γ释放试验(IGRAs)的TB.QFT-IT(QuantiFERON-TB Gold in Tube)用于诊断结核性胸腔积液也不如IFN-γ水平直接定量测定价值高,TB.QFT-IT只增加了医疗费用没有提高诊断价值[7]。
本研究利用液态芯片技术多指标并行的优势联合检测IFN-γ、IP-10诊断结核性胸腔积液,操作简单,报告时间短,而且灵敏度、特异度均较高,满足了辅助临床对结核性胸腔积液早期准确诊断的需要。但是由于类似研究的缺少,没有推荐的临界值及医学决定水平,而且本研究的标本均来自于同一家医院,其代表性有一定局限性,样本量较小,也不能排除在结核性胸腔积液患者中有非结核分枝杆菌感染,虽然这种现象很少见[8],因此,需要进一步扩大样本量继续深入研究。
[1]Wang LX,Cheng SM,Chen MT,et al.The fifth national tuberculosis epidemiological survey in 2010[J].Chinese Journal of Antituberculosis,2012,34(8):485-508.[王黎霞,成诗明,陈明亭,等.2010年全国第五次结核病流行病学抽样调查报告[J].中国防痨杂志, 2012,34(8):485-508.]
[2]Qian F,Wang W,Qiu Z,et al.Evaluation of a new tuberculosis-related interferon gamma release assay for tuberculosis infection diagnosis in Huzhou,eastern China[J].Indian J Pathol Microbiol,2013, 56(2):125-128.
[3]Ibrahim L,Salah M,Abd El Rahman A,et al.Crucial role of CD4+ CD 25+FOXP3+T regulatory cell,interferon-γ and interleukin-16 in malignant and tuberculous pleural effusions[J].Immunol Invest,2013,42(2):122-136.
[4]Khan FY,Hamza M,Omran AH,et al.Diagnostic value of pleural fluid interferon-gamma and adenosine deaminase in patients with pleural tuberculosis in Qatar[J].Int J Gen Med,2013,6:13-18.
[5]Wu YB,Ye ZJ,Qin SM,et al.Combined detections of interleukin 27,interferon-γ,and adenosine deaminase in pleural effusion for diagnosis of tuberculous pleurisy[J].Chin Med J(Engl),2013,126 (17):3215-3221.
[6]Keng LT,Shu CC,Chen JY,et al.Evaluating pleural ADA,ADA2, IFN-and IGRA for diagnosing tuberculous pleurisy[J].J Infect, 2013,67(4):294-302.
[7]Ghanem M,Nasr Eldin E,Omar A,et al.Diagnostic value of quantitative measurement of pleural fluid interferon-gamma(IFN-γ)versus quantiFERON-TB gold in tube assays(QFT-IT)in blood,pleural fluid,and isolated pleural fluid cells in tuberculous pleural effusion[J].Chest,2013,144:262A.
[8]Lim JG,O SW,Lee KD,et al.Mycobacterium intracellulare pleurisy identified on liquid cultures of the pleural fluid and pleural biopsy[J].Tuberc Respir Dis(Seoul),2013,74(3):124-128.
(2013-12-14收稿 2014-04-25修回)
(本文编辑 李国琪)
Diagnostic Value of Combined Detection of the Level of IFN-γ and IP-10 by Liquid Array Technology in Tuberculous Pleural Effusion
LIU Jiaqing1,2,ZHANG Li1,SUN Haibai1,WU Min1,DU Yanqing1,FENG Shuang1,LIU Shuye2△
1 Tianjin Haihe Hospital,Tianjin 300350,China;2 The Third Central Clinical School of Tianjin Medical University△
E-mail:lshye@163.com
ObjectiveTo explore the diagnostic value of combined detection of the liquid array technology,interferon(IFN)-γ and IFN-γ-inducible protein(IP)-10 in the rapid,accurate diagnosis and differential diagnosis of tuberculous pleural effusions.MethodsPatients with transudative pleural effusions were divided into tuberculous pleural effusion group(n=52)and malignant pleural effusion group(n=38).The method of T-SPOT.TB was used to detect the number of effector T cells sensitized to Mycobacterium tuberculosis and spot forming cells(SFCs).The liquid array technology was used to detect the level of IFN-γ and IP-10.Logistic regression was used to analyze and compare the diagnostic value of the twomethod combination.ResultsThe diagnostic sensitivity,specificity and the area under the ROC curve(AUC)of T-SPOT. TB were 90.38%,84.21%,and 0.938(95%CI:0.867-0.978),respectively.The diagnostic sensitivity,specificity and AUC of combined detection of IFN-γ and IP-10 were 98.08%,97.37%,and 0.995(95%CI:0.951-1.000),respectively.There was no significant difference in the diagnostic sensitivity and specificity between the two methods,and the diagnostic agreement for the two diagnostic methods was fine(Kappa=0.703).The difference of AUC between the methods was significantly different(Z=1.996,P<0.05).The method of combined detection of IFN-γ and IP-10 showed the larger AUC(AUC=0.995).Conclusion The combined diagnosis meets the clinical needs of rapid,accurate diagnosis and differential diagnosis for tuberculous pleural effusion by simultaneously assaying the level of IFN-γ and IP-10 using the liquid array technology.
interferon typeⅡ;chemokine CXCL10;pleural effusion,malignant;tuberculosis;ROC Curve; T-SPOT.TB;liquid array technology;IFN-γ-inducible protein 10
R521
A
10.3969/j.issn.0253-9896.2014.09.027
天津市卫生局科技基金项目(2013KZ042)
1天津市海河医院检验科(邮编300350);2天津医科大学三中心临床学院
△通讯作者 E-mail:lshye@163.com
