PKH26荧光标记牛尾髓核细胞的实验研究
2014-07-05丁晓明徐宝山伍耀宏许海委强马信龙张春秋李秀兰
丁晓明 徐宝山 伍耀宏 许海委 杨 强马信龙 张春秋李秀兰 张 扬
细胞与分子生物学
PKH26荧光标记牛尾髓核细胞的实验研究
丁晓明1徐宝山2△伍耀宏1许海委2杨 强2马信龙2张春秋3李秀兰2张 扬2
目的 探讨PKH26荧光标记在牛尾髓核细胞的应用,为髓核组织工程的体内研究提供可示踪的种子细胞。方法从牛尾椎间盘中分离髓核组织,通过酶消化法获取原代细胞,倒置显微镜下观察,P1代髓核细胞进行番红O、甲苯胺蓝和Ⅱ型胶原免疫细胞化学染色,对P1代髓核细胞进行PKH26荧光染料标记,并对标记后细胞的活性、荧光强度(0、14、28 d)、增殖特性及基因表达进行评估。结果分离得到的髓核细胞数为(1.56±0.35)×106/g,倒置显微镜下,原代细胞培养4 d开始贴壁,细胞成群生长,14 d铺满瓶底,原代细胞、P1代细胞均呈类软骨样细胞形态;P1代髓核细胞甲苯胺蓝染色异染、番红O染色和Ⅱ型胶原免疫细胞化学染色阳性;PKH26标记前后细胞活性均在95%以上,1、14、28 d呈递减趋势,但28 d时细胞仍可检测出较强的荧光,标记后的细胞增殖及基因表达(Ⅰ、Ⅱ型胶原及聚集蛋白聚糖)与标记前的细胞相比差异无统计学意义(P>0.05)。结论牛尾髓核组织中可以分离出数量满意的髓核细胞,且具有软骨样细胞的表型,可以用作种子细胞;PKH26标记后的髓核细胞无生物学特性的变化,可以用作髓核细胞体内研究的示踪染料。
组织工程;椎间盘;牛尾;髓核细胞;PKH26
椎间盘退变引起的下腰痛是劳动力丧失的主要原因之一,严重者常采用手术治疗[1],但目前的治疗措施未能从根本上重建正常的椎间盘结构和功能。近年来,组织工程椎间盘作为一种生物治疗方法引起广泛关注。研究发现椎间盘的退变起源于髓核,目前组织工程的研究也主要集中在髓核组织工程上,并取得了巨大进展[2]。种子细胞是组织工程的重要环节,用于髓核组织工程的种子细胞主要有干细胞、髓核细胞、软骨细胞,其中干细胞是最具应用前景的种子细胞[3],但干细胞诱导条件和诱导后细胞的鉴定方法尚不成熟,因此常用的种子细胞仍是髓核细胞[4]。牛尾髓核细胞具有取材方便、经济廉价、细胞表型良好等特点,为髓核组织工程提供了新的细胞来源。本实验对髓核细胞进行PKH26荧光标记,为进一步的种子细胞体内示踪提供依据。
1 材料与方法
1.1 组织来源、主要试剂及仪器 新鲜牛尾。DMEM培养基、胎牛血清(GIBCO公司,美国);乙二胺乙酸二钠(EDTA)、胰蛋白酶、四甲基偶氮唑蓝(MTT)、兔抗牛Ⅱ型胶原抗体(Abcam公司,英国);生物素化山羊抗兔IgG(北京中杉金桥生物技术有限公司);PKH26红色荧光细胞链接Mini试剂盒(Sigma公司,美国)。CO2培养箱(Hera-cell公司,德国);恒温摇床(Heidolph公司,德国);倒置显微镜、荧光显微镜(OLYMPUS公司,日本)。
1.2 髓核细胞分离 取刚宰杀的牛尾(雄性,3岁龄),简单消毒后送至实验室。无菌环境下分离出脊柱和牛尾椎间盘,取出髓核,清除其他组织,用含10万U/L青霉素的Hanks液漂洗2遍,剪碎,加入浓度为0.2%的Ⅱ型胶原酶,与髓核组织以3∶1体积充分混合,在37℃、220 r/min摇床中消化4 h,至髓核组织基本消化完全,200目滤网过滤,收集细胞悬液,细胞计数和台盼蓝染色检测活性,1 000 r/min离心7 min,弃上清,用含10%FBS的高糖DMEM重悬细胞沉淀,调整细胞密度为1×105/mL,接种至培养瓶,培养液为含10%胎牛血清(FBS)的高糖DMEM,置于37℃、5%(V/V)CO2的培养箱中培养。每2 d换液1次,倒置荧光显微镜观察细胞生长情况,待细胞融合至80%左右,消化传代,P1代细胞制成悬液备用。
1.3 髓核细胞鉴定 将P1代细胞悬液调整至浓度1×104/mL,接种至含有盖玻片的24孔板中进行爬片,48 h后取出,多聚甲醛固定20 min,PBS缓冲液漂洗3遍,甲苯胺蓝、番红O染液常温下染色15~20 min,风干,中性树脂封片,显微镜下观察;按照试剂盒操作,SABC法进行Ⅱ型胶原免疫组织化学染色,显微镜下观察。
1.4 PKH26荧光染料标记 胰酶和EDTA常规消化髓核细胞,用不含血清的DMEM培养基洗涤,1 000 r/min离心5 min,弃上清,重复2次,细胞沉淀用1 mL Diluent C溶液重悬成单个细胞,将其与1 mL浓度为4×10-6mol/L的PKH26染料混匀,室温反应5 min,加入2 mL血清终止标记反应,1 000 r/min离心10 min,去上清,加入完全培养基洗涤3次,1 000 r/min离心5 min,弃上清。用含10%FBS的高糖DMEM培养基重悬至所需细胞浓度1×107/mL,涂片,台盼蓝染色,观察细胞活性,荧光显微镜下观察荧光标记强度(1 d、14 d、28 d)。
1.5 PKH26标记细胞增殖活性测定 MTT检测标记前后的髓核细胞生长曲线。取PKH26标记前后的P1代髓核细胞进行实验,将1 mL浓度为1.0×104/mL的细胞悬液接种到24孔板上,连续培养7 d,MTT法检测对髓核细胞增殖活性的影响。每天操作如下:每组样本取3孔,每孔加入100µL MTT溶液,37℃下继续培养4 h,弃去培养液,每孔加入500µL DMSO,置摇床上低速振荡10 min后移入96孔板的3个孔中,每孔100 μL,96孔板在酶联免疫检测仪中570 nm测定光密度(OD)值。根据OD值和时间点制作生长曲线。
1.6 PKH26标记细胞基因表达测定 实时荧光定量PCR检测Ⅰ、Ⅱ型胶原及聚集蛋白聚糖(Aggrecan)基因表达。收集标记前后的髓核细胞,Trizol法提取总RNA,采用M-MLV反转录酶合成cDNA,采用SYBR Premix DimerEvaser建立反应体系,分别扩增Ⅰ、Ⅱ型胶原和Aggrecan,以β-actin作为内参。实验采用Primier 5.0设计引物序列,由北京诺赛基因组研究中心合成。引物序列:β-actin上游5′-AGGTTGGCTCTGACTGT-3′,下游5′-TCTCCTTAATGTCACGCACG-3′;Ⅰ型胶原上游5′-AGGGAGTTTACAGGAAGCAGACA-3′,下游5′-CGAATACAAAACCACCAAGACC-3′;Ⅱ型胶原上游5′-TTCAGCTATGGAGATGACAATC-3′,下 游 5′-AGAGT CCTAGAGTGACTGAG-3′;Aggrecan上游 5′-GAGATGGAGGGTGAGGTC-3′,下游5′-ACGCTGCCTCGGGCTTC-3′。将各样本放入ABI PRIS M®7500荧光定量PCR仪,按下列条件扩增:95℃、5 min;95℃、15 s,60℃、60 s,45个循环。以β-actin作内参照,用LightCycler Software Ver.4.0软件分析目的基因的相对表达水平。
1.7 统计学方法 用SPSS 13.0软件包进行统计学处理。数据以均数±标准差(±s)表示,两组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 髓核细胞分离及鉴定结果 从牛尾髓核组织中分离的髓核细胞数量为(1.56±0.35)×106/g,细胞活性为95%以上,牛尾髓核原代细胞4 d开始贴壁,7 d可见细胞聚集成群生长,14 d长满瓶底,胞浆饱满,细胞呈卵圆形或短梭形,类软骨样细胞形态,见图1。P1代细胞形态与原代细胞相同,呈类软骨样细胞形态,见图2。细胞番红O和甲苯胺蓝染色阳性,Ⅱ型胶原免疫细胞化学阳性,见图3。
2.2 髓核细胞PKH26标记 髓核细胞标记后,台盼蓝染色标记后细胞活性仍能保持95%以上,对细胞活性无影响,荧光显微镜下细胞呈红色荧光,荧光强烈且分布均匀,1 d、14 d、28 d荧光呈减弱趋势,但28 d时仍可观察到较强荧光,见图4。MTT检测结果证明PKH26标记前后髓核细胞各增殖时间点的OD值无明显的差异,见表1。PKH26标记前后髓核细胞Ⅰ型胶原、Ⅱ型胶原、Aggrecan基因表达相对定量比较差异均无统计学意义(t分别为2.671、1.021、0.870,均P>0.05),见图5。

Fig.1 Primary nucleus pulposus cells(inverted phase contrast microscope,×100)图1 原代髓核细胞(倒置相差显微镜,×100)

Fig.2 P1 generation of nucleus pulposus cells(inverted phase contrast microscope,×100)图2 P1代髓核细胞(倒置相差显微镜,×100)
Tab.1 Comparison of the proliferations of nucleus pulposus cells before and after PKH26 labeling表1 PKH标记前后髓核细胞增殖情况比较(n=3,±s)

Tab.1 Comparison of the proliferations of nucleus pulposus cells before and after PKH26 labeling表1 PKH标记前后髓核细胞增殖情况比较(n=3,±s)
均P>0.05
组别PKH26标记组未标记组t 1 d 0.27±0.06 0.24±0.05 0.663 2 d 0.71±0.11 0.63±0.08 1.019 3 d 1.03±0.10 1.19±0.13 1.690 4 d 1.79±0.09 1.70±0.18 0.775组别PKH26标记组未标记组t 7 d 1.97±0.24 1.89±0.27 0.384 5 d 2.01±0.17 1.92±0.14 0.708 6 d 1.95±0.21 2.10±0.15 1.007
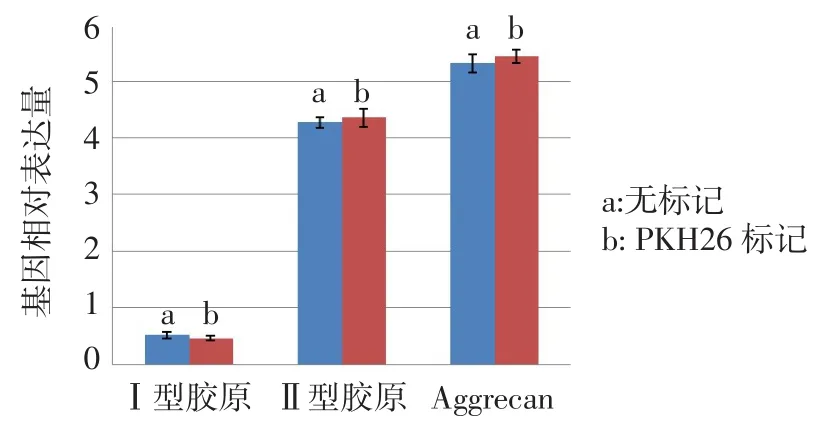
Fig.5 Comparison of gene expressions of nucleus pulposus cells before and after PKH26 labeling图5 髓核细胞PKH26标记前后基因表达水平比较
3 讨论
3.1 髓核细胞来源 髓核细胞作为种子细胞,目前主要来源于患者手术切除组织和兔[4]、鼠[5]等小动物。而小动物存在以下不足:首先,获取髓核组织量少,不能得到理想的种子细胞数目;其次,小动物与人的亲缘关系不如大型动物;用于研究的人髓核细胞都来源于患者手术中切除的退变组织,分离的细胞没有正常髓核细胞的表型,不能满足研究的需要[6]。牛尾取材经济、方便,能一次性获取大量的髓核组织。Roughley等[7]从成年牛尾中获得细胞数为3×106/g。Halloran等[8]从6月龄牛尾中提取的细胞数约为7.0×106/g。不同实验者获取的种子细胞数目存在较大差异,这主要与牛的年龄有关。本实验获取的种子细胞数在文献所报道的范围内,能够满足种子细胞的数量要求。目前对于髓核细胞的鉴定没有统一的方法,但由于髓核细胞是一种软骨样细胞,能够分泌蛋白多糖和Ⅱ型胶原,通过这两个表型特点来初步鉴定髓核细胞,并且染色均为阳性,说明牛尾髓核组织可以获得数量和表型均满意的髓核种子细胞。
3.2 荧光标记技术 目前常用的细胞标记染料包括Brdu[9]、CFSE[10]、绿色荧光蛋白[11]、PKH26[12]、放射性同位素标记[13]等。其中,PKH26是一种亲脂性的荧光染料,荧光显微镜下呈现红色荧光,能够不可逆地结合细胞膜,在合适的浓度下不会影响细胞活力,标记物可以随着种子细胞的分裂而均匀地分配给两个子细胞,同时荧光强度减半,是一种简便的体内细胞示踪染料,在体内荧光强度可以维持4个月,已成功用于上皮细胞[12]、骨髓基质干细胞[14]等的荧光标记。
3.3 PKH标记牛尾髓核细胞 本实验PKH26标记采用Sigma公司推荐的标记浓度(2 μmol/L)成功对牛尾髓核细胞进行了标记,荧光显微镜下强度满意,荧光标记均匀,且标记后的细胞活性基本没有影响(2 μmol/L浓度下,标记时间一般在2~3 min,延长时间细胞荧光强度没有明显增强,而细胞活性会受到影响),细胞标记前后MTT增殖检测、同一基因相对表达量比较也无明显差异。传代培养14 d、28 d细胞荧光逐渐减弱,但是仍可检测出,这说明PKH26标记的细胞体内可以至少维持1个月,这为髓核组织工程体内研究提供了新的研究方法,可以对种子细胞进行示踪,根据荧光定位区分移植细胞和宿主细胞,结合免疫荧光可以更准确地对种子细胞体内生物学功能进行评估。
综上,从牛尾髓核组织可以获得数量和表型均满意的髓核种子细胞,经PKH26标记后,牛尾髓核细胞形态、表型、增殖及蛋白表达无影响,而且PKH26标记技术操作简单,标记迅速、持续时间长,可以用作组织工程椎间盘种子细胞的示踪研究。

Fig.3 The staining for nucleus pulposus cells of P1(inverted phase contrast microscope,×200)图3 P1代髓核细胞鉴定染色(倒置相差显微镜,×200)

Fig.4 PKH26 labeled nucleus pulposus cells(fluorescence microscope,×100)图4 PKH26标记的髓核细胞(荧光显微镜,×100)
[1]XU Baoshan,MA Xinlong,XIA Qun,et al.Percutaneous Transforaminal Endoscopic Spine System in Lumbar Discectomy for Disc Herniation[J].Tianjin Medical Journal,2014,42(5):470-472.[徐宝山,马信龙,夏群,等,椎间孔镜TESSYS技术治疗腰椎间盘突出症效果分析[J].天津医药,2014,42(5):470-472.]
[2]Yang X,Li X.Nucleus pulposus tissue engineering:a brief review [J].Eur Spine J,2009,18(11):1564-1572.doi:10.1007/s00586-009-1092-8.
[3] Smith LJ,Gorth DJ,Showalter BL,et al.In Vitro Characterization of a Stem Cell-Seeded Triple Interpenetrating Network Hydrogel for Functional Regeneration of the Nucleus Pulposus[J].Tissue Eng Part A,2014,20(13-14):1841-1849.doi:10.1089/ten.TEA.2013. 0516.
[4] ZENG Chao,ZHU Meifeng,XU Baoshan,et al.Evaluation of the compatibility of silk fibroin porous scaffolds with rabbit nucleus pulposus cells[J].Orthopedic Journal of China,2013,21(23):2402-2407.[曾超,朱美峰,徐宝山,等.丝素蛋白多孔支架与兔髓核细胞生物相容性研究[J].中国矫形外科杂志,2013,21(23):2402-2407.]doi:10.3977/j.issn.1005-8478.2013.23.15.
[5]Nilsson E,Larsson K,Rydevik B,et al.Evoked thalamic neuronal activity following DRG application of two nucleus pulposus derived cell populations:an experimental study in rats[J].Eur Spine J, 2013,22(5):1113-1118.doi:10.1007/s00586-013-2669-9.
[6]Hudson KD,Alimi M,Grunert P,et al.Recent advances in biological therapies for disc degeneration:tissue engineering of the annulus fibrosus,nucleus pulposus and whole intervertebral discs[J]. Curr Opin Biotechnol,2013,24(5):872-879.doi:10.1016/j.copbio.2013.04.012.
[7] Roughley P,Hoemann C,DesRosiers E,et al.The potential of chitosan-based gels containing intervertebral disc cells for nucleus pulposus supplementation[J].Biomaterials,2006,27(3):388-396.doi: 10.1016/j.biomaterials.2005.06.037.
[8] Halloran DO,Grad S,Stoddart M,et al.An injectable cross-linked scaffold for nucleus pulposus regeneration[J].Biomaterials,2008,29 (4):438-447.doi:10.1016/j.biomaterials.2007.10.009.
[9]Dahia CL,Mahoney E,Wylie C.Shh signaling from the nucleus pulposus is required for the postnatal growth and differentiation of the mouse intervertebral disc[J].PloS one,2012,7(4):e35944.doi: 10.1371/journal.pone.0035944.
[10]Yang Q,Zhao Y,Xia Q,et al.Novel Cartilage-derived biomimetic scaffold for human nucleus pulposus regeneration:a promising therap strategy for symptomatic degenerative disc diseases[J].Orthop Surg,2013,5(1):60-63.doi:10.1111/os.12020.
[11]Fang Z,Yang Q,Luo W,et al.Differentiation of GFP-Bcl-2-engineered mesenchymal stem cells towards a nucleus pulposus-like phenotype under hypoxia in vitro[J].Biochem Biophys Res Ccommun,2013,432(3):444-450.doi:10.1016/j.bbrc.2013.01.127.
[12]Pastò A,Marchesi M,Diamantini A,et al.PKH26 Staining Defines Distinct Subsets of Normal Human Colon Epithelial Cells at Different Maturation Stages[J].PloS one,2012,7(8):e43379.doi: 10.1371/journal.pone.0043379.
[13]Wang D,Vo NV,Sowa GA,et al.Bupivacaine decreases cell viability and matrix protein synthesis in an intervertebral disc organ model system[J].Spine J,2011,11(2):139-146.doi:10.1016/j. spinee.2010.11.017.
[14]Chiba Y,Kuroda S,Osanai T,et al.Impact of ageing on biological features of bone marrow stromal cells(BMSC)in cell transplantation therapy for CNS disorders:Functional enhancement by granulocyte colony stimulating factor(G-CSF)[J].Neuropathology,2012,32(2): 139-148.doi:10.1111/j.1440-1789.2011.01255.x.
(2014-04-28收稿 2014-05-23修回)
(本文编辑 李鹏)
An Experimental Study on Bovine Nucleus Pulposus Cells Labelled with PKH26 in Vitro
DING Xiaoming1,XU Baoshan2△,WU Yaohong1,XU Haiwei2,YANG Qiang2,MA Xinlong2,ZHANG Chunqiu3,LI Xiulan2,ZHANG Yang2
1 Tianjin Medical University,Tianjin 300070,China;2 Tianjin Hospital;3 Tianjin University of Technology△
E-mail:xubaoshan99@126.com
ObjectiveTo investigate the application of PKH26 fluorescent labeling on nucleus pulposus cells isolated from bovine coccyx disc,and to provide nucleus pulposus tissue engineering with traceable nucleus pulposus cells by PKH26 fluorescence labelling.MethodsNucleus pulposus primary cells were isolated from the nucleus pulposus tissue detached from bovine coccyx disc by enzymatic digestion,and observed under the inverted microscope.Safranin O,toluidine blue and typeⅡcollagen immunocytochemistry methods used to stain for passage one generation cells.Nucleus pulposus cells were labeled with PKH26 fluorescence in accordance with the instructions.The cell activity,fluorescence intensity at d0,d14 and d28 of culture,characteristics of proliferation and the expression of gene in labeled cells were assessed.ResultsIsolated nucleus pulposus cells amounted to(1.56±0.35)×106/g.Under the inverted microscope,primary cells adhered at the 4 th day of culture,grew in groups,and covered the bottom of culture flask at the 13 th day.Both primary cells and the P1 generation cells were chondrocyte-like morphology.The staining of safranin O,toluidine blue and typeⅡcollagen immunocytochemistry for P1 generation of nucleus pulposus cells showed positive results.The cell activity before and after PKH26 labeling showed more than 95%,and the fluorescence intensity at d0,d14 and d28 performed a decreasing trend, but still showed detect strong fluorescence at d28.There were no significant differences in proliferation and the expression of gene(collagen typeⅠandⅡ,aggrecan)before and after cell labeling(P>0.05).ConclusionAs the seed cells of tissue engineering,nucleus pulposus cells isolated from bovine coccyx can reach a satisfactory number and maintain cartilage-like phenotype,and no changes shown in the biological characteristics after labeling.PKH26 labeled nucleus pulposus cells are suitable for the traceable cells in vivo study.
tissue engineering;intervertebral disk;bovine coccyx;nucleus pulposus cells;PKH26
R329-33,R349.89
A
10.3969/j.issn.0253-9896.2014.09.001
国家自然科学基金资助项目(81272046,31300798,31000432);中国博士后科学基金项目(2011M500530,2012T50221);天津市卫生局科技基金(2013KR16)
1天津医科大学研究生院(邮编300070);2天津市天津医院;3天津理工大学
△通讯作者 E-mail:xubaoshan99@126.com
