Notch1(NICD)过表达真核载体构建及对大鼠BMSCs增殖分化的影响
2014-07-05杜红阳李东宁付海燕包翠芬秦书俭
杜红阳 李东宁 付海燕 包翠芬 秦书俭
Notch1(NICD)过表达真核载体构建及对大鼠BMSCs增殖分化的影响
杜红阳1李东宁1付海燕2△包翠芬3秦书俭3
目的 探讨过表达Notch1(NICD)基因对大鼠骨髓间充质干细胞(BMSCs)增殖分化的影响。方法构建Notch1(NICD)过表达真核载体,实验分正常对照组(CON组,不做转染)、阳性对照组(空载体组,将质粒pEGFP-N1转染BMSCs)和转染组(将重组质粒pEGFP-N1-NICD转染BMSCs)。转染48 h后观察细胞一般状态,Real-time PCR和Western blotting检测神经元特异性烯醇化酶(NSE)、胶质纤维酸性蛋白(GFAP)和Notch1基因和蛋白表达,流式检测转染后细胞凋亡、细胞周期,MTT检测细胞增殖情况。结果重组质粒pEGFP-N1-NICD编码序列与设计完全一致。转染组和空载体组BMSCs均可表达绿色荧光。转染组GFAP、Notch1的基因和蛋白表达均高于CON组和空载体组(均P<0.05),空载体组与CON组差异无统计学意义;各组间NSE的基因和蛋白表达差异无统计学意义。转染组存活细胞比率低于CON组和空载体组,早期细胞凋亡比率、晚期细胞凋亡比率均高于CON组和空载体组;空载体组晚期细胞凋亡比率高于CON组。转染组细胞处于G1/G0期的比例高于CON组和空载体组,处于S期和G2/M期的比例低于CON组和空载体组(均P<0.05)。除转染1 d时各组MTT A490值差异无统计学意义外,其余时点转染组MTT A490值均低于CON组和空载体组(均P<0.05)。结论高表达Notch1(NICD)基因可能在一定程度上诱导BMSCs凋亡、抑制其增殖,且表现诱导向神经胶质样细胞分化。
细胞增殖;细胞分化;转染;神经胶质原纤维酸性蛋白质;磷酸丙酮酸水合酶;Notch信号通路;骨髓间充质干细胞;诱导;Notch1(NICD)
骨髓间充质干细胞(bone mesenehymal stem cells,BMSCs)是一类来源于骨髓的非造血干细胞,目前BMSCs在皮肤病包括皮肤伤口愈合、银屑病、系统性红斑狼疮(SLE)、放射性皮炎和硬皮病等方面的治疗作用受到广泛的关注[1]。近年来关于BMSCs增殖分化的分子机制的研究多集中在细胞信号通路上[2]。其中,Notch信号通路是一条保守而非常重要的细胞信号通路[3]。Notch信号通路由受体、配体、下游信号传递分子及调节分子等组成[4],在哺乳动物中,目前已发现4种Notch受体(Notch1~4),5种配体(Delta 1,3,4和Jagged 1,2),其中Notch1为细胞表面跨膜蛋白,NICD(the intracellular domain of Notch)为其胞内段且发挥重要的信号传递作用。本课题组前期研究发现正常扩增的BMSCs其Notch1蛋白为相对高表达,在促分化剂作用下Notch1 (NICD)蛋白表达降低[5],而本研究旨在探讨过表达Notch1(NICD)基因对BMSCs增殖分化的影响。
1 材料与方法
1.1 材料
1.1.1 药物与试剂 Notch1兔抗大鼠单克隆抗体购自Cell signaling公司,NICD一抗购自美国SANTA CRUZ公司,Hoechst33258购自Sigma公司,SDS购自Biomol公司,NheⅠ、AgeⅠ内切酶购自NEB公司;AxyPrep凝胶回收试剂盒、AxyPrep质粒小量提取试剂盒购自Axygen公司;Wide Range DNA Marker、RNA PCR kit(AMV)Ver 3.0、PMD18-T载体XGal、IPTG、T4DNA连接酶和大肠杆菌DH5α及克隆载体pMD18-T Vector、真核表达载体pEGFP-N1均购自TaKaRa公司;LipofectamineTM2000脂质体转染试剂盒购自Invitrogen公司。Triton X-100购自美国Amresco公司,TRITC标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司,其他试剂为进口或国产分析纯。
1.1.2 实验细胞 纯化P5大鼠BMSCs由辽宁医学院科学实验中心提供,经细胞冻存复苏后进行传代培养。当细胞生长融合达培养板/孔85%时应用0.25%胰蛋白酶及0.02% EDTA混合消化液消化,1∶3比例转入培养瓶内传代。取P3~P5代细胞以1×105个/mL的密度接种于6孔板或以5× 106个/mL接种于25 cm2细胞培养瓶中培养。
1.1.3 仪器 EC250电泳仪(美国EC公司),细胞超声粉碎仪VCX105(美国BIO-RAD公司);数控层析冷柜SL-Ⅲ(上海新诺);荧光分光光度计(天津拓普)。PCR仪(美国ABI公司),实时荧光定量PCR仪、核酸蛋白定量仪(德国Eppendorf公司);全自动凝胶成像分析系统(美国Syngene公司);倒置相差显微镜、荧光倒置显微镜IX70(日本Olympus公司),凝胶图像分析系统(美国Kodak公司)等。
1.2 方法
1.2.1 引物设计及质粒构建 根据GenBank大鼠Notch1 cDNA序列号X57405,采用Primer Premier 5.0和Oligo 6.0软件设计并扩增Notch1胞内段(NICD)编码区的引物。并且在上游引物的5′端引入NheⅠ限制性核酸内切酶位点,在下游引物5′端引入AgeⅠ限制性核酸内切酶位点,引物序列如下:Notch1-F 5′-AGTCGCTAGCATGGTGCTGCTGTCCCGCAAGCGCA-3′;Notch1-R 5′-GTACCGGTGGCTTAAATGCCTCTGGAATGTGGGTG-3′,下划线部分为酶切识别位点。经Blast分析所选序列与大鼠其他基因序列无同源性。经PCR扩增酶切与载体质粒连接,见图1,质粒提取试剂盒提取连接好的质粒,送上海生工生物工程有限公司测序。测序正确后将构建的重组表达质粒命名为pEGFP-N1-NICD,保存于-20℃冰箱中,用于后续试验。

Fig.1 The pEGFP-N1 carrier vector and multiple clone site icon (MCS means multiple clone site)图1 pEGFP-N1载体质粒及多克隆位点图谱(MCS为多克隆位点)
1.2.2 细胞转染及实验分组 采用质粒小量抽提试剂盒抽提pEGFP-N1-NICD和pEGFP-N1,经蛋白核酸分光光度计和电泳检测,A260/A280在1.8~2.0,且无任何降解的质粒DNA用于转染(pEGFP-N1-NICD浓度为200 mg/L,pEGFPN1浓度为200 mg/L)。实验分组:正常对照组(CON组):不做转染的BMSCs;阳性对照组(空载体组):将质粒pEGFP-N1转染BMSCs;转染组:将重组质粒pEGFP-N1-NICD转染BMSCs。使用6孔细胞培养板培养细胞,将每板细胞分为3组,每组2孔。参照LipofectamineTM2000脂质体转染试剂盒说明,将质粒通过脂质体转染法导入各组纯化培养的BMSCs。确保种植于6孔板中的BMSCs生长超过80%;用无血清培养基DMEM来稀释Lipofectamine 2000和质粒,质粒DNA(μg)与Lipofectamine 2000(μL)的混合比例1∶3,将转染细胞置于37℃的5%CO2培养箱中孵育48 h,此时为瞬时表达,每组收集2孔标本用于后续检测。
1.2.3 转染后一般形态学观察 转染后每日倒置显微镜下观察各组细胞形态变化。转染48 h后计算转染效率,随机读取3个非重叠高倍视野,计数发绿色荧光的细胞占所有细胞中的百分比,并计算平均值。
1.2.4 Real-time PCR检测神经元特异性烯醇化酶(NSE)、胶质纤维酸性蛋白(GFAP)和Notch1基因表达 细胞总RNA的提取,按照Invitrogen公司的TRIzol Reagent使用说明书进行操作,然后进行总RNA的纯度测定和质量检测,制备反转录cDNA按照TaKaRa公司Prime Script RT reagent Kit With gDNA Eraser说明书操作进行。最终进行Realtime PCR反应,Realtime PCR引物由TaKaRa公司设计合成,引物序列如下:NSE基因上游5′-CAACAGCACCATCGCACCG-3′,下游5′-GGCAAAGCCGCCTTCATC-3′;GFAP基因上游5′-GATGTAGGAGTGGGTAGGGC-3′,下游5′-GGACTGAGCAACCAGGAATAG-3′;Notch1基因上游5′-GCCGCAAGAGGCTTGAGAT-3′,下游5′-GGGGTCCTGGCATCGCTGG-3′;内参GAPDH基因上游5′-CCCACGGCAAGTTCAACGGCA-3′,下游5′-TGGCAGGTTTCTCCAGGCGGC-3′,利用Eppendorf公司的Realplex实时定量PCR仪进行分析,GAPDH作内参对每个基因进行标准化,每个样品同一个基因重复3次,并用去离子水取代模板作为阴性对照。反应完成后,系统软件将自动计算出每个样本扩增的Threshold cycle(Ct)值,最终根据目的基因和管家基因的Ct值,计算出目的基因的相对表达量,用2-△△Ct表示。对照组各基因表达量设为1。
1.2.5 Western blotting检测NSE、GFAP和NICD蛋白表达情况 收集转染48 h后细胞,弃培养液后用温的PBS冲洗3遍,Western blotting法检测蛋白表达,蛋白条带图像经过凝胶成像照相及图像分析系统测定其光密度,每个样本重复3次,计算各个样本积分光密度(条带强度×条带面积)与β-actin内参对照的比值(IOD值),即相对IOD值,以表示目标蛋白的相对表达量,从而反映各目的蛋白水平的变化情况。
1.2.6 转染后BMSCs细胞凋亡和细胞周期检测 转染48 h后各组细胞,按照Calbiochem®Annexin V-FITC凋亡检测试剂盒(购自美国EMD化学试剂公司)说明书操作用流式细胞仪检测细胞凋亡。同时收集转染后各组细胞,加预冷70%乙醇固定,4℃,加PI 37℃避光30 min,检测细胞周期,每组实验重复3次。
1.2.7 MTT检测转染后BMSCs增殖情况 转染前1 d,BMSCs 以1×104个/孔接种于96孔板中,按上述分组进行实验,每组设7个复孔。转染48 h后,加入完全培养基,从第2天起每隔24 h(分别为第1、2、3、4天)取7孔加入MTT溶液(5 g/L)20 μL,37℃继续孵育3 h后终止培养。小心弃除孔内培养液,每孔加入150 μL二甲基亚砜,低速振荡15 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫检测仪上测定各孔光密度值(OD值),计算不同组别细胞活力,整个过程重复3次,取其均值,绘制细胞增殖曲线。
1.3 统计学方法 利用SPSS 17.0统计软件,数据均采用±s表示,多组之间比较采用单因素方差分析,组间多重比较采用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 Notch1过表达真核质粒鉴定 测序结果见图2,重组质粒pEGFP-N1-NICD编码序列与设计完全一致。
2.2 Notch1(NICD)基因转染后BMSCs形态学观察及检测
2.2.1 基因转染后BMSCs一般形态学观察 倒置显微镜下观察,P3~P5代大鼠BMSCs形态均一,呈纺锤形、长梭形为主。Notch1(NICD)基因转染6 h后,细胞形态无显著改变,24 h后少部分细胞胞浆向核略回缩,出现胞体伸出多数突起,分支数量逐渐增加,似神经样细胞形态改变。24~48 h神经样细胞数量逐渐增多,但转染48 h后出现部分细胞死亡现象,随着培养时间的延长,死亡细胞不再增加,而后稳定生长。至5 d神经胶质样细胞不断增多,但至7 d时因转染细胞老化,而出现不断死亡。CON组和空载体组细胞胞体较前略有收缩,2组均未见神经样细胞的出现。荧光显微镜观察,转染48 h后转染组和空载体组的BMSCs均可以表达绿色荧光,且表达的部位无差异,转染细胞的胞浆和细胞核中均有特异性绿色荧光蛋白的表达。CON组BMSCs没有荧光表达,见图3。转染48 h后,转染组转染效率可达到60%。

Fig.2 The gene sequencing results of pEGFP-N1-NICD eukaryotic expression vector图2 pEGFP-N1-NICD真核表达载体的基因测序结果

Fig.3 The cell morphology after 48-hour transfection(×200)图3 转染48 h各组细胞形态(×200)
2.2.2 各组NES、GFAP、Notch1 mRNA表达情况比较 各组细胞提取总RNA的OD260/OD280比值均位于1.8~2.0,无蛋白质和DNA污染;熔解曲线分析显示各目的基因熔解曲线高尖,无其他基因非特异性扩增的波峰,说明实验选择的引物合适,无不扩增现象。转染48 h后,转染组GFAP、Notch1基因相对表达量均明显高于CON组和空载体组(均P<0.05),而各组间NSE基因表达差异无统计学意义。空载体组与CON组间各基因表达差异均无统计学意义,见图4。
2.2.3 各组NSE、GFAP和Notch1(NICD)蛋白表达情况比较 转染组GFAP、Notch1(NICD)蛋白表达均高于CON组和空载体组(均P<0.05),空载体组与CON组间GFAP、Notch1(NICD)蛋白表达差异均无统计学意义。各组间NSE蛋白表达差异无统计学意义,见图5、6。

Fig.4 The NES,GFAP and Notch1 mRNA expressions detected by real-time PCR图4 Real-time PCR检测NES、GFAP、Notch1 mRNA表达情况

Fig.5 The protein expressions of NSE,GFAP and NICD in three groups图5 3组NSE、GFAP和NICD蛋白表达

Fig.6 Comparison of IOD values of NSE,GFAP and NICD between three groups图6 3组NSE、GFAP和Notch1(NICD)蛋白IOD值比较
2.2.4 基因转染后BMSCs细胞凋亡和细胞周期变化情况 BMSCs转染48 h后,转染组存活细胞比率低于CON组和空载体组,早期细胞凋亡比率、晚期细胞凋亡比率均高于CON组和空载体组(均P<0.05);空载体组晚期细胞凋亡比率高于CON组(P<0.05),见图7、表1。转染组细胞处于G1/G0期的比例明显高于CON组和空载体组,而处于S期和G2/M期的比例明显低于CON组和空载体组(均P<0.05),见表2。
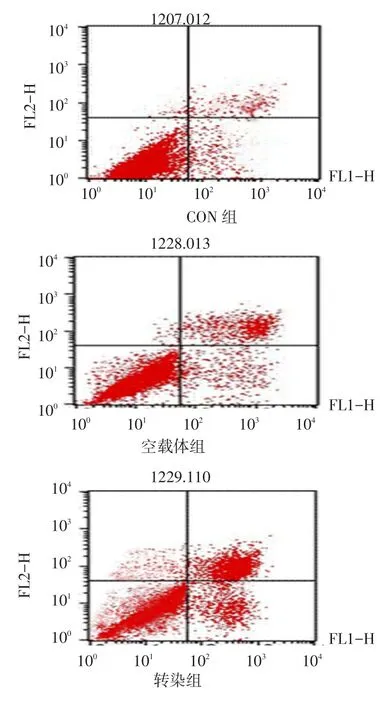
Fig.7 The apoptosis scatter diagram of BMSCs after transfection in three groups图7 基因转染后3组BMSCs细胞凋亡散点图
Tab.1 Comparison of the cell apoptosis after transfection between three groups表1 基因转染后3组细胞凋亡情况比较(n=3,%,±s)

Tab.1 Comparison of the cell apoptosis after transfection between three groups表1 基因转染后3组细胞凋亡情况比较(n=3,%,±s)
*P<0.05,;a与CON组比较,b与空载体组比较,P<0.05
组别CON组空载体组转染组F晚期细胞凋亡比率4.75±1.08 9.64±2.33a13.96±2.38ab385.27*存活细胞比率89.09±0.13 83.25±2.07 71.77±0.89ab57.18*早期细胞凋亡比率5.21±0.97 6.09±1.43 11.26±1.70ab189.14*
Tab.2 Comparison of the cell cycles after transfection between three groups表2 基因转染后3组细胞周期情况比较(n=3,%,±s)

Tab.2 Comparison of the cell cycles after transfection between three groups表2 基因转染后3组细胞周期情况比较(n=3,%,±s)
*P<0.05,;a与CON组比较,b与空载体组比较,P<0.05
组别CON组空载体组转染组F G1/G0 62.11±0.01 63.25±0.15 81.56±1.23ab43.26*S 18.05±1.31 20.57±2.21 8.51±0.10ab116.98*G2/M 19.84±2.11 16.18±0.62 9.93±1.82ab273.62*
2.2.5 转染后BMSCs增殖情况 除转染1 d时各组MTT A490值差异无统计学意义外,之后其余时点转染组MTT A490值均低于CON组和空载体组(均P<0.05),CON组与空载体组比较差异均无统计学意义,见图8。

Fig.8 The cell proliferation after transfection in three groups图8 基因转染后3组细胞增殖情况
3 讨论
目前在基因转染研究中应用较多的是质粒载体和病毒载体[6-7],本实验从经济与安全角度考虑,采用非病毒载体作为外源性基因的表达载体即携带有绿色荧光蛋白(green fluorescent protein,GFP)基因的质粒用于转染,基因测序结果显示该序列正确插入质粒载体pEGFP-N1中,构建的质粒符合实验设计标准。且行BMSCs瞬时转染48 h后,转染组转染效率可达60%,认定转染比较成功。
本课题组前期研究发现,BMSCs在诱导剂作用下向神经样细胞分化过程中影响Notch信号通路相关基因和蛋白的表达[5]。为研究在Notch信号通路中具有重要作用的Notch1蛋白在BMSCs增殖分化中的作用,笔者通过构建Notch1(NICD)高表达质粒,并转染BMSCs从而达到Notch1胞内段表达型增高,以探讨这条信号通路起点的作用。结果发现,转染48 h后,转染组Notch1、GFAP基因相对表达量均明显高于CON组和空载体组,空载体组与CON组无明显差异,且各组间NSE基因表达也无明显差异;Western Blotting的结果也与此一致。提示转染NICD基因的BMSCs可能具有向神经胶质细胞诱导分化的倾向,而不具有向神经元诱导分化的倾向。已有研究发现,高表达Notch信号具有向神经胶质化方向诱导的作用:(1)Notch的细胞内结构NICD片段能直接活化GFAP启动子[8]。(2)Notch蛋白通过Hes因子的作用间接或直接地促进星形胶质细胞的生成[9]。(3)活化型转录调节因子(Ngn1、Ngn2、Ngn3等)参与皮质祖细胞向神经元的特化,但其缺少将使皮质祖细胞变为星形胶质细胞[10],而Notch蛋白的高表达具有抑制活化型转录调节因子的作用。以上研究推测,Notch胞内信号活化,NICD转运到细胞核与DNA结合蛋白CSL结合,可激活Hes基因表达,Hes表达水平增高可使Mash和Ngns活性降低,从而促进前体细胞向星形胶质细胞分化。
BMSCs转染48 h后,活细胞比率、早期凋亡率及晚期凋亡率与CON组和空载体组比较,转染组存活细胞比率下降,早期细胞凋亡比率、晚期细胞凋亡比率均升高。MTT A490检测发现,转染组细胞生长曲线随时间变化逐渐降低,而空载体组和CON组比较无明显差异。同时,细胞一般状态观察发现转染后的BMSCs存在生存期较短的现象,这一方面可能由于转染试剂的影响;另一方面可能由于存在高表达NICD使得Notch信号活化,有证据显示,Notch信号活化可通过P53凋亡途径诱导细胞的凋亡[11],同时外源性活化Notch信号可以促使骨髓间充质干细胞提前衰老,抑制细胞的增殖能力[12]。笔者推测转染组细胞处于分化状态,可能与Notch信号对多潜能干细胞的定向分化和自身复制具有决定性的调控作用有关。然而,目前这些研究多停留在神经形态特征和神经细胞标志物水平上,而缺乏生物学功能特性相关的证据,目前还没有确切实验能够证明诱导后的神经细胞具有神经生理功能,因此许多学者将这类细胞称为“神经样细胞”。
综上所述,高表达Notch1(NICD)基因可以在一定程度上诱导BMSCs凋亡、抑制其增殖,且表现诱导向神经胶质样细胞分化趋势。
[1]Liu R,Yang Y,Yan X,et al.Abnormalities in cytokine secretion from mesenchymal stem cells in psoriatic skin lesions[J].Eur J Dermatol,2013,23(5):600-607.doi:10.1684/ejd.2013.2149.
[2]Crane JL,Cao X.Bone marrow mesenchymal stem cells and TGF-β signaling in bone remodeling[J].J Clin Invest,2014,124(2):466-472.doi:10.1172/JCI70050.
[3]Carvalho FL,Simons BW,Eberhart CG,et al.Notch signaling in prostate cancer:A moving target[J].Prostate,2014,74(9):933-945. doi:10.1002/pros.22811.
[4]Wang S,Kan Q,Sun Y,et al.Caveolin-1 regulates neural differentiation of rat bone mesenchymal stem cells into neurons by modulating Notch signaling[J].Int J Dev Neurosci,2013,31(1):30-35.doi: 10.1016/j.ijdevneu.2012.09.004.
[5]Du HY,Li DN,Fu HY,et al.Effect of rehmannia glutinosa polysaccharide on Notch signal pathway in rat bone marrow mesenchymal stem cells during differentiation into neuron-like cells in vitro[J]. Journal of Shandong University(Health Science),2013,51(12):1-6. doi:10.6040/j.issn.1671-7554.0.2013.402.[杜红阳,李东宁,付海燕,等.地黄多糖诱导大鼠BMSCs向神经样细胞分化中对Notch信号通路的影响[J].山东大学学报(医学版),2013,51(12):1-6.]
[6]Wu R,Tang Y,Zang W,et al.MicroRNA-128 regulates the differentiation of rat bone mesenchymal stem cells into neuron-like cells by Wnt signaling[J].Mol Cell Biochem,2014,387(1-2):151-158. doi:10.1007/s11010-013-1880-7.
[7]Cui H,Yi Q,Feng J,et al.Mechano growth factor E peptide regulates migration and differentiation of bone marrow mesenchymal stem cells[J].J Mol Endocrinol,2014,52(2):111-120.doi:10.1530/JME-13-0157.
[8]Muranishi Y,Terada K,Inoue T,et al.An essential role for RAX homeoprotein and NOTCH-HES signaling in Otx2 expression in embryonic retinal photoreceptor cell fate determination[J].J Neurosci, 2011,31(46):16792-16807.doi:10.1523/JNEUROSCI.3109-11.2011.
[9]Kim M,Park YK,Kang TW,et al.Dynamic changes in DNA methylation and hydroxymethylation when hES cells undergo differentiation toward a neuronal lineage[J].Hum Mol Genet,2014,23(3):657-667.doi:10.1093/hmg/ddt453.
[10]Ille F,Atanasoski S,Falk S,et al.Wnt/BMP signal integration regulates the balance between proliferation and differentiation of neuroepithelial cells in the dorsal spinal cord[J].Dev Biol,2007,304(1): 394-408.
[11]El Khatib M,Bozko P,Palagani V,et al.Activation of Notch signaling is required for cholangiocarcinoma progression and is enhanced by inactivation of p53 in vivo[J].PLoS One,2013,8(10):e77433.doi: 10.1371/journal.pone.0077433.
[12]Xie J,Wang W,Si JW,et al.Notch signaling regulates CXCR4 expression and the migration of mesenchymal stem cells[J].Cell Immunol,2013,281(1):68-75.doi:10.1016/j.cellimm.2013.02.001.
(2014-05-13收稿 2014-05-29修回)
(本文编辑 陈丽洁)
Construction of Notch1(NICD)Eukaryotic Expression Vector and Its Influence on the Proliferation and Differentiation of Rat Bone Marrow Mesenchymal Stem Cells in vitro
DU Hongyang1,LI Dongning1,FU Haiyan2△,BAO Cuifen3,QIN Shujian3
1 Department of Dermatology,2 ICU in the First Affiliated Hospital of Liaoning Medical University,3 Department of Anatomy, Liaoning Medical University,Jinzhou 121001,China△
E-mail:4197123@163.com
ObjectiveTo investigate the effect of construct the Notch1(NICD)eukaryotic expression vector on the proliferation and differentiation of rat bone marrow mesenchymal stem cells(BMSCs)in vitro.MethodsRat BMSCs were experimented as the object.NICD eukaryotic expression vector was constructed.pEGFP-N1-NICD expressing plasmids were used to transfect BMSCs.The study included control group(CON group),empty vector group(VEC group)and the transfection group(TRA group).After 48-hour transfection,BMSCs were observed for general morphology.The protein expressions of NSE,GFAP and Notch1 were detected by real-time PCR and Western blotting assay respectively.The apoptosis,cycle distribution and cell proliferation were evaluated by flow cytometry and MTT assay.ResultsThe DNA sequencing confirmed that the pEGFP-N1-NICD recombinant plasmid was successfully constructed,and both VEC group and TRA group expressed green fluorescence after 48-hour transfection.The relative expression levels of Notch1 and GFAP mRNA and protein were significantly higher in TRA group than those in VEC group and CON group(P<0.05),and there was no significant difference between VEC group and CON group.After 48-hour transfection,the ratio of living cells was significantly lower in TRA group than that of CON group and VEC group,and the early apoptotic rate and late apoptotic rate were significantly higher in TRA group than those of CON group and VEC group(P<0.05).The late apoptotic rate was significantly higher inVEC group than that of CON group.The proportion of G1/G0 cells was significantly higher in TRA group than that of CON group and VEC group,but S and G2/M cells were significantly lower(P<0.05).The value of growth curve was gradually decreased in TRA group than that of CON group and VEC group(P<0.05).ConclusionThe high expression of NICD gene might induce apoptosis of BMSCs,inhibit the proliferation in part,and induce into glial-like cell differentiation.
cell proliferation;cell differentiation;transfection;glial fibrillary acidic protein;phosphopyruvate hydratase;Notch signal pathway;bone mesenchymal stem cells;induction;Notch1(NICD)
R349.5
A
10.3969/j.issn.0253-9896.2014.09.009
国家自然科学基金面上项目(31170930);辽宁省科技厅自然科学基金计划项目(2013022059);辽宁医学院青年科技启动基金项目(Y2011Z010)
1辽宁医学院附属第一医院皮肤科(邮编121001),2重症医学科;3辽宁医学院解剖学教研室
△通讯作者 E-mail:4197123@163.com
