CXCR7对胃癌生长、黏附及侵袭的影响
2014-07-05娜辛艳刘炜张传山战忠利
张 娜辛 琪 杨 艳刘 炜张传山战忠利
CXCR7对胃癌生长、黏附及侵袭的影响
张 娜1辛 琪2△杨 艳1刘 炜1张传山2战忠利3
目的 研究CXCR7在胃癌组织中的表达,及其与胃癌生长、黏附及侵袭的关系。方法收集160例胃腺癌患者的癌组织(胃癌组)和30例正常胃组织(对照组),采用免疫组化方法检测CXCR7、Survivin、CD44v6、基质金属蛋白酶(MMP)-3在胃腺癌和正常组织中的表达,并分析其相关性。结果CXCR7在胃腺癌组织中的表达明显高于对照组(P<0.05),并且其在胃癌中的表达则因胃癌肿块直径的大小、浸润深度、是否有淋巴结转移及临床分期不同而不同,差异有统计学意义(P<0.05)。在胃癌组中CXCR7表达与Survivin、CD44v6及MMP-3呈正相关。结论CXCR7通过抗凋亡因子Survivin参与胃癌的生长,在胃癌的黏附及侵袭过程中通过CD44v6及MMP-3发挥作用,并可能参与胃癌的淋巴结转移。
胃肿瘤;受体,CXCR;趋化因子CXCL12;基质金属蛋白酶3;抗原,CD44;免疫组织化学;生存素;CD44v6
基质细胞衍生因子-1(stromal cell-derived factor 1,SDF-1)亦称CXCL12,是趋化因子CXC亚家族的一个成员,可刺激肿瘤细胞增殖、分离、迁移、浸润和转移。一直以来,CXCR4被认为是CXCL12的唯一受体,但近来研究发现CXCL12存在另一个受体CXCR7,CXCR7在多种肿瘤中表达,参与细胞增殖、生长、黏附,并促进肿瘤细胞的生长、浸润和转移[1-2]。但其在胃癌中的研究国内外尚少见报道。本研究采用免疫组化方法观察CXCR7在胃癌组织中的表达以及与临床病理特征的关系,同时选取与肿瘤生长、浸润、黏附有关的凋亡抑制因子生存素(Survivin)、基质金属蛋白酶(MMP)-3、基质黏附分子CD44v6进行研究,比较它们与CXCR7的关系,以期进一步阐明胃癌生长、浸润的生物学机制。
1 对象与方法
1.1 研究对象 选取2009年7月—2011年7月在天津市肿瘤医院行胃癌根治手术的160例患者石蜡标本(胃癌组)。全部患者均经HE切片复读确认,术前未经任何针对肿瘤的治疗。按照Lauren’s分型,160例胃癌中肠型胃癌120例(包括高中分化管状腺癌78例,低分化管状腺癌42例),弥漫型胃癌40例(均为印戒细胞癌)。同时选取天津市大港医院因胃良性病变行胃次全切标本30例作为对照组。收集患者临床病理资料,包括性别、年龄、肿瘤大小、肿瘤分化程度、肿瘤浸润深度、有无淋巴结转移和肿瘤临床分期。
1.2 试剂 CXCR7多克隆抗体购自美国dako公司;兔抗人Survivin多克隆抗体购自北京博奥森生物技术有限公司;兔抗人CD44v6多克隆抗体和鼠抗人MMP-3单克隆抗体、快捷型酶标羊抗鼠/兔IgG聚合物及二氨基联苯胺(DAB)酶底物显色试剂盒等均购自北京中杉金桥生物技术有限公司。
1.3 免疫组化方法 所有标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm连续切片。采用免疫组化SP法检测对照组正常胃黏膜及胃癌组织中 CXCR7、Survivin、CD44v6及MMP-3的表达。
1.4 结果判断 CXCR7、Survivin、CD44v6及MMP-3阳性结果判断标准:细胞膜或细胞质内出现淡黄至棕黄色染色为阳性细胞,随机读取5个高倍镜视野(×400)进行判断。阳性细胞范围:无阳性细胞计0分,1%~29%计1分,30%~59%计2分,≥60%计3分。染色强度:阴性计0分,轻度淡黄色染色计1分,中度棕黄色染色计2分,强染色深棕黄色计3分。按阳性细胞范围×染色强度评分,<2分为阴性,≥2分为阳性。
1.5 统计学方法 应用SPSS 16.0统计软件包,计数资料比较用χ2检验,相关性分析用Spearman等级相关,P<0.05为差异有统计学意义。
2 结果
2.1 CXCR7在对照组及胃癌组中的表达 对照组胃黏膜上皮中少见CXCR7阳性表达,纤维母细胞等少见表达,脉管内皮细胞可见少量表达。胃癌细胞质内见密集分布的棕黄色或深棕黄色粗颗粒或团块状阳性表达物,肿瘤间质纤维母细胞广泛棕黄色或深棕黄色表达,并且肿瘤中的小血管及其浸润边缘的扩张的血管均有广泛强阳性表达,见图1~3。对照组中正常胃黏膜CXCR7表达的阳性率(2/30)低于胃癌组(126/160),差异有统计学意义(χ2=59.712,P<0.01)。
2.2 CXCR7、CD44v6、MMP-3和Survivin蛋白与胃癌生物学行为的关系 CXCR7在肿瘤大小、Lauren’s分型、浸润深度、淋巴结转移和临床分期不同患者中阳性表达差异有统计学意义,而在性别、年龄、分化程度不同患者中阳性表达差异无统计学意义。CD44v6在Lauren’s分型、分化程度、淋巴结转移及临床分期不同患者中阳性表达差异有统计学意义,而在性别、年龄、肿瘤大小、浸润深度不同患者中阳性表达差异无统计学意义。MMP-3在分化程度、浸润深度、淋巴结转移、临床分期不同患者中阳性表达差异有统计学意义,而在性别、年龄、Lauren’s分型、肿瘤大小不同患者中阳性表达差异无统计学意义。Survivin在肿瘤大小、淋巴结转移、临床分期不同患者中阳性表达差异有统计学意义,而在性别、年龄、分化程度、Lauren’s分型、浸润深度不同患者中阳性表达差异无统计学意义,见表1。
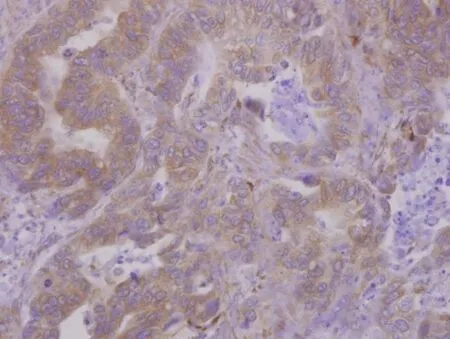
Fig.1 The expression of CXCR7 in the gastric adenocarcinoma cells(SP,×400)图1 CXCR7在胃腺癌细胞中表达(SP,×400)
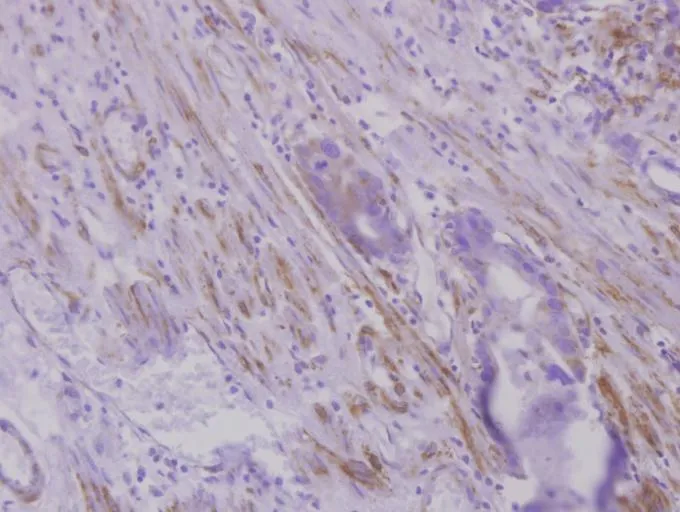
Fig.2 The expression of CXCR7 in the fibroblastic cells(SP,×200)图2 CXCR7在纤维母细胞中表达(SP,×200)
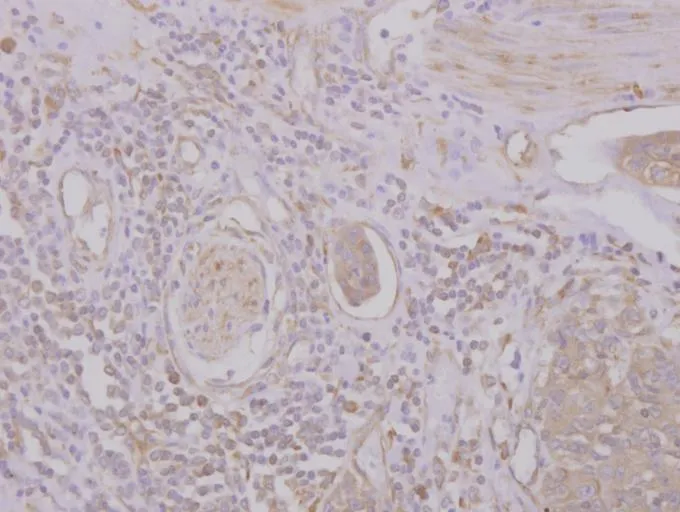
Fig.3 The expression of CXCR7 in the vascular endothelium(SP,×100)图3 CXCR7在间质血管中表达(SP,×100)
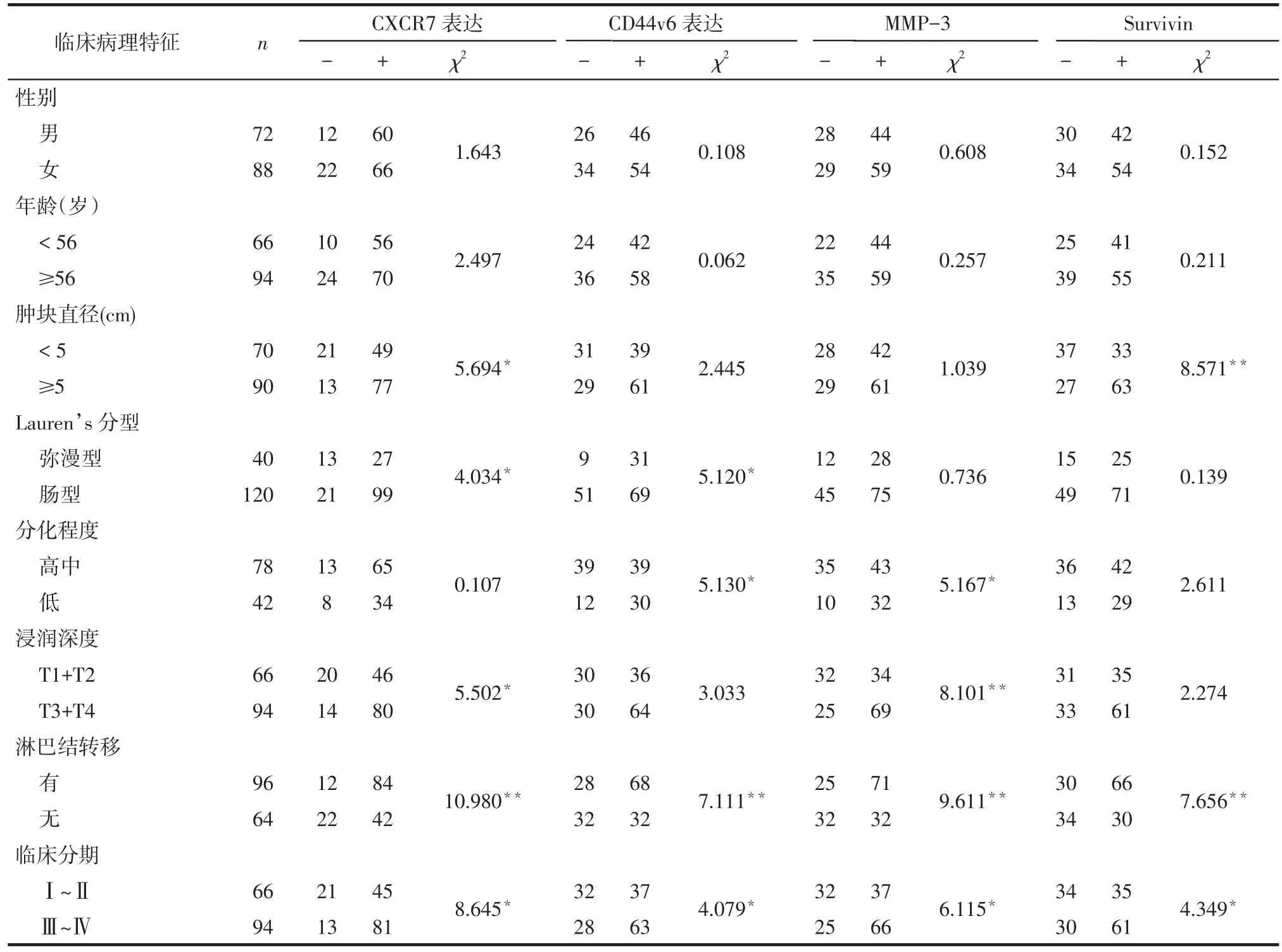
Tab.1 The relationship between expression levels of CXCR7,CD44v6,MMP-3 and Survivin in gastric carcinoma tissues with clinical pathological features表1 CXCR7、CD44v6、MMP-3和Survivin蛋白与临床病理特征的关系
2.3 胃癌组织中 CXCR7与CD44v6、MMP-3和Survivin表达的相关性 CXCR7与CD44v6、MMP-3 和Survivin表达呈明显正相关,见表2。
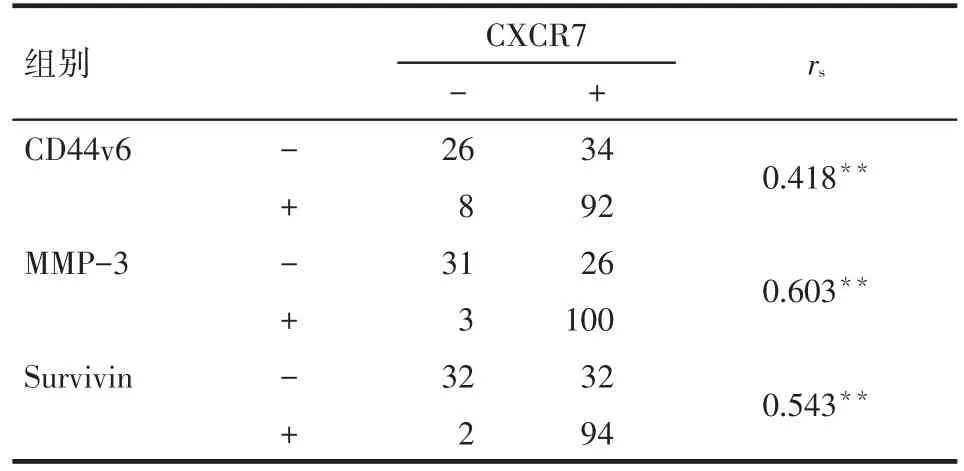
Tab.2 The relationship between CXCR7 with CD44v6,MMP-3 and Survivin in gastric cancer表2 胃癌组织中CXCR7与CD44v6、MMP-3、Survivin表达的关系
3 讨论
肿瘤的侵袭转移是一个多步骤的复杂过程,趋化因子CXCL12在这一进程中发挥着重要作用。CXCR7是近年来发现的独立于CXCR4的CXCL12受体,研究表明,CXCR7在多种肿瘤中表达,并在侵袭转移过程中起重要作用[1-3]。本研究显示胃腺癌中CXCR7表达明显高于正常胃组织,且CXCR7在直径≥5 cm的肿瘤中与直径<5 cm肿瘤中的表达存在差异,提示在胃癌生长中CXCR7有一定作用。有研究认为CXCR7能够激活AKT信号通路抑制肿瘤细胞的凋亡,增强肿瘤细胞的存活能力[1]。Bakondi等[4]的研究发现脑组织肿瘤中CXCR7通过抑制凋亡发挥作用。Survivin是近年发现的一种新的凋亡抑制因子。本研究显示胃腺癌中Survivin与CXCR7的表达呈正相关,提示在胃癌增殖生长过程CXCR7通过调控Survivin抑制胃癌细胞的自身凋亡,在癌细胞生长和增殖过程中起重要的促进作用。CXCR7能够增强肿瘤细胞的黏附能力,使肿瘤细胞黏附到纤维基质和内皮细胞上[5]。前列腺癌细胞中高表达CXCR7能够通过上调黏附分子CD44和钙黏蛋白11(CDH11)来促进肿瘤细胞与人真皮微血管内皮细胞(HDMEC)的黏附和侵袭[6]。本研究结果显示在胃癌组织中CD44v6与CXCR7表达呈正相关,提示胃癌组织中CXCR7通过调控CD44v6介导肿瘤细胞的黏附,并促进其侵袭。CXCR7能调控多种MMP,包括MMP-3、MMP-10和MMP-11的表达水平,增强肿瘤细胞的侵袭能力。Zabel等[7]研究认为在乳腺癌中表达CXCR7的肿瘤细胞能够促进MMP-3的分泌,从而促进肿瘤细胞基质降解。本研究显示胃癌组织中CXCR7与MMP-3表达呈正相关,与在肝癌中的研究结果一致[8]。
以上结果提示CXCL12/CXCR7生物轴可通过调节多级进程参与胃癌的生长浸润和转移。CXCR7 与CXCL12结合后,调节Survivin蛋白分泌,抗肿瘤细胞凋亡,促进肿瘤细胞增殖。CXCL12/CXCR7通过调节CD44v6诱导肿瘤细胞黏附到血管内皮及其周围组织。通过促进MMP-3的分泌,导致肿瘤细胞基质降解,使肿瘤细胞获得向周围基质侵袭及其跨血管内皮的功能。
体外实验中,利用CXCL12刺激CXCR7可以促使CXCR7进入细胞膜,并以配体依赖途径通过β抑制蛋白-2激活丝裂原活化蛋白激酶的级联反应[9]。Uto-Konomi等[10]的研究表明CXCR7与CXCR4在细胞上共表达时可能形成异二聚体,CXCR7干扰CXCR4介导的G蛋白活动和Ca2+诱导CXCR4/Gi蛋白复合体结构性重排,从而影响之后的级联信号传导。因此推断,CXCL12/CXCR7轴作用可能是由它们自身不同寻常信号通路介导或是通过与CXCR4形成异源二聚体调节CXCR4的活性来介导的。目前CXCL12/CXCR4轴和CXCL12/CXCR7轴信号传导通路及其级联信号通路与肿瘤发生发展的分子机制的研究还处于基础实验阶段,信号通路的具体情况,两条信号传导通路之间究竟是独立发挥作用还是协同作用都将是今后研究的重点。
[1]Hattermann K,Held-Feindt J,Lucius R,et al.The chemokine receptor CXCR7 is highly expressed in human glioma cells and mediates antiapoptotic effects[J].Cancer Res,2010,70(8):3299-3308.
[2]Grymula K,Tarnowski M,Wysoczynski M,et al.Overlapping and distinct role of CXCR7-SDF-1/ITAC and CXCR4-SDF-1 axes in regulating metastatic behavior of human rhabdomyosarcomas[J].Int J Cancer,2010,127(11):2554-2568.
[3]Totonchy JE,Osborn JM,Botto S,et al.Aberrant proliferation in CXCR7+endothelial cells via degradation of the retinoblastoma protein[J].PLoS One,2013,8(7):69828-69839.
[4]Bakondi B,Shimada IS,Peterson BM,et al.SDF-1α secreted by human CD133-derived multipotent stromal cells promotes neural progenitor cell survival through CXCR7[J].Stem Cells Dev,2011,20 (6):1021-1029.
[5]Dai X,Tan Y,Cai S,et al.The role of CXCR7 on the adhesion,proliferation and angiogenesis of endothelial progenitor cells[J].J Cell Mol Med,2011,15(6):1299-1309.
[6]Wang J,Shiozawa Y,Wang J,et al.The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1 in prostate cancer[J].J Bio Chem,2008,283(7):4283-4294.
[7]Zabel BA,Miao Z,Lai NL,et al.CXCR7 protein expression correlates with elevated MMP-3 secretion in breast cancer cells[J].Oncol Lett,2010,1(5):845-847.
[8]Zheng K,Li HY,Su XL,et al.Chemokine receptor CXCR7 regulates the invasion,angiogenesis and tumor growth of human hepatocellular carcinoma cells[J].J Exp Clin Cancer Res,2010,29(31):2-14.
[9]Rajagopal S,Kim J,Ahn S,et al.Beta-arrestin-but not G protein-mediated signaling by the“decoy”receptor CXCR7[J].Proc Natl Acad Sci USA,2010,107(2):628-632.
[10]Uto-Konomi A,McKibben B,Wirtz J,et al.CXCR7 agonists inhibit the function of CXCL12 by down-regulation of CXCR4[J].Biochem Biophys Res Commun,2013,4(31):772-776.
(2013-12-24收稿 2014-04-28修回)
(本文编辑 李国琪)
The Role of CXCR7 on Proliferation,Adhesion and Invasion of Gastric Cancer
ZHANG Na1,XIN Qi2△,YANG Yan1,LIU Wei1,ZHANG Chuanshan2,ZHAN Zhongli3
1 Department of Pathology,Dagang Hospital,Tianjin Binhai New Area,Tianjin 300270;2 Department of Pathology,Tianjin Third Central Hospital;3 Department of Pathology,Tiajin Cancer Institute&Hospital△
E-mail:Xinqi19820204@126.com
ObjectiveTo investigate the expression of CXCR7 in gastric carcinoma tissues and the role of CXCR7 in tumor growth,adhesion and invasion of gastric cancer.MethodsThe expression levels of CXCR7,Survivin,CD44v6 and matrix metalloproteinase(MMP)-3 were detected by immunnohistochemistry method in gastric cancer specimens came from 160 patients(gastric cancer group)and 30 specimens of normal gastric tissues(control group).ResultsThe expression of CXCR7 protein was significantly higher in gastric cancer group than that of control group(P<0.05).The positive CXCR7 staining was significantly different with tumor size,depth of invasion,lymph node metastasis and clinical staging(P<0.05). CXCR7 expression was positively correlated with Survivin,CD44v6 and MMP-3.ConclusionCXCR7 might take part in progression of gastric cancer by anti-apoptosis(Survivin).CXCR7 might take part in the lymph node metastasis of gastric cancer and mediate the adhesion and invasion by CD44v6 and MMP-3.
stomach neoplasms;receptors,CXCR;chemokine CXCL12;matrix metalloproteinase 3;antigens,CD44; immunohistochemistry;survivin;CD44v6
R735.2
A
10.3969/j.issn.0253-9896.2014.09.006
天津市滨海新区卫生局医药卫生科技项目(2011BHKY021);天津市滨海新区大港区域社会发展科技项目(20120211);天津市滨海新区科技发展战略研究计划项目(2012DK15W007)
1天津市滨海新区大港医院病理科(邮编300270);2天津市第三中心医院病理科;3天津市肿瘤医院病理科
△通讯作者 E-mail:Xinqi19820204@126.com
