胱硫醚β-合酶/胱硫醚γ-裂解酶-硫化氢体系小干扰RNA对大鼠正常肝细胞株BRL凋亡的影响
2014-07-05李彦敏郭雪西章明放
闫 骏 李彦敏 郭雪西 章明放
胱硫醚β-合酶/胱硫醚γ-裂解酶-硫化氢体系小干扰RNA对大鼠正常肝细胞株BRL凋亡的影响
闫 骏 李彦敏 郭雪西 章明放△
目的 探讨内源性胱硫醚β-合酶(CBS)/胱硫醚γ-裂解酶(CSE)-硫化氢(H2S)体系在生理状态肝细胞凋亡中的作用及其机制。方法培养大鼠正常肝细胞株BRL。小干扰RNA(siRNA)序列筛选:设阴性siRNA序列转染组(对照组)、CBS siRNA序列转染组(CBS 1~3序列组)和CSE siRNA序列转染组(CSE 1~3序列组),转染24、48 h;siRNA转染后检测细胞凋亡:设阴性对照组、溶剂对照组、CBS siRNA组、CSE siRNA组、(CBS+CSE)siRNA组,作用时间为转染后0、4、8、12、24 h;凋亡机制探讨:设阴性对照组、CBS siRNA组、CSE siRNA组、(CBS+CSE)siRNA组,作用时间为转染后4、8、12、24 h;每组均4个平行样。RT-PCR、Western blot检测BRL细胞中CBS、CSE mRNA和蛋白的表达,siRNA基因静默CBS、CSE,去蛋白法检测H2S生成,Hoechst荧光染色、流式细胞术检测BRL细胞凋亡,荧光染色检测线粒体膜电位(MMP)变化,Western blot检测胞浆内细胞色素C(Cyt C)和激活型caspase 3 (cleaved-caspase 3)蛋白表达变化。结果BRL细胞株存在CBS、CSE表达。CBS/CSE siRNA转染后,细胞内源性H2S生成降低,凋亡细胞数量和细胞凋亡率随时间延长而逐渐增加,BRL细胞上清乳酸脱氢酶(LDH)活性均未见明显变化,MMP下降,胞浆内Cyt C蛋白表达上调,cleaved-caspase3蛋白表达上调。结论抑制内源性H2S体系可引起生理状态肝细胞凋亡,机制可能部分涉及凋亡线粒体途径。
胱硫醚β合酶;胱硫醚γ裂合酶;硫化氢;RNA,小分子干扰;细胞凋亡;BRL细胞
一氧化氮(NO)、一氧化碳(CO)相继成为气体信号分子的研究热点之后,硫化氢(H2S)作为新发现的第三种气体信使分子,其生物学效应逐渐得到人们的重视[1]。研究表明内源性H2S主要是在胱硫醚β-合成酶(cystathionine β-synthase,CBS)、胱硫醚γ-裂解酶(cystathionine γ-lyase,CSE)以及半胱氨酸转移酶等的催化作用下产生,少数由含硫氨基酸代谢生成[2]。CBS和CSE是H2S生成的主要限速酶,其分布存在组织差异性[3]。肝脏是机体同时分布有CBS、CSE的少数器官之一,也是机体H2S的主要代谢器官[4]。肝脏是体内发挥生物转化、新陈代谢的主要器官,H2S在参与肝细胞调节胆汁分泌、拮抗肝缺血/再灌注损伤等病理生理过程中发挥了重要作用[5-6]。然而H2S介导肝细胞凋亡,尤其是生理状态下的凋亡机制尚不明确。本实验选取培养大鼠正常肝细胞株BRL,模拟肝细胞体内生理状态,观察肝细胞中CBS-H2S、CSE-H2S体系分布情况,检测内源性H2S生成,并利用小干扰 RNA(small interfering RNA,siRNA)技术基因沉默CBS-H2S、CSE-H2S体系,旨在探讨CBS-H2S与CSE-H2S体系在生理状态下肝细胞凋亡中的作用及其作用机制。
1 材料与方法
1.1 实验材料 大鼠正常肝细胞株BRL购自中国科学院上海细胞研究所。RPMI 1640细胞培养液及胎牛血清、Lipo 2000TMRNAiMAX转染试剂盒、CBS/CSE逆转录PCR引物合成及反应体系试剂盒均购自Invitrogen公司。siRNA序列由Invitrogen公司设计并合成。兔抗大鼠CBS、CSE一抗、兔抗大鼠细胞色素C(cytochrome C,Cyt C)一抗、兔抗大鼠激活型caspase 3(cleaved-caspase 3)一抗、兔抗大鼠β-tubulin一抗(内参)及辣根酶标记山羊抗兔IgG二抗均购自Santa Cruz公司。ProteoJETTM胞浆蛋白抽提试剂盒购自Fermentas公司。线粒体膜电位(MMP)检测试剂盒、细胞凋亡-Hoechst染色试剂盒与AnnexinⅤ-FITC/PI凋亡检测试剂盒均购自Calbiochem公司。
1.2 方法
1.2.1 细胞培养与分组处理 BRL细胞接种于含10%胎牛血清的RPMI 1640培养液中,置于含5%CO2、37℃恒温培养箱中培养。(1)siRNA序列的筛选。操作方法参照文献[7]进行,实验设阴性siRNA序列转染组(对照组)、CBS siRNA序列转染组(CBS 1~3序列组)和CSE siRNA序列转染组(CSE-siRNA 1~3序列组),分别转染24、48 h,见表1。(2)检测CBS/ CSE siRNA转染后对生理状态BRL细胞凋亡的影响。实验设阴性对照组、溶剂对照组、CBS siRNA组、CSE siRNA组和(CBS+CSE)siRNA组。根据Lipo 2000TMRNAiMAX转染试剂说明书进行转染,转染成功后,继续实验时间分别为0、4、8、12、24 h。(3)探讨CBS/CSE siRNA转染BRL细胞可能涉及的凋亡机制。实验设阴性对照组、CBS siRNA组、CSE siRNA组和(CBS+CSE)siRNA组,实验时间为4、8、12、24 h。各组均设4个平行样。

Tab.1 The siRNA sequences of CBS,CSE and negative control groups表1 CBS、CSE、阴性对照siRNA序列
1.2.2 RT-PCR检测 BRL细胞中CBS/CSE mRNA的表达 Trizol一步法提取细胞总RNA,引物序列见表2。扩增后以琼脂糖凝胶电泳鉴定PCR产物,以扩增条带的有无作为BRL细胞中是否存在CBS/CSE基因表达的依据。
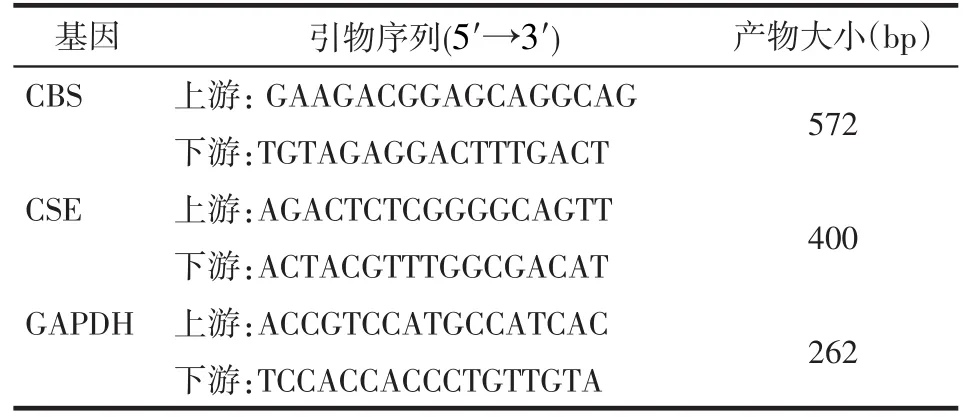
Tab.2 The RT-PCR primer sequences of CBS, CSE and GAPDH表2 CBS、CSE、GAPDH的RT-PCR引物序列
1.2.3 Western Blot检测目的蛋白的表达水平 BRL细胞胞浆蛋白的提取按照试剂盒说明书进行。蛋白浓度定量后,行SDS-PAGE。待测条带电泳至分离胶目标区域时,电转至PVDF膜。抗体稀释度:一抗为 1∶400~1∶600,二抗为1∶2 000~1∶2 500。以电化学凝胶成像系统显影,并记录目标蛋白条带光密度值,以β-tubulin为内参,反映目标蛋白CBS/ CSE、Cyt C、cleaved-caspase 3相对表达量。
1.2.4 内源性H2S生成的检测 根据去蛋白的方法[8-9]检测H2S生成变化。首先配制不同浓度的NaHS,建立H2S浓度标准曲线,得出直线回归方程:=0.003 185+0.000 061 89X,r= 0.998。0.1 mL待测标本加入至10%醋酸锌0.5 mL混匀,充分沉淀后,以30 mmol/L三氯化铁0.5 mL、20 mmol/L对苯二胺盐酸盐0.5 mL充分混匀、显色,以10%三氯醋酸1 mL沉淀蛋白,最后以蒸馏水补齐液体总体积至5 mL,6 000 r/min离心5 min,调定酶标仪波长670 nm,检测吸光度值并代入方程式,以得出待测液上清中H2S的含量。
1.2.5 细胞上清乳酸脱氢酶(LDH)释放检测 以850×g离心3 min收集待测细胞上清,检测样本200 μL;调定全自动生化仪吸光度波长450 nm,检测LDH活性。
1.2.6 MMP的检测 按照MMP检测试剂盒说明操作,预制BRL细胞爬片;满足实验条件时,细胞爬片以MitoCaptureTM和Buffer 1混合液孵育15 min;随后以Buffer 2清洗2次;封片处理后,在荧光显微镜下观察并记录红色荧光和绿色荧光的强度比值。
1.2.7 Hoechst染色法形态学检测细胞凋亡 预制BRL细胞爬片;细胞生长满足实验要求后,加入0.5 mL 75%乙醇,固定30 min;吸弃固定液,用PBS洗2遍,每次3 min;加入0.5 mL Hoechst 33258染色液,染色5 min;用PBS洗2遍,每次3 min;滴一滴抗荧光淬灭封片液于载玻片上,封片观察;荧光显微镜可检测到呈蓝色(RGB值:0、0、255)的细胞核,激发波长350 nm,发射波长460 nm。
1.2.8 细胞凋亡流式检测 实验细胞以0.25%胰酶消化、收集;洗涤细胞2次;加入500 μL的AnnexinⅤBinding Buffer悬浮细胞;加入5 μL AnnexinⅤ-FITC混匀后,加入5 μL Propidium Iodide,混匀避光、室温反应5 min;上机,流式细胞仪检测(Ex=488 nm;Em=530 nm)细胞凋亡率。
2 结果
2.1 大鼠正常肝细胞株BRL细胞中CBS和CSE基因与蛋白表达 扩增后琼脂糖凝胶电泳分别在572 bp和400 bp左右观察到与目标片段长度相符的荧光条带;CBS、CSE蛋白分子质量分别为63、45 ku,见图1。
2.2 CBS/CSE siRNA对BRL细胞内源性H2S生成的影响
2.2.1 siRNA序列筛选 转染24 h时,CBS 3序列组CBS蛋白和CSE蛋白表达均低于对照组(P<0.05);CBS siRNA抑制率最高为45.3%,CSE siRNA抑制率最高为52.3%。转染48 h时,各组间CBS、CSE蛋白表达差异均无统计学意义,见图2。
2.2.2 siRNA转染对BRL细胞H2S生成的影响 转染0、4 h时各组H2S差异均无统计学意义;转染8 h 时CSE siRNA组和(CBS+CSE)siRNA组的H2S低于阴性对照组,CBS siRNA组与阴性对照组差异无统计学意义;转染12、24 h时CBS siRNA组、CSE siRNA组和(CBS+CSE)siRNA组的H2S均低于阴性对照组(均P<0.05),见表3。
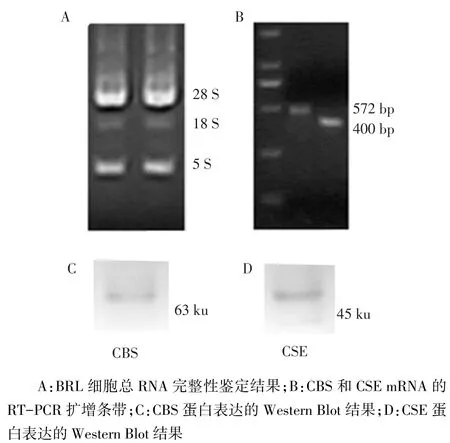
Fig.1 The basic expression of CBS/CSE gene and protein in physiological BRL cells图1 生理状态下BRL细胞CBS、CSE基因和蛋白的基础表达
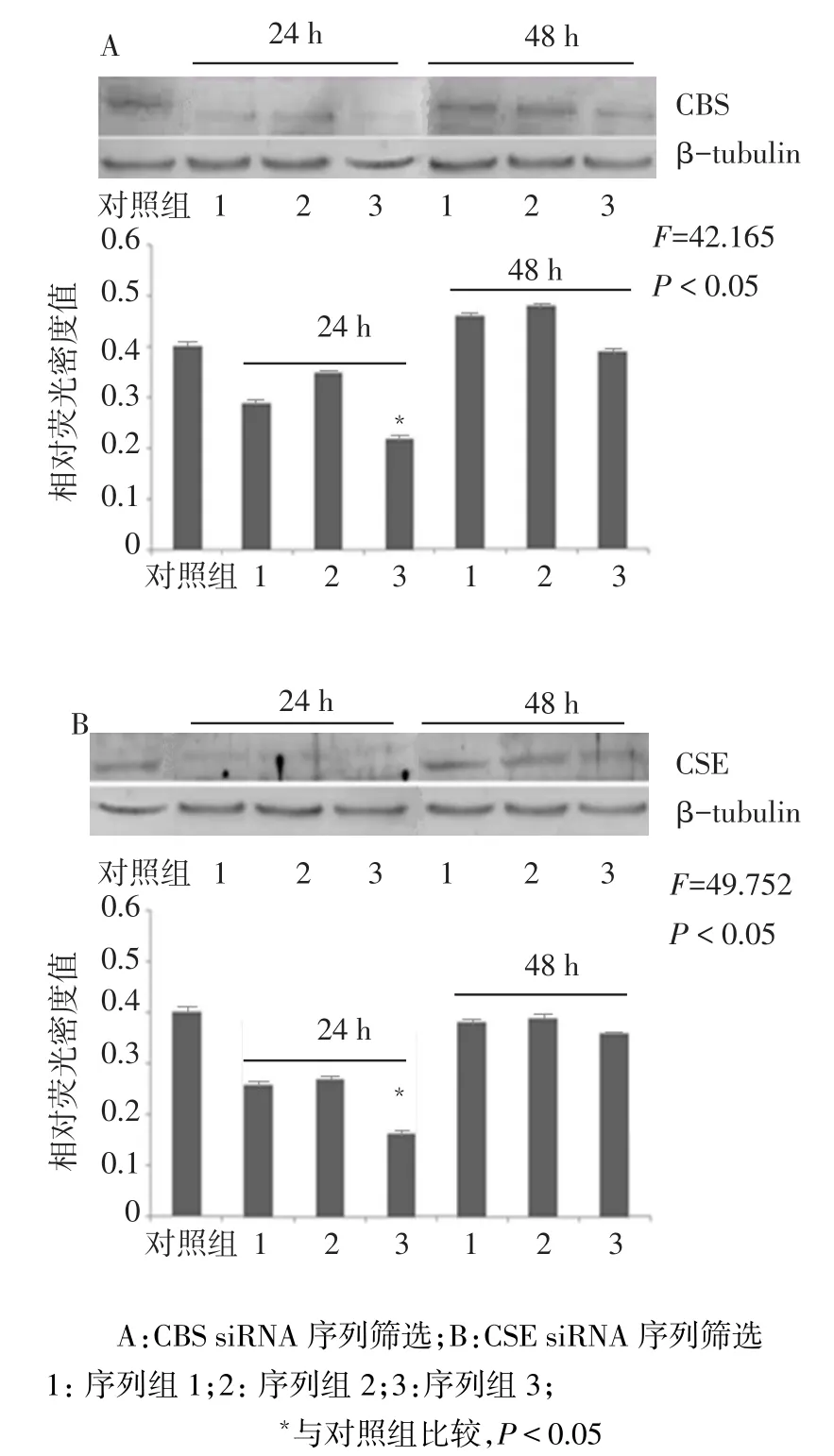
Fig.2 The screening experiment of CBS/CSE siRNA sequences图2 CBS/CSE siRNA序列筛选实验
Tab.3 Changes of endogenous H2S generation in BRL cells treated with siRNA表3 CBS/CSE siRNA转染BRL细胞内源性H2S生成变化 (n=4,μmol/L,±s)
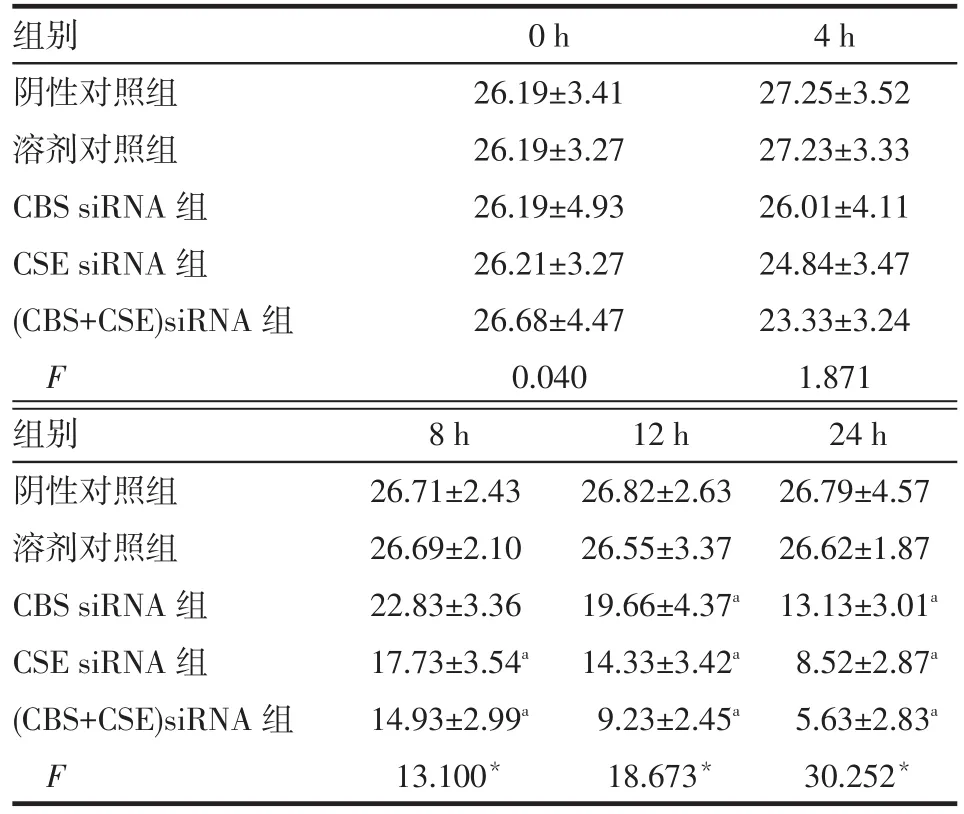
Tab.3 Changes of endogenous H2S generation in BRL cells treated with siRNA表3 CBS/CSE siRNA转染BRL细胞内源性H2S生成变化 (n=4,μmol/L,±s)
*P<0.05;a与阴性对照组比较,P<0.05
组别阴性对照组溶剂对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 0 h 26.19±3.41 26.19±3.27 26.19±4.93 26.21±3.27 26.68±4.47 0.040 4 h 27.25±3.52 27.23±3.33 26.01±4.11 24.84±3.47 23.33±3.24 1.871组别阴性对照组溶剂对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 8 h 26.71±2.43 26.69±2.10 22.83±3.36 17.73±3.54a14.93±2.99a13.100*12 h 26.82±2.63 26.55±3.37 19.66±4.37a14.33±3.42a9.23±2.45a18.673*24 h 26.79±4.57 26.62±1.87 13.13±3.01a8.52±2.87a5.63±2.83a30.252*
2.3 siRNA转染对BRL细胞凋亡的影响
2.3.1 siRNA转染对BRL细胞上清LDH活性的影响 CBS/CSE siRNA单独或联合转染BRL细胞后不同时点,BRL细胞上清LDH活性均未见明显变化(均P>0.05),见表4。
Tab.4 Changes of LDH content in culture supernatant of BRL cells treated with siRNA表4 CBS/CSE siRNA转染BRL细胞上清LDH活性变化 (n=4,U/L,±s)
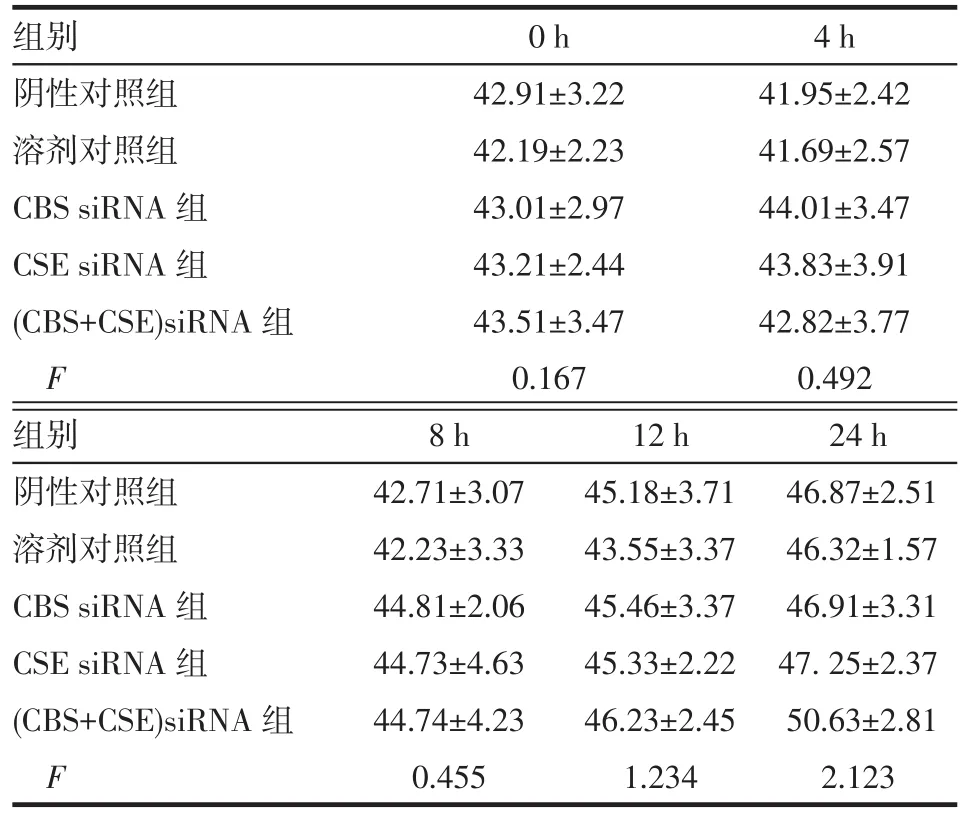
Tab.4 Changes of LDH content in culture supernatant of BRL cells treated with siRNA表4 CBS/CSE siRNA转染BRL细胞上清LDH活性变化 (n=4,U/L,±s)
均P>0.05
组别阴性对照组溶剂对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 0 h 42.91±3.22 42.19±2.23 43.01±2.97 43.21±2.44 43.51±3.47 0.167 4 h 41.95±2.42 41.69±2.57 44.01±3.47 43.83±3.91 42.82±3.77 0.492组别阴性对照组溶剂对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 8 h 42.71±3.07 42.23±3.33 44.81±2.06 44.73±4.63 44.74±4.23 0.455 12 h 45.18±3.71 43.55±3.37 45.46±3.37 45.33±2.22 46.23±2.45 1.234 24 h 46.87±2.51 46.32±1.57 46.91±3.31 47.25±2.37 50.63±2.81 2.123
2.3.2 细胞凋亡的形态学变化 CBS/CSE siRNA单独或联合转染BRL细胞后4 h即出现凋亡细胞,且随时间延长而出现凋亡细胞数量增多趋势。阴性对照和溶剂对照组均未见凋亡细胞,见图3。
2.3.3 细胞凋亡流式检测结果 除转染0 h时,各组BRL细胞凋亡率差异无统计学意义外,其余时点CBS siRNA组、CSE siRNA组和(CBS+CSE)siRNA组BRL细胞凋亡率均高于阴性对照组(均P<0.05),见表5。
Tab.5 Apoptosis variation of BRL cells treated with CBS/CSE siRNA表 5CBS/CSE siRNA转染后BRL细胞凋亡率变化(n=4,%,±s)
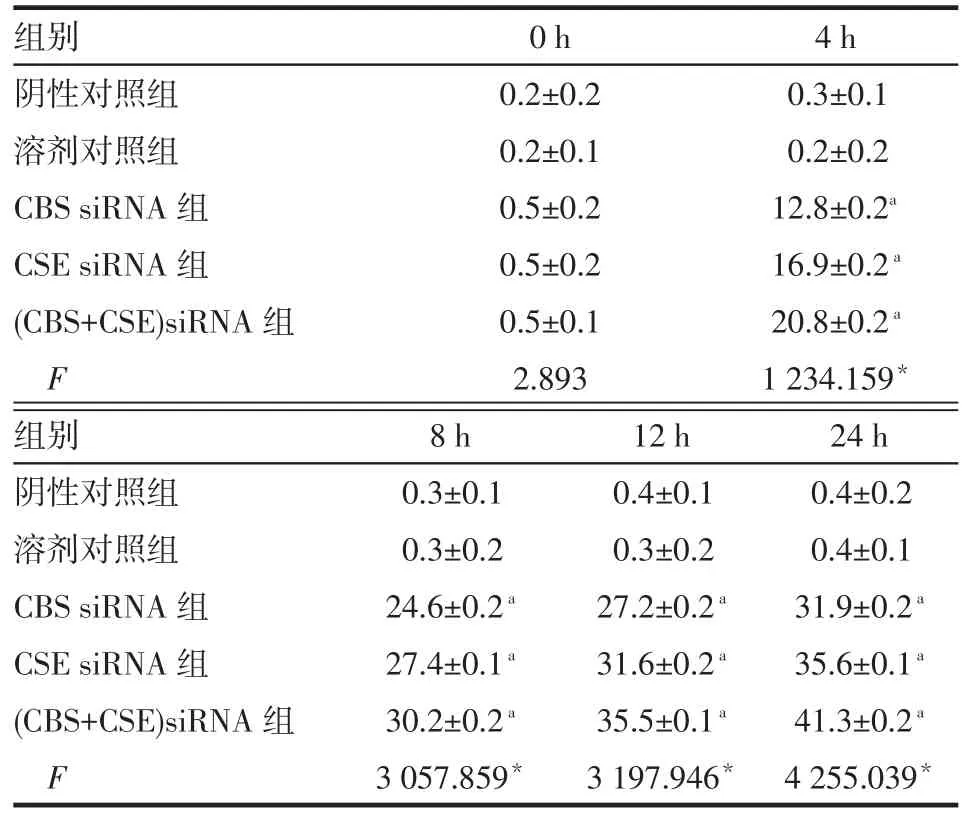
Tab.5 Apoptosis variation of BRL cells treated with CBS/CSE siRNA表 5CBS/CSE siRNA转染后BRL细胞凋亡率变化(n=4,%,±s)
*P<0.05;a与阴性对照组比较,P<0.05
组别阴性对照组溶剂对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 0 h 0.2±0.2 0.2±0.1 0.5±0.2 0.5±0.2 0.5±0.1 2.893 4 h 0.3±0.1 0.2±0.2 12.8±0.2a16.9±0.2a20.8±0.2a1 234.159*组别阴性对照组溶剂对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 8 h 0.3±0.1 0.3±0.2 24.6±0.2a27.4±0.1a30.2±0.2a3 057.859*12 h 0.4±0.1 0.3±0.2 27.2±0.2a31.6±0.2a35.5±0.1a3 197.946*24 h 0.4±0.2 0.4±0.1 31.9±0.2a35.6±0.1a41.3±0.2a4 255.039*
2.4 CBS/CSE siRNA转染BRL细胞MMP、Cyt C及cleaved-caspase 3蛋白表达的变化
2.4.1 MMP CBS siRNA组转染12、24 h时MMP低于阴性对照组,4、8 h时与阴性对照组差异无统计学意义;CSE siRNA组除除转染4 h时MMP与阴性对照组差异无统计学意义外,转染8、12、24 h时均低于阴性对照组;(CBS+CSE)siRNA组转染后各时点MMP均低于阴性对照组(均P<0.05),见图4、表6。
2.4.2 Cyt C蛋白 转染4 h时各组Cyt C蛋白表达差异无统计学意义;转染8 h时CSE siRNA组和(CBS+CSE)siRNA组高于阴性对照组,CBS siRNA组与阴性对照组差异无统计学意义;转染12、24 h时CBS siRNA组、CSE siRNA组和(CBS+CSE)siRNA组均高于阴性对照组(均P<0.05),见图5、表7。
2.4.3 cleaved-caspase 3蛋白 CBS siRNA组、CSE siRNA组和(CBS+CSE)siRNA组cleaved-caspase 3蛋白表达转染24 h时高于阴性对照组(P<0.05),其余时点与阴性对照组差异均无统计学意义,见表6、表8。
Tab.6 Comparison of MMP levels between BRL cells treated with CBS/CSE siRNA表6 CBS/CSE siRNA转染BRL细胞后胞浆内MMP水平比较 (n=4,±s)
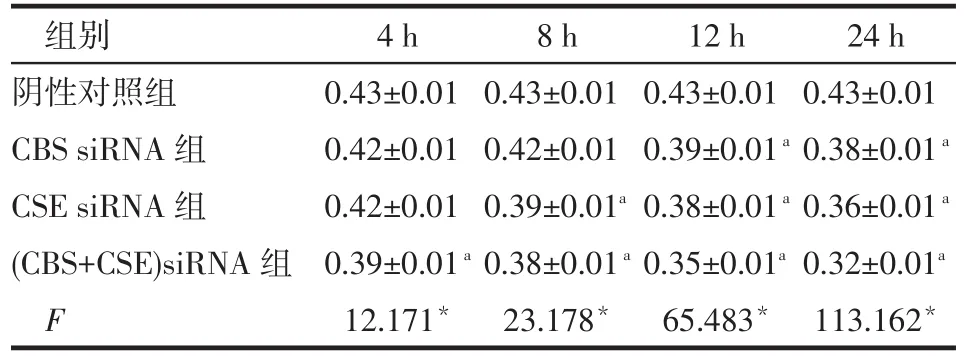
Tab.6 Comparison of MMP levels between BRL cells treated with CBS/CSE siRNA表6 CBS/CSE siRNA转染BRL细胞后胞浆内MMP水平比较 (n=4,±s)
*P<0.05;a与阴性对照组比较,P<0.05
组别阴性对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 4 h 0.43±0.01 0.42±0.01 0.42±0.01 0.39±0.01a12.171*8 h 0.43±0.01 0.42±0.01 0.39±0.01a0.38±0.01a23.178*12 h 0.43±0.01 0.39±0.01a0.38±0.01a0.35±0.01a65.483*24 h 0.43±0.01 0.38±0.01a0.36±0.01a0.32±0.01a113.162*
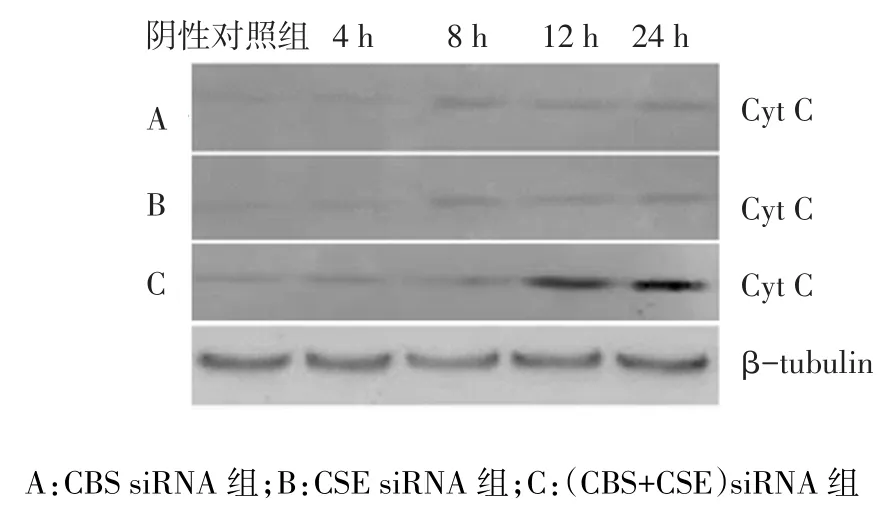
Fig.5 The Cyt C expression level in BRL cells treated with CBS/CSE siRNA图5 CBS/CSE siRNA转染BRL细胞后胞浆内Cyt C蛋白表达变化
Tab.7 Cyt C protein expression level in BRL cells treated with CBS/CSE siRNA表7 CBS/CSE siRNA转染BRL细胞后胞浆内Cyt C蛋白表达水平比较 (n=4,±s)
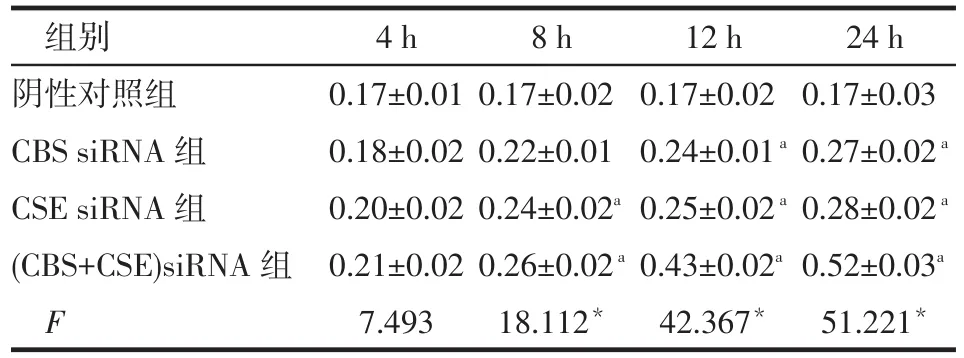
Tab.7 Cyt C protein expression level in BRL cells treated with CBS/CSE siRNA表7 CBS/CSE siRNA转染BRL细胞后胞浆内Cyt C蛋白表达水平比较 (n=4,±s)
*P<0.05;a与阴性对照组比较,P<0.05
组别阴性对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 4 h 0.17±0.01 0.18±0.02 0.20±0.02 0.21±0.02 7.493 8 h 0.17±0.02 0.22±0.01 0.24±0.02a0.26±0.02a18.112*12 h 0.17±0.02 0.24±0.01a0.25±0.02a0.43±0.02a42.367*24 h 0.17±0.03 0.27±0.02a0.28±0.02a0.52±0.03a51.221*
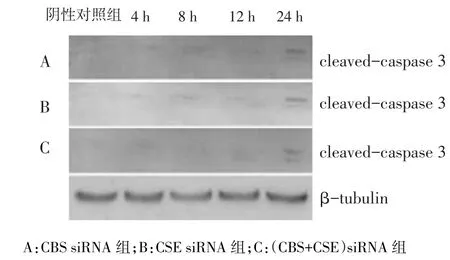
Fig.6 The cleaved-capase 3 expression in BRL cells treated with CBS/CSE siRNA图6 CBS/CSE siRNA转染BRL细胞后cleaved-capase 3蛋白表达变化
Tab.8 The cleaved-caspase 3 protein expression level in BRL cells treated with CBS/CSE siRNA表8 CBS/CSE siRNA转染BRL细胞后胞浆内cleavedcaspase 3蛋白表达水平比较 (n=4,±s)
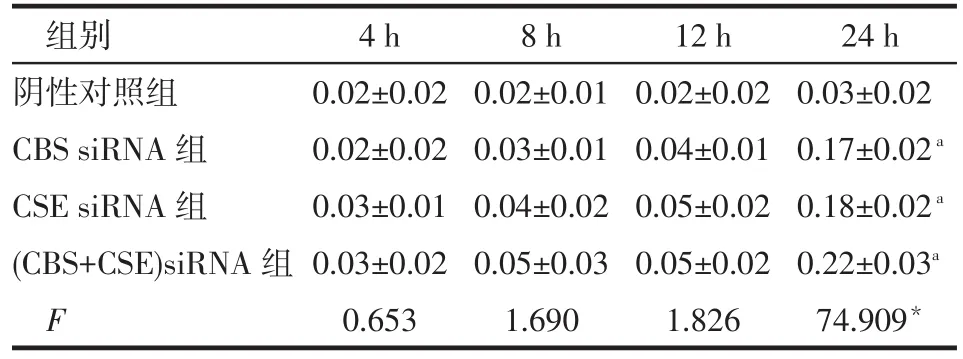
Tab.8 The cleaved-caspase 3 protein expression level in BRL cells treated with CBS/CSE siRNA表8 CBS/CSE siRNA转染BRL细胞后胞浆内cleavedcaspase 3蛋白表达水平比较 (n=4,±s)
*P<0.05;a与阴性对照组比较,P<0.05
组别阴性对照组CBS siRNA组CSE siRNA组(CBS+CSE)siRNA组F 4 h 0.02±0.02 0.02±0.02 0.03±0.01 0.03±0.02 0.653 8 h 0.02±0.01 0.03±0.01 0.04±0.02 0.05±0.03 1.690 12 h 0.02±0.02 0.04±0.01 0.05±0.02 0.05±0.02 1.826 24 h 0.03±0.02 0.17±0.02a0.18±0.02a0.22±0.03a74.909*
3 讨论
近年来H2S在细胞凋亡过程中的作用及机制成为研究热点之一,有研究显示外源性H2S在抑制平滑肌细胞增殖的同时,可进一步促进自发性高血压大鼠主动脉平滑肌细胞凋亡[10]。应用NaHS能显著减弱由肝脏缺血/再灌注引起的肝损伤的严重性,并抑制脂质过氧化作用以及血清中炎症因子的产生,进而抑制细胞凋亡和凋亡相关蛋白的产生[11]。然而内源性H2S参与生理状态下肝细胞凋亡的相关研究,尤其是内源性H2S在介导肝细胞凋亡的过程中发挥促进还是抑制的作用尚不明确。
以往研究中,涉及肝脏或肝细胞内源性H2S研究时,多以CSE代表肝内H2S的主要合成酶[12-13],本课题组观察到BRL细胞中同时存在CBS、CSE的基础表达。尤其是CBS-H2S体系,已有报道其存在于肝脏整体器官中[14],本研究进一步明确了其分布于肝细胞中,并筛选出CBS/CSE siRNA最佳序列转染BRL细胞进行实验,结果发现,联合转染两种siRNA,可减少BRL细胞内源性H2S生成,与单独转染CBS或CSE siRNA相比,联合转染CBS siRNA和CSE siRNA后12 h,内源性H2S生成分别减少了50%和35.59%,提示CBS和CSE在内源性H2S酶促反应生成中均发挥作用,但作用大小有所区别。在研究肝脏或肝细胞内源性H2S时,仅研究一个来源的H2S不足以充分反映肝脏或肝细胞内源性H2S酶促生成情况。
CBS/CSE siRNA单独或联合转染BRL细胞后,细胞上清中LDH活性未见明显变化。LDH一般稳定存在于正常细胞胞浆中,在细胞膜完整性遭到破坏时才会大量逸出至细胞外,本研究结果提示siRNA转染体系试剂处理细胞后,未影响细胞膜相的完整性。本研究结果显示,CBS siRNA、CSE siRNA分别单独处理BRL细胞后4~24 h,细胞凋亡率随时间变化而明显增加,且均明显高于阴性对照组,提示抑制CBS源性、CSE源性H2S生成均可导致BRL细胞凋亡;其中,与CBS siRNA单独处理组相比,联合转染CBS与CSE siRNA处理BRL细胞12 h后,内源性H2S生成减少了50%,而细胞凋亡率增加了30.83%,与CSE siRNA单独处理组相比,联合转染12 h后内源性H2S生成减少了35.59%,细胞凋亡率增加了11.97%,提示两种来源的H2S发挥的作用大小不同,且CBS源性H2S略少于CSE源性H2S生成,二者之间可能存在一定的代偿机制。在探讨肝细胞凋亡途径的过程中,单独或联合应用CBS/CSE siRNA作用BRL细胞后,细胞MMP下降,胞浆内Cyt C蛋白表达上调,cleaved-caspase3蛋白表达上调,这一过程符合凋亡线粒体通路中MMP下降,开启线粒体膜孔,进而使线粒体膜内Cyt C逸出至胞浆内,通过一系列转导,活化caspase 3系统的过程节点[15],提示内源性H2S参与凋亡的通路可能部分涉及了凋亡的线粒体途径,并最终引发细胞凋亡。
肝细胞中内源性H2S信号分子的研究需全面考虑多个酶促反应体系及相互间可能的代偿机制,为今后H2S相关基础研究及临床应用的发展提供借鉴,但有关内源性H2S气体信号分子发挥调节作用的特异性机制和交互作用尚待进一步探讨。
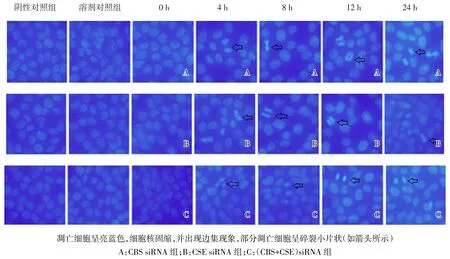
Fig.3 The morphological changes of BRL cells treated with siRNA(Hoechst,×400)图3 CBS/CSE siRNA转染后BRL细胞凋亡的形态学变化(Hoechst染色,×400)
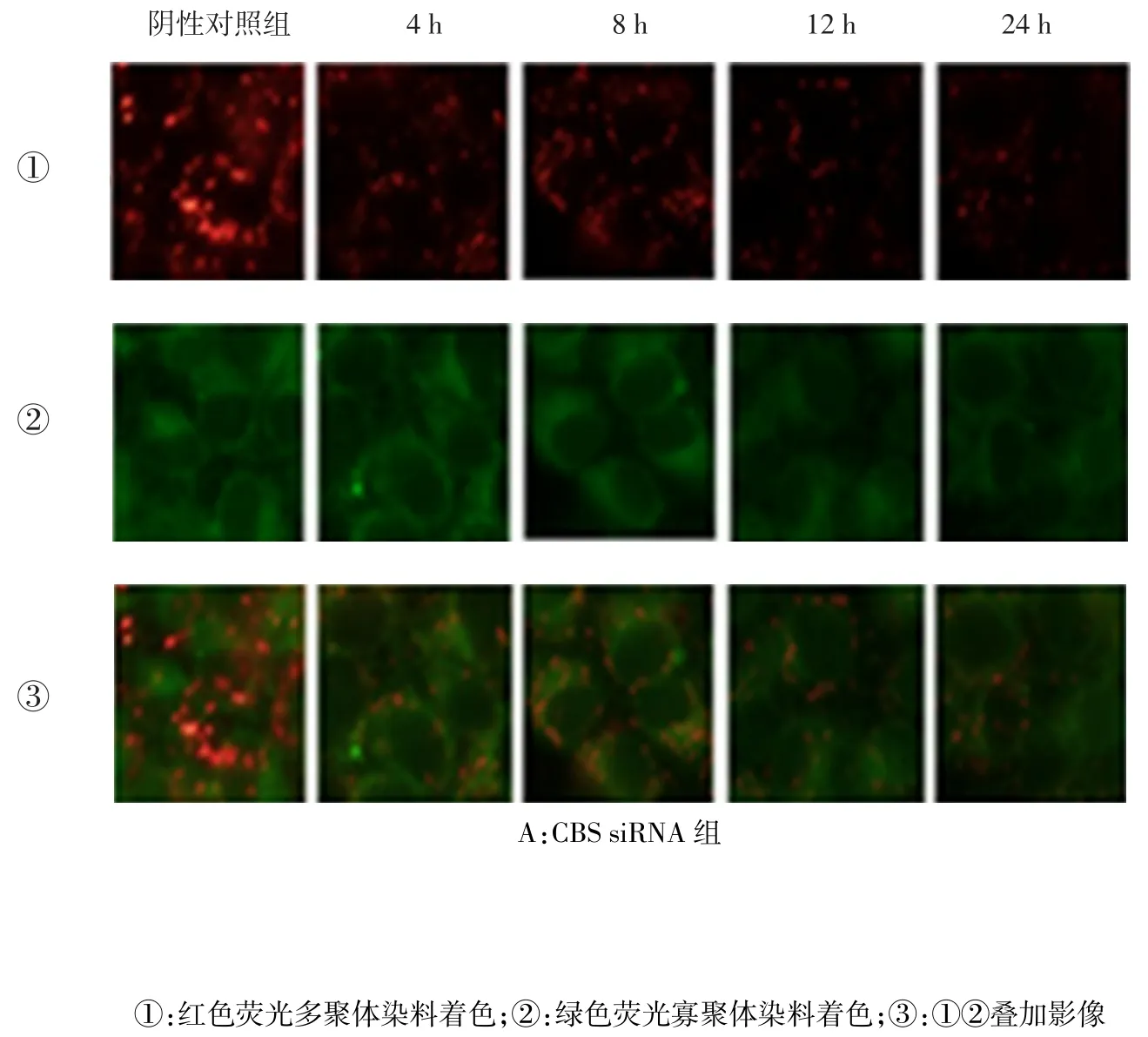
Fig.4 MMP variation of BRL cells treated with CBS/CSE siRNA(fluorescence,×400)图4 CBS/CSE siRNA转染BRL细胞后MMP变化(荧光显微镜,×400)
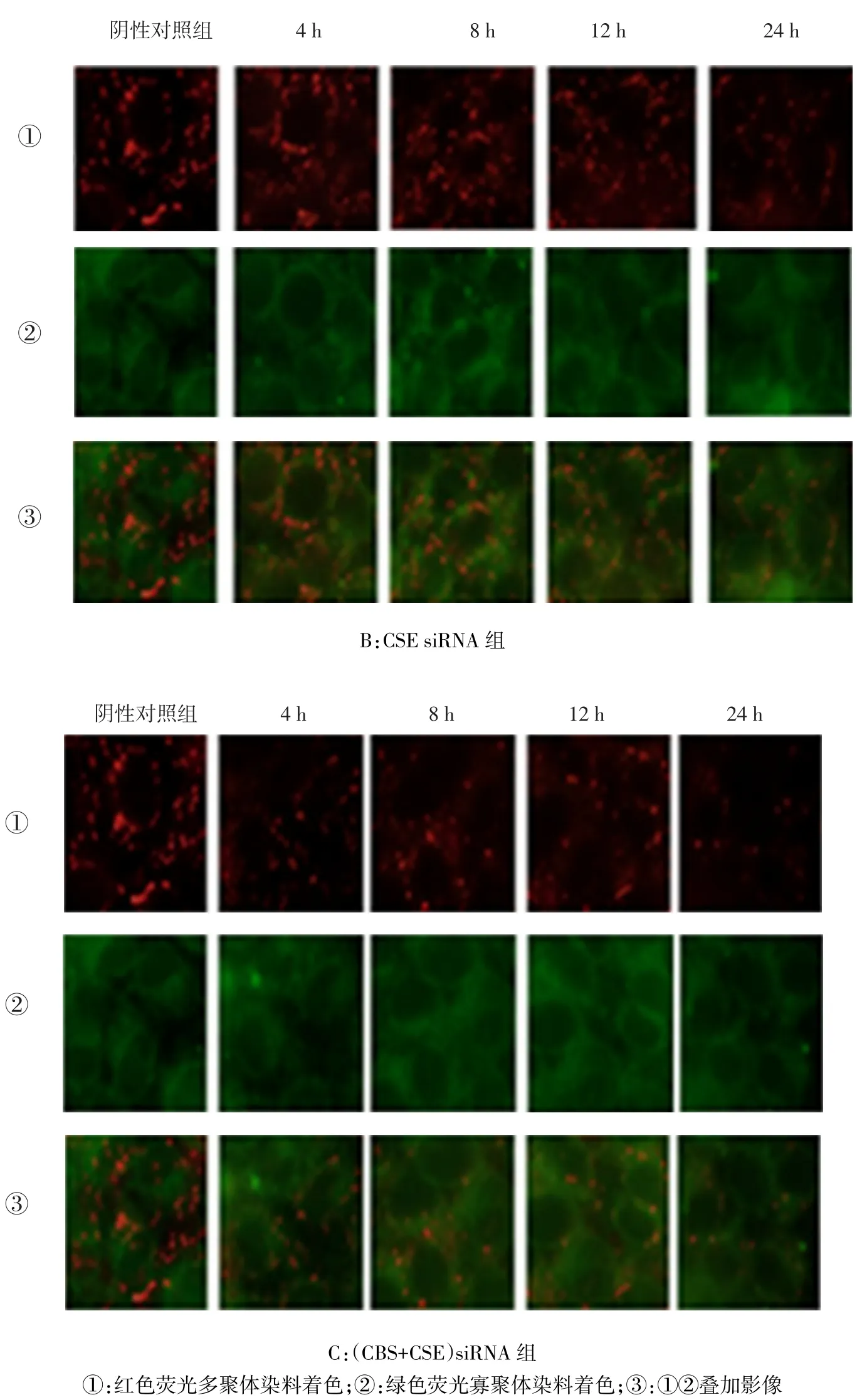
Fig.4 MMP variation of BRL cells treated with CBS/CSE siRNA(fluorescence,×400)图4 CBS/CSE siRNA转染BRL细胞后MMP变化(荧光显微镜,×400)
[1]Olas B,Kontek B.The possible role of hydrogen sulfide as a modulator of hemostatic parameters of plasma[J].Chem Biol Interact,2014, 220(9):20-24.doi:10.1016/j.cbi.2014.06.001.
[2]Hancock JT,Whiteman M.Hydrogen sulfide and cell signaling: Team player or referee[J]?Plant Physiol Biochem,2014,78(5):37-42.doi:10.1016/j.plaphy.2014.02.012.
[3]Wang JF,Li Y,Song JN,et al.Role of hydrogen sulfide in secondary neuronal injury[J].Neurochem Int,2014,64(1):37-47.doi: 10.1016/j.neuint.2013.11.002.
[4]Yan YL,Chen C,Zhou H,et al.Endogenous hydrogen sulfide formation mediates the liver damage in endotoxemic rats[J].Res Vet Sci, 2013,94(3):590-595.doi:10.1016/j.rvsc.2012.10.009.
[5]Norris E,Culberson C,Clemens M.P57 hydrogen sulfide differentially regulates hepatic blood flow at sinusoidal and extrasinusoidal sites during endotoxemia[J].Nitric Oxide,2012,27(9),S37.doi: 10.1016/j.niox.2012.08.058.
[6]Koning AM,Leuvenink HG,Hoeksma DH,et al.P30 NaHS and STS treatment in ischemia-reperfusion injury in rats[J].Nitric Oxide,2014,39(5):S25.doi:10.1016/j.niox.2014.03.080.
[7]Rose VL,Winkler GS,Allen S.Ploymer siRNAconjugates synthesized by controlled radical polymerization[J].Eur Polym J,2013,49 (10):2861-2883.doi:10.1016/j.eurpolymj.2013.06.002.
[8]Nagy P,Pálinkás Z,Nagy A,et al.Chemical aspects of hydrogen sulfide measurements in physiological samples[J].Biochim Biophys Acta,2014,1840(2):876-891.doi:10.1016/j.bbagen.2013.05. 037.
[9]Huang SF,Chua JH,Yew WS,et al.Site-Directed Mutagenesis on human cystathionine-gamma-lyase reveal insights into the modulation of H2S production[J].J Mol Biol,2010,396(3):708-718.doi: 10.1016/j.jmb.2009.11.058.
[10]Ahmad FU,Sattar MA,Rathore HA,et al.Exogenous hydrogen sulfide(H2S)reduces blood pressure and prevents the progression of diabetic nephropathy in spontaneously hepertensive rats[J].Ren Fail, 2012,34(2):203-210.doi:10.3109/0886022X.2011.643365.
[11]Kang K,Zhao M,Jiang H,et al.Role of Hydrogen Sulfide in Hepatic Ischemia-Reperfusion– Induced Injury In Rats[J].Liver Transpl,2009,15(10):1306-1314.doi:10.1002/lt.21810.
[12]Shirozu K,Tokuda K,Marutani E,et al.OP05 cystathionine γ-lyase deficiency protects mice from galactosamine/lipopolysaccharide-induced acute liver failure[J].Nitric Oxide,2013,31(9):S21.doi: 10.1016/j.niox.2013.06.035.
[13]Helmy N,Prip-Buus C,Vons C,et al.Oxidation of hydrogen sulfide by human liver mitochondria[J].Nitric Oxide,2014,Jun11.doi: 10.1016/j.niox.2014.05.011.[Epub ahead of print]
[14]Bekpinar S,Develi-ls S,Unlucerci Y,et al.Modulation of arginine and asymmetric dimethylarginine concentrations in liver and plasma by exogenous hydrogen sulfide in LPS-induced endotoxemia[J]. Can J Physiol Pharmacol,2013,91(12):1071-1075.doi:10.1139/ cjpp-2013-114.
[15]Zhang Q,Fu H,Zhang H,et al.Hydrogen sulfide preconditioning protects rat liver against ischemia/reperfusion injury by activating Akt-GSK-3β signaling and inhibiting mitochondrial permeability transition[J].PLoS One,2013,8(9):e74422.doi:10.1371/journal. Pone.0074422.
(2014-07-07收稿 2014-07-17修回)
(本文编辑 陈丽洁)
Small Interfering RNA of Cystathionine β-Synthase/Cystathionine γ-Lyase-Derived Hydrogen Sulfide Synthesis Induces Apoptosis of Rat Hepatic BRL Cell Line
YAN Jun,LI Yanmin,GUO Xuexi,ZHANG Mingfang△
Department of Patholog of Tianjin First Center Hospital,Tianjin 300100,China△
E-mail:yanhuang2@163.com
ObjectiveTo explore the inhibitory effects of endogenous hydrogen sulfide,a novel and important gaseous transmitter generated in mammalian tissues mainly by cystathionine β-synthase(CBS)or cystathionine γ-lyase(CSE) on the apoptosis of the rat hepatic BRL cell line in physiological condition.MethodsBRL cells were cultured,and divided randomly into several groups in different phases of the experiment,including negative-siRNA(control)group,CBS siRNA (CBS 1~3)group and CSE siRNA(CSE 1~3)group,which were used to select the most efficient sequences of siRNAs at 48 or 24-hour transfection.Solution group and(CBS+CSE)siRNA group were added to detect the variation of apoptosis.The BRL cell line was observed and evaluated at 0,4,8,12,and 24 hrs after siRNA transfection.When the mechanisms of the apoptosis were detected,CBS/CSE siRNAs were transfected individually or jointly into BRL cells,and compared with negative-siRNA group to examine the variation.The genic and protein expression of CBS/CSE were detected by RT-PCR and Western blot assay.After transfection of CBS/CSE siRNA,the apoptosis of BRL cells was detected by Hoechst stain and flow cytometry(FCM).The mitochondrial membrane potential(MMP)changes were observed by fluorescent staining.Western blot assay was used to examine the protein expression of intracytoplasm cytochrome C(Cyt C)and cleaved-caspase 3.ResultsCBS and CSE were observed in BRL cells.After transfection of CBS/CSE siRNA,endogenous H2S generation decreased and the apoptosis of BRL cells increased.Accordingly,the expression of intracytoplasm-Cyt C and cleaved-caspase 3 increased.ConclusionThe inhibition of endogenous H2S synthesis induced the apoptosis of BRL cells under physiological condition,which may be involved in mitochondrial pathway of apoptosis.
cystathionine β-synthase;cystathionine gamma-lyase;hydrogen sulfide;RNA,small interfering; apoptosis;BRL cells
R363.1
A
10.3969/j.issn.0253-9896.2014.09.002
国家自然科学基金资助项目(81300346)
天津市第一中心医院病理科(邮编300100)
△通讯作者 E-mail:yanhuang2@163.com
