食欲素A与慢性阻塞性肺疾病患者呼吸中枢驱动的相关性研究
2014-07-05秦勇李峰赵恬
秦 勇 李 峰 赵 恬
食欲素A与慢性阻塞性肺疾病患者呼吸中枢驱动的相关性研究
秦 勇1李 峰1赵 恬2△
目的 探讨食欲素A水平与慢性阻塞性肺疾病(COPD)患者呼吸中枢驱动之间的关系。方法收集30例稳定期COPD患者为COPD组,以20例健康体检者为健康对照组。记录所有受试者体质指数(BMI)、年龄、COPD组患者吸烟史。测定血浆食欲素A水平,并于采血当天上午测定肺功能,包括第1秒用力呼气容积(FEV1)、用力肺活量(FVC)和FEV1/FVC、最大呼气压(MEP)、最大吸气压(MIP)、口腔闭合压(P0.1)。结果COPD组患者血浆食欲素A水平(1.87±0.43)ng/L高于健康对照组(1.49±0.19)ng/L(t=3.665,P<0.01)。COPD组患者血浆食欲素A与FEV1呈负相关(r=-0.389,P<0.05),与P0.1呈正相关(r=0.728,P<0.01),与年龄、BMI、MEP、MIP均无相关性(均P>0.05)。结论COPD患者血浆食欲素A水平升高,其原因可能与吸烟和高碳酸血症有关,且食欲素A可能参与COPD呼吸中枢驱动的调节。
肺疾病,慢性阻塞性;呼吸功能试验;呼吸中枢;食欲素A
慢性阻塞性肺疾病(COPD)是一种具有气流受限特征的疾病,随着患者呼吸肌肌力下降,负担增加,呼吸中枢驱动代偿性增加。研究表明COPD患者呼吸中枢驱动水平高于健康人群,且与疾病的严重程度正相关[1],但其神经分子机制尚不清楚。有研究表明下丘脑合成的一种神经多肽——食欲素(orexin)具有呼吸调节作用[2]。本研究旨在探讨食欲素A水平与COPD患者呼吸中枢驱动之间的关系。
1 对象与方法
1.1 研究对象 收集2010年9月—2011年9月在我院门诊和住院的稳定期COPD患者30例为COPD组。同期我院健康体检者20例为健康对照组。纳入标准:COPD诊断符合中华医学会呼吸病学分会制订的《慢性阻塞性肺疾病诊治指南》(2007修订版),病情稳定至少4周及以上。稳定期指患者咳嗽、咳痰、气短等症状稳定或症状轻微。排除标准:营养不良或肥胖者;正在接受全身激素及营养支持治疗者;睡眠呼吸障碍、肿瘤、结缔组织病、心力衰竭、肝或肾功能障碍、糖尿病等疾病者。健康对照组为无吸烟史的健康体检者,经病史、查体及辅助检查,排除糖尿病,心、脑、肺、肾及肝脏等器官的器质性病变,近2个月内无全身感染史。
1.2 方法
1.2.1 受试者一般状况 记录所有受试者年龄、身高、体质量,计算体质指数(BMI),吸烟史以及合并症。
1.2.2 血浆食欲素A水平测定 清晨空腹肘正中静脉采血3 mL,置于乙二胺四乙酸(EDTA)抗凝管中,摇匀后倒入加有抑肽酶的试管中,再次摇匀,低温离心后,置-70℃保存以备用。采用放射免疫分析法测定食欲素A水平,所用试剂盒为美国Phoenix公司产品。
1.2.3 肺功能及呼吸肌功能测定 所有受试者均于采血当天上午测定肺功能(美国麦加菲公司肺功能仪)。主要测定指标为第1秒用力呼气容积(FEV1)、用力肺活量(FVC)和FEV1/FVC,以及最大呼气压(MEP)、最大吸气压(MIP)、口腔闭合压(P0.1)。
1.3 统计学方法 采用SPSS 16.0统计软件包进行统计分析,计量资料用均数±标准差(±s)表示,组间比较采用t检验;两变量关联性分析用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 2组一般情况及血浆食欲素水平比较 2组性别、年龄、BMI差异均无统计学意义(P>0.05)。COPD组食欲素A水平、P0.1高于健康对照组,而FEV1、MEP、MIP等指标低于健康对照组(均P<0.01),见表1。
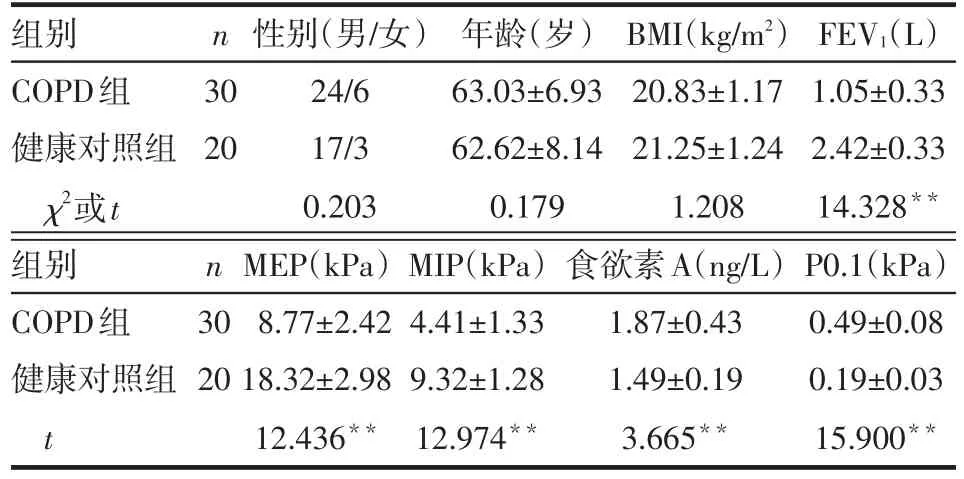
Tab.1 Comparison of general condition and plasma orexin A level between two groups表1 2组一般情况及血浆食欲素A水平比较
2.2 血浆食欲素A水平与各参数相关性分析 结果显示健康对照组血浆食欲素A水平与年龄、BMI、FEV1、MEP、MIP、P0.1均无相关性(r分别为-0.125、0.118、0.206、0.002、-0.062、0.216,均P>0.05)。COPD组患者血浆食欲素A水平与FEV1呈负相关(r=-0.389,P<0.05),与P0.1呈正相关(r=0.728,P<0.01),与年龄、BMI、MEP、MIP均无相关性(r分别为-0.025、0.183、-0.258、0.026,均P>0.05)。
3 讨论
3.1 食欲素A对COPD患者呼吸中枢的调节作用及机制 食欲素是由下丘脑神经元合成和分泌的一种小分子神经多肽,具有广泛的生理作用,对能量代谢、睡眠-觉醒周期、循环系统、自主神经系统、生长发育等均有不同程度的影响。近年来发现食欲素还有呼吸调节作用。研究显示,作为调节呼吸的重要区域的脊髓前包钦格复合体(PBC)和膈神经支配的膈运动神经元中存在含食欲素的神经纤维和食欲素受体[3]。在神经鞘内注射食欲素A后呼吸中枢驱动增加,包括膈神经振幅增加、频率下降,分钟通气量增加,呼气时间延长,吸气时间缩短[4]。此外,食欲素基因敲除小鼠呼吸频率和潮气量下降[5],表明食欲素对呼吸有调节作用。COPD模型小鼠体内食欲素A及受体的含量相同且均明显高于正常对照组,同时COPD模型小鼠的呼吸中枢兴奋性及对食欲素的敏感性也相应增高[6],因此推测食欲素可能在COPD呼吸中枢兴奋中起重要作用。本研究结果显示:COPD患者血浆食欲素A水平高于健康对照组,且与FEV1呈负相关,提示食欲素A的水平与COPD的临床严重程度相关。P0.1指在气道阻断的情况下吸气0.1秒产生的口腔压力变化,是反映呼吸中枢驱动的最常用指标,患者血浆食欲素A水平与P0.1呈正相关,表明食欲素对呼吸中枢驱动可能存在调节作用,与文献报道一致。
3.2 COPD患者食欲素A水平升高的机制 Williams 等[7]发现食欲素神经元细胞的兴奋性是随体内CO2浓度和酸碱度的变化而变化的,内环境pH值越低,食欲素神经元的兴奋性越高,产生的食欲素也就越多。COPD患者由于气流受限,通气功能障碍,体内CO2潴留,使CO2浓度偏高,内环境pH值偏低,导致食欲素产生增加,血浆水平升高。此外也可能与吸烟有关。Kane等[8]发现长期慢性尼古丁的摄入可以上调大鼠脑组织内食欲素前体以及食欲素受体mRNA的表达。
3.3 不足与展望 由于COPD患者多伴有营养不良,营养状况对食欲素的影响也须考虑。本研究中并未发现营养状况相关指标BMI与食欲素水平有关,与Matsumura等[9-10]研究不一致。鉴于食欲素A是近年来新兴研究的一种神经肽,目前国内外对COPD与食欲素A关系的临床研究较少,而且试验条件以及入组分组标准不同,试验方法迥异,因而其试验结果尚待进一步证实。此外,由于研究较早,患者纳入依据为《慢性阻塞性肺疾病诊治指南》(2007修订版),目前《指南》已经多次修订,但总体来讲各次修订中的COPD诊断标准基本无明显变化,故对本次研究的纳入标准产生的影响不大。总之,本研究结果表明COPD患者血浆食欲素A水平升高,其原因可能与吸烟和高碳酸血症有关,食欲素A可能参与COPD呼吸中枢驱动的调节。血浆食欲素A有望作为评价COPD呼吸中枢兴奋性、病情严重程度的一个重要生物学指标。
[1]Jolley CJ,Luo YM,Steier J,et al.Neural respiratory drive in healthy subjects and in COPD[J].Eur Respir J,2009,33(2):289-297.doi: 10.1183/09031936.00093408.
[2]Williams RH,Burdakov D.Hypothalamic orexins/hypocretins as regulators of breathing[J].Expert Rev Mol Med,2008,10:e28.doi:10. 1017/S1462399408000823.
[3]Young JK,Wu M,Manaye KF.Orexin stimulates breathing via medullary and spinal pathways[J].J Appl Physiol,2005,98(4):1387-1395.doi:10.1152/japplphysiol.00914.2004.
[4]Shahid IZ,Rahman AA,Pilowsky PM.Intrathecal orexin A increases sympathetic outflow and respiratory drive,enhances baroreflex sensitivity and blocks the somato-sympathetic reflex[J].British Journal of Pharmacology,2011,162(4):961-973.doi:10.1111/ j.1476-5381.2010.01102.x.
[5]Nakamura A,Zhang W,Yanagisawa M,et al.Vigilance state-dependent attenuation of hypercapnic chemoreflex and exaggerated sleep apnea in orexin knockout mice[J].J Appl Physiol,2007,102 (1):241-248.doi:10.1152/japplphysiol.00679.2006.
[6]Liu ZB,Song NN,Geng WY.Orexin-A and respiration in a rat model of smoke-induced chronic obstructive pulmonary disease[J].Clin Exp Pharmacol Physiol,2010,37(10):963-968.doi:10.1111/ j.1440-1681.2010.05411.x.
[7]Williams RH,Jensen LT,Verkhratsky A,et al.Control of hypothalamic orexin neurons by acid and CO2[J].PNAS,2007,104(25): 10685-10690.doi:10.1073/pnas.0702676104.
[8]Kane JK,Parker SL,Matta SG,et al.Nicotine up-regulates expression of orexin and its receptors in rat brain[J].Endocrinology,2000,141(10):3623-3629.
[9]Matsumura T,Nakayama M,Satoh H,et al.Plasma orexin-A levels and body composition in COPD[J].Chest,2003,123(4):1060-1065.doi:10.1378/chest.123.4.1060.
[10]Zhu LY,Summah H,Jiang HN,et al.Plasma orexin-A levels in COPD patients with hypercapnic respiratory failure[J].Mediators Inflamm,2011,2011:754847.doi:10.1155/2011/754847.
(2013-10-24收稿 2014-02-26修回)
(本文编辑 李鹏)
The Relationship between Orexin A and Respiratory Drive in Patients with Chronic Obstructive Pulmonary Disease
QIN Yong1,LI Feng1,ZHAO Tian2
1 Department of Respiratory Medicine,the First Division Hospital of Xinjiang Production Corps, Xinjiang Aksu 843000,China;2 Zhejiang Province Zhejiang Hospital ZHAO Tian,E-mail:zjzt2005@163.com
Obejective To explore the correlation of Orexin A and respiratory drive in chronic obstructive pulmonary disease(COPD)patients.MethodsPulmonary function was tested in 30 stable COPD patients and 20 normal healthy adults.Plasma orexin A level was measured with a radioimmunoassay kit.The correlation of Orexin A with BMI,age,BDI, FEV1,FVC,FEV1/FVC,MEP,MIP,P0.1 in COPD patients was analyzed.ResultsPlasma Orexin A levels in patients with COPD group(1.87±0.43)ng/L was higher than those in the control group(1.49±0.19)ng/L,P<0.01.Plasma Orexin A levels in patients with COPD correlated negatively with FEV1(r=-0.389,P<0.05),and correlated positively with P0.1(r= 0.728,P<0.01).ConclusionPlasma orexin A in COPD patients increased which may be caused by smoking and hypercapnia.Orexin A may play a crucial role in regulating respiratory drive in COPD patients.
pulmonary disease,chronic obstructive;respiratory function tests;respiratory center;orexin-A
R563
A
10.3969/j.issn.0253-9896.2014.08.019
1新疆阿克苏,新疆生产建设兵团第一师医院(邮编843000);2浙江省浙江医院
△通讯作者 E-mail:zjzt2005@163.com
