H2S对尿源性脓毒血症肾损伤的影响
2014-07-05许武军罗志刚罗红梅
许武军 陈 仙△ 罗志刚 汪 翼 罗红梅 张 涛 刘 俊
H2S对尿源性脓毒血症肾损伤的影响
许武军1陈 仙1△罗志刚1汪 翼1罗红梅2张 涛1刘 俊1
目的 探讨H2S对尿源性脓毒血症肾损伤的影响及其机制。方法将30只大白兔随机均分为Control组、Sham组、Sepsis组、NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组。建立上尿路急性梗阻并感染脓毒血症动物模型。于术前、术后24 h、48 h、72 h采血行外周血检测白细胞计数(WBC)、血肌酐(Cr)、尿素氮(BUN)。术后72 h光学显微镜及透射电子显微镜观察肾组织形态结构变化;应用免疫组织化学法检测肾组织肿瘤坏死因子(TNF)-α、白细胞介素(IL)-10和核因子(NF)-κB蛋白表达;去蛋白法测定血浆H2S浓度,亚甲基蓝分光光度计法测肾组织胱硫醚-γ-裂解酶(CSE)的活性。结果术后24 h、48 h、72 h,Sepsis组WBC、Cr、BUN均高于其他4组,NaHS 8.4 μmol/kg组WBC、BUN低于NaHS 2.8 μmol/kg组;血Cr术后24 h、48 h NaHS 8.4 μmol/kg组与NaHS 2.8 μmol/kg组差异无统计学意义,术后72 h低于NaHS 2.8 μmol/kg组。静脉注射NaHS后肾病理形态损害减轻。NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组TNF-α、NF-κB蛋白表达均低于Sepsis组,IL-10蛋白表达高于Sepsis组。NaHS 8.4 μmol/kg组TNF-α、NF-κB蛋白表达低于NaHS 2.8 μmol/kg组,IL-10蛋白表达高于NaHS 2.8 μmol/kg组。Sepsis组较Control组和Sham 组H2S浓度降低,肾组织CSE表达减弱。经静脉注射NaHS后H2S浓度升高,CSE活性无明显变化。结论内源性H2S通过抑制NF-κB的表达,下调TNF-α,上调IL-10,减轻尿源性脓毒血症肾损伤。
硫化氢;NF-κB;肿瘤坏死因子α;白细胞介素10;胱硫醚γ裂合酶;肾损伤;尿源性脓毒血症
尿源性脓毒血症(urine-derived toxinemia,Urosepsis)中肾脏是最容易受损的重要脏器之一[1]。研究发现NaHS(H2S的供体)可抑制脂多糖对血管内皮细胞的炎症反应[2],H2S可对抗脓毒血症诱发的急性肺损伤及其炎症反应[3]。核因子(NF)-κB在脓毒血症器官衰竭中发挥重要的作用[4],其参与多种与感染性免疫应答相关的基因调节。H2S可抑制NF-κB信号通路[5],对NF-κB的表达与活性具有重要的调控作用[6]。H2S能否通过抑制NF-κB的表达,减轻尿源性脓毒血症肾损伤目前尚少见报道。本研究通过模拟上尿路急性梗阻注入大肠杆菌建立兔上尿路感染致脓毒血症模型,观察H2S对尿源性脓毒血症所致肾损害的作用及对肾组织NF-κB表达的影响,以揭示H2S抗尿源性脓毒血症肾损害作用的机制。
1 材料与方法
1.1 动物及试剂 雄性新西兰大白兔30只,体质量1.80~2.20 kg(购自南华大学动物学部),实验中以颗粒饲料及自来水喂养,严格遵行南华大学《动物实验伦理准则》。大肠杆菌(ATCC 25922)由南华大学附二医院微生物室提供;NaHS (Sigma公司);肿瘤坏死因子(TNF)-α抗体、白细胞介素(IL)-10抗体、NF-κB抗体(北京博奥森公司);兔SP-HRP试剂盒与DAB显色试剂盒(北京康为世纪生物科技有限公司)。
1.2 方法
1.2.1 尿源性脓毒血症动物模型的建立 将30只大白兔按随机数字表法分为Control组、Sham组、Sepsis组、NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组5组,每组6只。Control组以正常颗粒饲料及自来水喂养,不做任何处理。Sham组兔称体质量后用10%水合氯醛(3 mL/kg)腹腔注射,麻醉满意后,取左下腹腹直肌旁切口,打开腹腔,分离左输尿管中段,肠管复位后关闭切口。Sepsis组分离并结扎左输尿管中段,将0.5 mL/kg、108/mL浓度大肠杆菌悬液(ATCC 25922)注入输尿管管腔内。NaHS 2.8 μmol/kg组及NaHS 8.4 μmol/kg组实验操作同Sepsis组,术后分别经耳缘静脉注射浓度为50 mmol/L的NaHS溶液2.8 μmol/kg及8.4 μmol/kg,术后正常颗粒饲料及自来水喂养。术后72 h处死兔子,取左侧肾脏。
1.2.2 血常规、肾功能的检测 于术前、术后24 h、术后48 h、术后72 h采血行血白细胞计数(WBC)分析;取静脉血5 mL离心(3 000 r/min,10 min)取上清液,用AU800全自动生化仪(奥林巴斯)检测血肌酐(Cr)、尿素氮(BUN)。
1.2.3 肾组织HE染色 术后72 h取适量肾组织以10%福尔马林固定、包埋,制作好病理切片。将石蜡切片脱蜡去水、苏木素染色、分化和蓝化、伊红染色、洗涤、脱水、透明,封片。光镜下观察并摄片。
1.2.4 肾组织透射电子显微镜观察病理变化 术后72 h将肾组织固定、漂洗、脱水、浸泡、烘烤、包埋、修块、半薄切片定位、超薄切片(厚约50 nm)、双重染色、电镜(日立Hitachi-7500)下观察并拍照。
1.2.5 免疫组织化学法检测肾脏组织中TNF-α、IL-10、NF-κB蛋白的表达 石蜡切片常规脱蜡、水化;抗原修复,3%过氧化氢清除内源性过氧化物酶活性,加正常血清工作液,室温孵育,加一抗(1∶300稀释),4℃孵育过夜,PBS淋洗后加生物素标记羊抗兔二抗,室温孵育,PBS充分淋浴;加HRP标记的链霉亲和素,室温孵育,PBS漂洗;加显色工作液显色(DAB);苏木精复染,脱水,二甲苯透明,封片。
1.2.6 去蛋白法测定血浆中H2S浓度 术后72 h,取血清样品0.1 mL,依次加入1%乙酸锌0.5 mL、20 mmol/L N,N-二甲基-对苯二胺硫酸盐0.5 mL(溶于7.2 mol/L盐酸)、30 mmol/L FeCl30.4 mL(溶于1.2 mol/L盐酸)混匀,室温静置20 min。加入10%三氯醋酸1 mL使蛋白沉淀,加蒸馏水2.5 mL,4 000 r/min离心,测定上清液在670 nm波长的吸光度,以硫化钠制定标准曲线计算血清H2S水平(μmol/L)。
1.2.7 肾组织胱硫醚-γ-裂解酶(CSE)活性测定 术后72 h取左肾组织在4℃的磷酸钾缓冲液(50 mmol/L,pH 6.8)中将肾组织研磨成10%(质量浓度,W/V)匀浆,低温离心,取上清液。加入反应液5-磷酸吡哆醛/磷酸钾缓冲液(0.5%,pH 7.4,100 mmol/L)、0.5 mol/L L-半胱氨酸,移至反应瓶,反应瓶中央的吸收孔中加入0.5 mL 1%乙酸锌+滤纸,锥形瓶用氮气充盈,封口,37℃水浴振荡孵育,加入0.5 mL 50%三氯醋酸,37℃孵育,终止反应,反应瓶中央孔的液体加入3.5 mL双蒸水、0.5 mL 20 mmol/L N,N-二甲基-对苯二胺硫酸盐(溶于7.2 mol/L盐酸)、0.4 mL 30 mmol/L FeCl3(溶于1.2 mol/L盐酸),静置20 min,离心5 min后测670 nm波长的吸光度,根据标准曲线,计算标本中H2S的含量,以每毫克肾组织在1 min内所生成H2S的量表示CSE活性(单位:nmol·min-1·mg-1)。
1.3 统计学方法 数据用SPSS 18.0统计软件处理,计量资料以均数±标准差(±s)表示,多组间不同时间点比较采用重复测量设计的方差分析;多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 NaHS对尿源性脓毒血症兔WBC的影响 成功建立尿源性脓毒血症兔动物模型,Sepsis组直肠温度、呼吸频率、心率明显升高,观察时间内无动物死亡。(1)组内比较。除Control组和Sham组不同时点WBC差异无统计学意义外,Sepsis组术后WBC呈升高趋势;NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组WBC均于术后24 h和48 h时升高,术后72 h时降低。(2)组间比较。术前各组间差异均无统计学意义;术后24 h Sham组WBC高于Control组,术后48 h、72 h Sham组与Control组WBC差异均无统计学意义;术后24 h、48 h、72 h,Sepsis组WBC均高于其他4组,NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组均高于Sham组和Control组,NaHS 8.4 μmol/kg组均低于NaHS 2.8 μmol/kg组。见表1。
Tab.1 Changes of WBC between rabbit groups表1 各组大白兔WBC变化 (n=6,×109/L,±s)
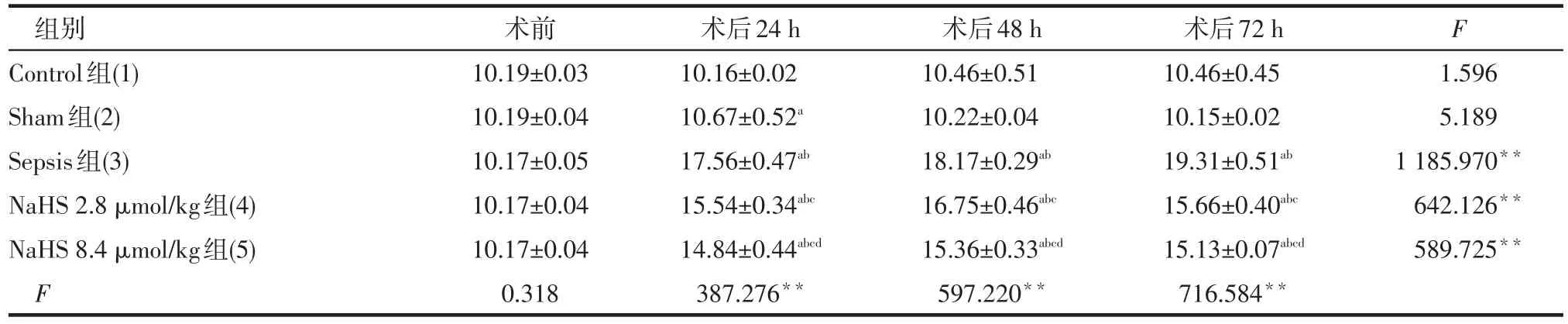
Tab.1 Changes of WBC between rabbit groups表1 各组大白兔WBC变化 (n=6,×109/L,±s)
**P<0.01;同一时点,a与(1)比较,b与(2)比较,c与(3)比较,d与(4)比较,P<0.05;表2~4同;F时间=1 390.031,F组间=963.177,F交互=249.412,均P<0.01;
组别Control组(1) Sham组(2) Sepsis组(3) NaHS 2.8 μmol/kg组(4) NaHS 8.4 μmol/kg组(5) F术前10.19±0.03 10.19±0.04 10.17±0.05 10.17±0.04 10.17±0.04 0.318术后24 h 10.16±0.02 10.67±0.52a17.56±0.47ab15.54±0.34abc14.84±0.44abcd387.276**术后48 h 10.46±0.51 10.22±0.04 18.17±0.29ab16.75±0.46abc15.36±0.33abcd597.220**术后72 h 10.46±0.45 10.15±0.02 19.31±0.51ab15.66±0.40abc15.13±0.07abcd716.584**F 1.596 5.189 1 185.970**642.126**589.725**
2.2 NaHS对脓毒血症肾功能的影响 (1)组内比较。除Control组和Sham组不同时点Cr、BUN差异无统计学意义外,Sepsis组、NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组术后Cr、BUN均呈升高趋势。(2)组间比较。术前各组间Cr、BUN差异均无统计学意义;术后24 h、48 h、72 h,Sham组与Control组Cr、BUN差异均无统计学意义,Sepsis组Cr、BUN均高于其他4组,NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组Cr、BUN均高于Sham组和Control组,NaHS 8.4 μmol/kg组BUN均低于NaHS 2.8 μmol/kg组;术后24 h、48 h NaHS 8.4 μmol/kg组Cr与NaHS 2.8 μmol/kg组差异无统计学意义,术后72 h Cr低于NaHS 2.8 μmol/kg组。见表2、3。
2.3 NaHS对尿源性脓毒血症肾组织病理特征的影响 光镜下观察,Control组和Sham组肾组织形态结构正常,无充血水肿及炎细胞浸润。Sepsis组肾小球变形、肾小囊扩张,肾小管上皮细胞肿胀、坏死脱落,肾小管管腔变大,充满中性粒细胞,肾间质充血、水肿,大量炎症细胞浸润;NaHS 2.8 μmol/kg组、NaHS 8.4 μmol/kg组较Sepsis组上述变化有所减轻,见图1A。电镜下观察,Control组、Sham组组织结构未见明显异常;Sepsis组肾间质水肿,肾小管上皮广泛萎缩,间质纤维细胞增生,肾小管上皮内线粒体水肿,排列紊乱,数量减少,部分上皮塌陷,管腔狭窄,刷状缘消失。肾小球足突细胞局灶性融合。系膜细胞和内皮细胞增生。NaHS 2.8 μmol/kg组、NaHS 8.4 μmol/kg组较Sepsis组上述变化明显减轻,见图1B。
2.4 NaHS对尿源性脓毒血症兔肾组织IL-10、TNF-α、NF-κB蛋白表达的影响 TNF-α、IL-10、NF-κB蛋白在5组兔肾组织中均呈微弱表达。Sham 组TNF-α、IL-10、NF-κB蛋白表达水平与Control组差异均无统计学意义。Sepsis组、NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组TNF-α、IL-10、NF-κB蛋白表达水平均高于Control组和Sham组。NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组TNF-α、NF-κB蛋白表达水平均低于Sepsis组,IL-10蛋白表达水平均高于Sepsis组。NaHS 8.4 μmol/kg组TNF-α、NF-κB蛋白表达水平均低于NaHS 2.8 μmol/kg组,IL-10蛋白表达水平均高于NaHS 2.8 μmol/kg组(均P<0.05)。见图2、表4。
Tab.2 Changes of Cr between rabbit groups表2 各组大白兔Cr变化 (n=6,μmol/L,±s)

Tab.2 Changes of Cr between rabbit groups表2 各组大白兔Cr变化 (n=6,μmol/L,±s)
F时间=500.136,F组间=134.123,F交互=103.296,均P<0.01
组别Control组(1) Sham组(2) Sepsis组(3) NaHS 2.8 μmol/kg组(4) NaHS 8.4 μmol/kg组(5) F术前88.22±5.52 87.92±5.81 88.13±5.97 88.63±5.68 88.62±5.00 0.190术后24 h 87.58±6.33 88.32±5.46 113.70±5.97ab103.43±5.92abc96.78±4.74abc22.072**术后48 h 89.27±6.19 88.75±6.16 156.10±6.69ab123.45±6.76abc116.48±5.90abc115.898**术后72 h 86.13±4.48 87.88±5.95 187.75±6.56ab153.68±6.49abc142.98±6.89abcd308.851**F 0.312 0.029 439.700**392.105**986.483**
Tab.3 Changes of BUN between rabbit groups表3 各组大白兔BUN变化 (n=6,mmol/L,±s)
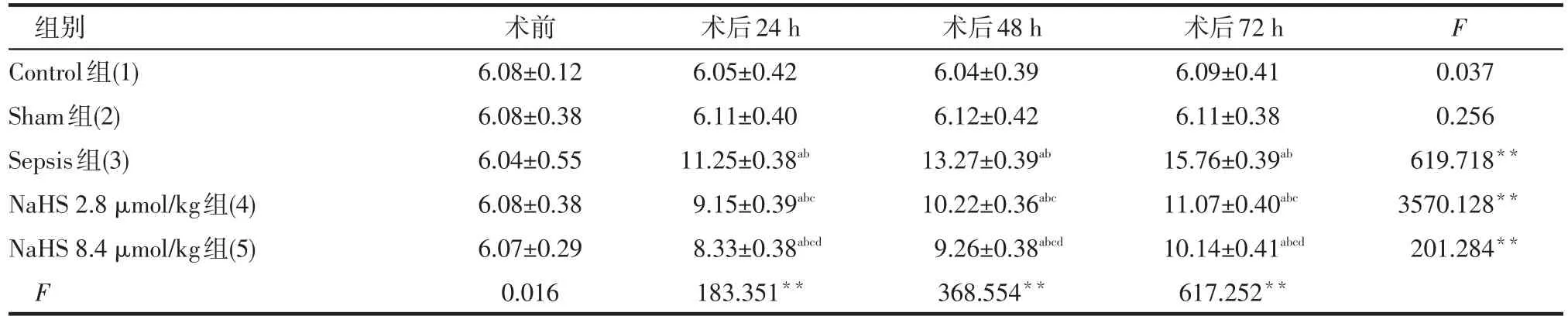
Tab.3 Changes of BUN between rabbit groups表3 各组大白兔BUN变化 (n=6,mmol/L,±s)
F时间=1 043.521,F组间=338.431,F交互=237.755,均P<0.01
组别Control组(1) Sham组(2) Sepsis组(3) NaHS 2.8 μmol/kg组(4) NaHS 8.4 μmol/kg组(5) F术前6.08±0.12 6.08±0.38 6.04±0.55 6.08±0.38 6.07±0.29 0.016术后24 h 6.05±0.42 6.11±0.40 11.25±0.38ab9.15±0.39abc8.33±0.38abcd183.351**术后48 h 6.04±0.39 6.12±0.42 13.27±0.39ab10.22±0.36abc9.26±0.38abcd368.554**术后72 h 6.09±0.41 6.11±0.38 15.76±0.39ab11.07±0.40abc10.14±0.41abcd617.252**F 0.037 0.256 619.718**3570.128**201.284**
Tab.4 Quantitation of of TNF-α,IL-10 and NF-κB expression between five groups表4 术后72h各组肾组织TNF-α、IL-10、NF-κB蛋白表达平均灰度值比较 (n=6,±s)
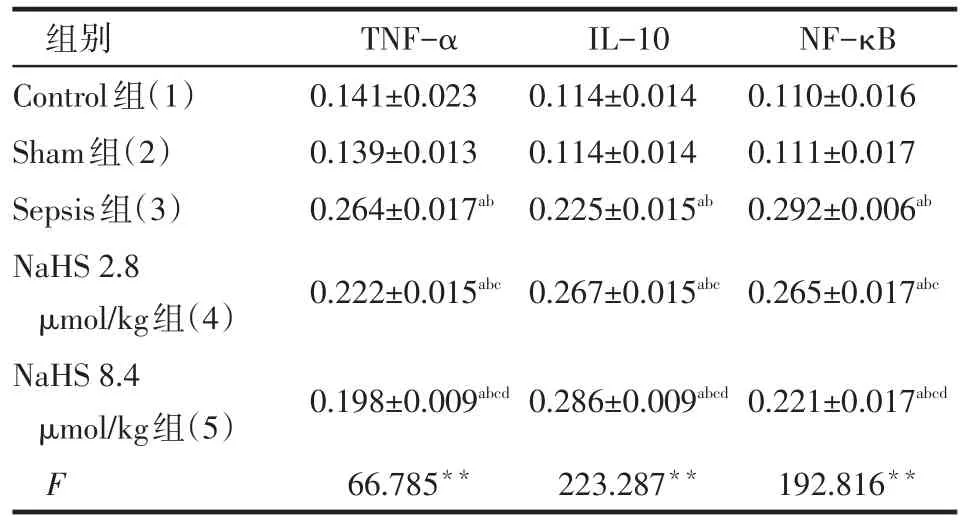
Tab.4 Quantitation of of TNF-α,IL-10 and NF-κB expression between five groups表4 术后72h各组肾组织TNF-α、IL-10、NF-κB蛋白表达平均灰度值比较 (n=6,±s)
组别Control组(1)Sham组(2)Sepsis组(3)NaHS 2.8 μmol/kg组(4)NaHS 8.4 μmol/kg组(5)F TNF-α 0.141±0.023 0.139±0.013 0.264±0.017ab0.222±0.015abcIL-10 0.114±0.014 0.114±0.014 0.225±0.015ab0.267±0.015abcNF-κB 0.110±0.016 0.111±0.017 0.292±0.006ab0.265±0.017abc0.198±0.009abcd66.785**0.286±0.009abcd223.287**0.221±0.017abcd192.816**
2.5 NaHS对尿源性脓毒血症兔血浆H2S浓度的影响 Sepsis组血浆H2S浓度低于Control组和Sham组。经静脉注射NaHS后血浆H2S浓度升高,NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组血浆H2S浓度均高于Sepsis组(均P<0.05),见图3。

Fig.3 Plasma H2S concentration in each groups 72 hours after operation图3 术后72 h各组血浆H2S浓度
2.6 NaHS对尿源性脓毒血症兔肾组织CSE活性的影响 Sepsis组、NaHS 2.8 μmol/kg组及NaHS 8.4 μmol/kg组肾组织CSE活性均低于Control组和Sham组。Sepsis组、NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组肾组织CSE活性比较差异均无统计学意义,见图4。
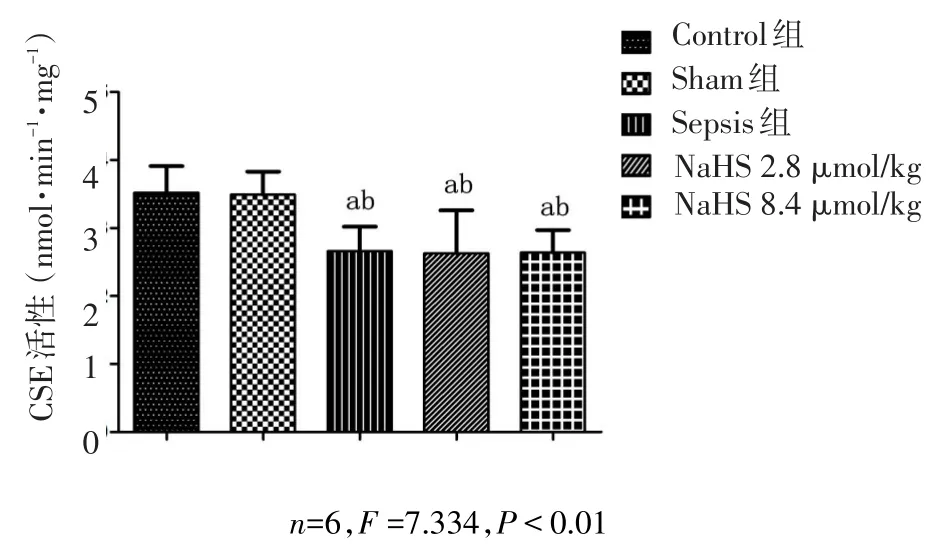
Fig.4 The kindey CSE changes in each groups 72 h after operation图4 术后72 h各组肾脏CSE变化
3 讨论
Chen等[7]通过注射脂多糖建立了尿源性脓毒血症动物模型。本实验通过结扎大白兔输尿管并注入大肠杆菌,术后72 h血WBC、Cr、BUN升高明显,提示尿源性脓毒血症建模成功,且并发急性肾功能受损。Sham组术后炎症因子及肾功能指标升高不明显,可排除手术创伤、应激对实验数据的干扰。该动物模型更接近于临床实际,为研究尿源性脓毒血症发病机制奠定了基础。
研究表明乌司他丁通过下调TNF-α,上调IL-10,能有效防治尿源性脓毒症,减轻组织器官的炎症反应[7]。脓毒血症致早期急性肾损伤早期进行肾脏替代治疗(renal replacement therapy,RRT),清除IL-10、IL-6等炎性介质,有利于器官功能的恢复,提高存活率[8]。Souza等[4]在脓毒症肾损伤的实验中发现,促红细胞生成素(EPO)通过下调NF-κB表达抑制炎症反应,对脓毒症肾损伤具有很好的保护作用。本研究中Sepsis组肾组织TNF-α、IL-10、NF-κB蛋白表达升高,随造模时间延长,肾组织损伤程度越来越严重,Cr、BUN及WBC也呈现上升趋势,光镜及电镜下观察肾组织病理损害明显。以上提示细胞因子TNF-α和NF-κB在尿源性脓毒血症肾损伤中起重要作用。
H2S可通过机体含硫氨基酸在胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)和CSE的作用下而内源性生成[9]。研究表明CBS和CSE在肾脏组织均有表达,但以CSE为主,肾组织也可内源性产生H2S,对肾脏功能具有重要的调节作用[10]。越来越多的证据显示H2S对脓毒血症核因子有着重要的调控作用,其通过抑制NF-κB信号通路,阻断炎症因子的表达,从而降低炎症反应。Li等[11]报道H2S可促进中性粒细胞向炎症部位聚集,提高中性粒细胞的迁移及黏附能力,降低血浆TNF-α、IL-1、IL-6等炎症因子水平,提高IL-10的含量,其机制与下调NF-κB有关。H2S可通过抑制NF-κB/COX-2途径减少IL-1β,IL-6和IL-8等炎症因子的产生,而降低炎症反应[12]。Pan等[13]认为H2S可抑制NF-κB的激活,上调血红素加氧酶-1(HO-1),降低TNF-α诱导的炎症反应。本研究结果显示,Sepsis组肾组织CSE表达较Control组和Sham组减弱,内源性硫化氢生成减少。应用NaHS对尿源性脓毒血症动物模型进行处理,Sepsis组、NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组肾组织CSE活性比较差异均无统计学意义;血浆H2S浓度升高,NaHS 2.8 μmol/kg组和NaHS 8.4 μmol/kg组血浆H2S浓度均高于Sepsis组,提示NaHS 为H2S的良好供体,但不能增加肾脏CSE活性,内源性H2S参与了尿源性脓毒血症肾损伤的病理生理过程。外源性给予H2S后Sepsis组肾组织TNF-α及NF-κB蛋白表达明显下降,IL-10表达增强,炎症指标及肾功能明显改善。光镜及电镜结果表明H2S可减轻尿源性脓毒血症引起的肾组织病理损害。据此推断H2S对尿源性脓毒血症肾损伤有保护作用,其机制可能是H2S通过抑制肾组织NF-κB的活性,下调TNF-α的表达,上调IL-10的表达,从而降低炎症反应。并且该保护作用在一定范围内呈剂量依赖性,8.4 μmol/kg NaHS溶液对肾脏的保护作用较2.8 μmol/kg明显。
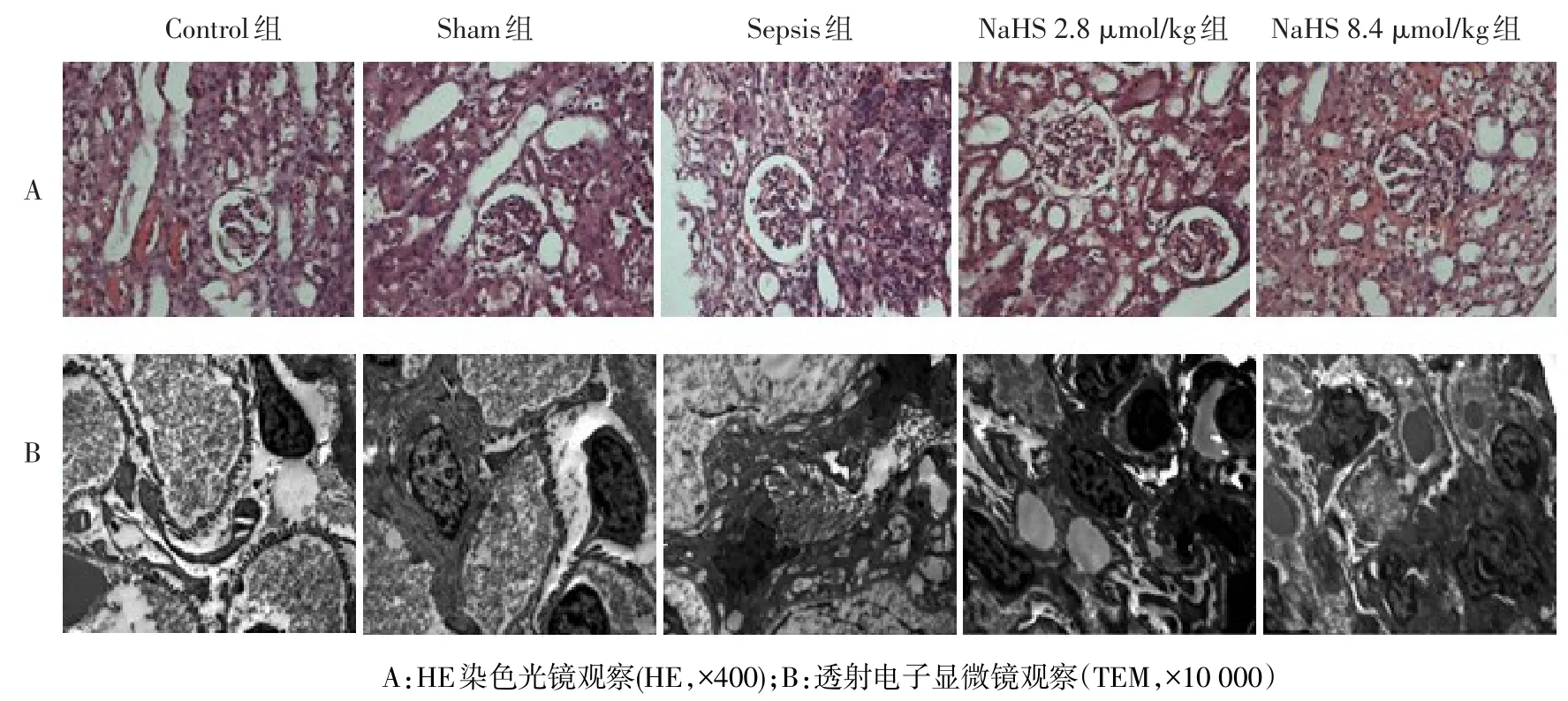
Fig.1 Pathological morphological changes of kidney in each group 72 hours post-operation图1 术后72 h各组肾脏病理形态学变化
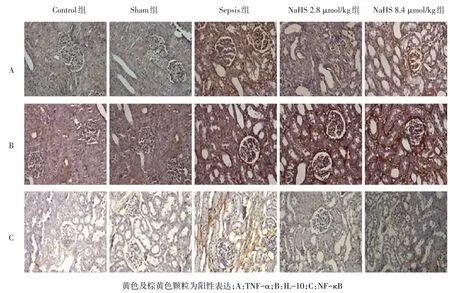
Fig.2 Immunohistochemical staining of kidney in each group 72 h after operation(immunohistochemistry,×400)图2 术后72 h各组肾脏免疫组化结果(免疫组织化学,×400)
[1]Bagshaw SM,George C,Bellomo R.Early acute kidney injurey and sepsis:a multicentre evaluation[J].Critical Care,2008,12(2):R47.
[2]Pan LL,Liu XH,Gong QH,et al.Hydrogen sulfide attenuated tumor necrosis factor-α-induced inflammatory signaling and dysfunction in vascular endothelial cells[J].PLoS One,2011,6(5):e19766.
[3]Ang SF,Sio SW,Moochhala SM,et al.Hydrogen sulfide upregulates cyclooxygenase-2 and prostaglandin E metabolite in sepsisevoked acute lung injury via transient receptor potential vanilloid type 1 channel activation[J].J Immunol,2011,187(9):4778-4787.
[4]Souza AC,Volpini RA,Shimizu MH,et al.Erythropoietin prevents sepsis-related acute kidney injury in rats by inhibiting nuclear-factor kappa B and upregulating endothelial nitric oxide synthase[J]. Am J Physiol Renal Physiol,2012,302(8):F1045-F1054.doi: 10.1152/ajprenal.00148.2011.
[5]Chattopadhyay M,Kodela R,Nath N,et al.Hydrogen sulfide-releasing aspirin suppresses NF-κB signaling in estrogen receptor negative breast cancer cells in vitro and in vivo[J].Biochem Pharmacol, 2012,83(6):723-732.
[6]Sen N,Paul BD,Gadalla MM,et al.Hydrogen sulfide-linked sulfhydration of NF-κB mediates its antiapoptotic actions[J].Mol Cell, 2012,45(1):13-24.
[7]Chen X,Wang Y,Luo H,et al.Ulinastatin reduces urinary sepsisrelated inflammation by upregulating IL10 and downregulating TNFα levels[J].Mol Med Rep,2013,8(1):29-34.
[8]Payen D,Lukaszewicz AC,Legrand M,et al.A multicentre study of acute kidney injury in severe sepsis and septic shock:association with inflammatory phenotype and HLA genotype[J].PLoS One, 2012,7(6):e35838.doi:10.1371/journal.pone.0035838.
[9]Kimura H.Hydrogen sulfide:its production,release and functions [J].Amino Acids,2011,41(1):113-121.
[10]Bełtowski J.Hypoxia in the renal medulla:implications for hydrogen sulfide signaling[J].J Pharmacol Exp Ther,2010,334(2):358-363.
[11]Li L,Salto-Tellez M,Tan CH,et al.GYY4137,a novel hydrogen sulfide-releasing molecule,protects against endotoxic shock in the rat [J].Free Radic Biol Med,2009,47(1):103-113.
[12]Yang C,Yang Z,Zhang M,et al.Hydrogen sulfide protects against chemical hypoxia-induced cytotoxicity and inflammation in HaCaT cells through inhibition of ROS/NF-κB/COX-2 pathway[J].PLoS One,2011,6(7):e21971.doi:10.1371/journal.pone.0021971.
[13]Pan LL,Liu XH,Gong QH,et al.Hydrogen sulfide attenuated tumor necrosis factor-α-induced inflammatory signaling and dysfunction in vascular endothelial cells[J].PLoS One,2011,6(5):e19766. doi:10.1371/journal.pone.0019766.
(2014-01-17收稿 2014-03-25修回)
(本文编辑 陈丽洁)
Effect of Hydrogen Sulfide on Kidney Injury Induced by Urinary-Derived Sepsis
XU Wujun1,CHEN Xian1,LUO Zhigang1,WANG Yi1,LUO Hongmei2,ZHANG Tao1,LIU Jun1
1 Department of Urology,Second Affiliated Hospital of University of South China,Hunan 421001,China;2 Department of Histology and Embryology,University of South China CHEN Xian,E-mail:ch1248@yeah.net
ObjectiveTo investigate the effect and mechanism of hydrogen sulfide(H2S)on kidney injury induced by urinary-derived sepsis.MethodsRabbits were randomly divided into Control group,Sham group,Sepsis group,NaHS 2.8 μmol/kg group and NaHS 8.4 μmol/kg group.Upper urinary tract obstruction and acute infection was induced to establish Sepsis model.At 24 h before surgery,and 24 h,48 h,72 h after surgery,blood was taken to examine white blood cell count(WBC),creatinine(Cr)and blood urea nitrogen(BUN).At 72 h after surgery,morphological changes were observed by HE staining and transmission electron microscopy.Immunohistochemical staining was used to detect TNF-α,IL-10 and NF-κB expression.Blood H2S concentration was measured by deproteinization and Cystathionine-γ-lyase(CSE)activity using spectrophotometric methylene blue method.ResultsAt 24 h,48 h,and 72 h after surgery,Levels of WBC,Cr and BUN were all elevated in Sepsis group compared with the other four groups.Levels of WBC and BUN in NaHS 8.4 μmol/kg group were lower than those in NaHS 2.8 μmol/kg group.At 24 h,48 h after surgery,there is no significant difference between levels of Cr in NaHS 8.4 μmol/kg group and that in NaHS 2.8 μmol/kg group,but Cr level in NaHS 8.4 μmol/kg group was marked lower than that in NaHS 2.8 μmol/kg group 72 hour after surgery.Pathological features of kidney injury were also alleviated by intravenous administration of NaHS.TNF-α,NF-κB expressions in NaHS 2.8 μmol/kg group and NaHS 8.4 μmol/kg group were lower than those in Sepsis group,IL-10 expression was higher than that in Sepsis group. TNF-α,NF-κB expressions in NaHS 8.4 μmol/kg group were lower than that in NaHS 2.8 μmol/kg group,whereas IL-10 expression in NaHS 8.4 μmol/kg group was higher than that in NaHS 2.8 μmol/kg group.Compared with Control group and Sham group,H2S content and CSE expression in kidney were decreased in Sepsis group.After intravenous administration of NaHS,H2S content increased,but the CSE activity has no obvious change.ConclusionExogenous H2S reduced kidney injury induced by urinary-derived sepsis through inhibiting NF-κB,decreasing TNF-α and increasing IL-10.
hydrogen sulfide;NF-kappa B;tumor necrosis factor-alpha;interleukin-10;cystathionine gamma-lyase;kidney injury;urinary-derived sepsis
R691.3
A
10.3969/j.issn.0253-9896.2014.08.010
湖南省自然科学基金项目(13JJ9009)
1湖南衡阳,南华大学附属第二医院泌尿外科(邮编421001);2南华大学组胚教研室
△通讯作者 E-mail:ch1248@yeah.net
