卵巢混合性生殖细胞肿瘤12例临床病理分析
2014-07-05郭苏阳
赵 艳 金 鑫 李 楠 郭苏阳 朱 博
(1蚌埠医学院第一附属医院临床病理科;2蚌埠医学院第一附属医院肿瘤外科;3蚌埠医学院第一附属医院妇瘤科,安徽 233000)
WHO女性生殖器官肿瘤分类(2006)将混合性生殖细胞肿瘤(mixed germ cell tumors,MGCT)定义为由两种以上生殖细胞成分构成的肿瘤,其中至少一种为原发性。主要好发于青年男性及女性性腺(睾丸和卵巢),纵隔及颅内等部位也有报道。由于其发病率较低,在日常的工作中也较为少见,病理医师和临床医师均会在诊断及治疗方面感到困惑。本文通过对12例卵巢MGCT的综合分析,总结规律,以期更完善地认识该肿瘤,并对其诊治提供理论支持。
材料和方法
1.临床病理资料
收集2005-2013年间蚌埠医学院第一附属医院经病理检查确诊的12例卵巢混合性生殖细胞肿瘤MGCT病例。具体资料见表1。
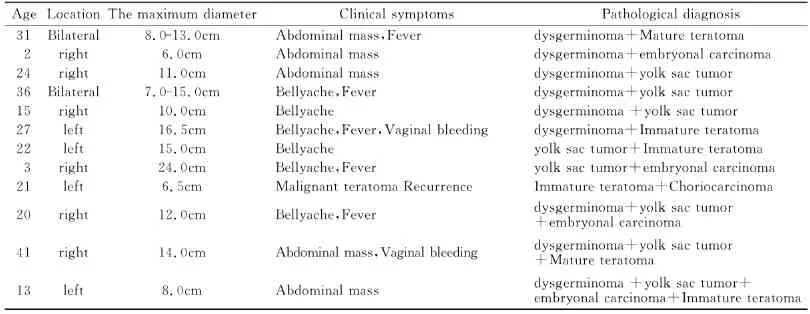
表1 12例卵巢混合性生殖细胞肿瘤MGCT临床资料Table1 clinicopathological characteristics of primary ovarian MGCT
2.方法
2.1 抗体及免疫组化染色
所有标本均经10%福尔马林固定,经常规石蜡包埋 ,4μm连续切片,HE染色,光镜观察。部分病例连续切片进行免疫组化染色(EliVision法),所用第一抗体:CD117(克隆号2E4)、PLAP(8A9)、hPL(多克隆)、hCG(ZSH17)、AFP(多克隆)、CK(AE1/AE3)、Syn(SYPO2)、GFAP(GA-5)、Ki67(SP6)、CD30(Ber-H2)、vimentin(V9)和 EMA(E29)均购自福州迈新生物技术开发有限公司。
2.2 免疫组化结果判定标准
高倍镜下随机选取5个视野,每个视野观察细胞数不少于200个,按阳性细胞所占百分比及着色深浅进行评分。阳性细胞<5%为0分,5%-25%为1分,26%-50%为2分,51%-75%为3分,>75%为4分。无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。以两项评分的乘积最终判定结果:<3分为阴性(-),3-5分为弱阳性(+),6-9分为中度阳性(++),10-12分为强阳性(+++),(+)-(+++)均视为阳性病例。
结 果
1.巨检
肿块大体均未见明显包膜,最大径6.0-24.0cm,平均15.6cm。表面光滑或呈结节状,切面取决于所含的组织学成分,灰白或灰红色、质地细腻,可呈现斑驳鱼肉状外观伴出血、坏死。
2.镜检
卵巢MGCT病理形态多样,由多种成分构成。本组病例肿瘤成分包括无性细胞瘤(9例,75%)、卵黄囊瘤(8例,66.7%)、未成熟畸胎瘤(4例,33.3%)、胚胎性癌 (4例,33.3%)、成熟性畸胎瘤(2例,16.7%)、绒毛膜癌(1例,8.3%)。其中9例(75%)包含2种不同的生殖细胞肿瘤成分,2例(16.7%)包含3种不同的肿瘤成分,1例(8.3%)包含4种不同的肿瘤成分见表1。
肿瘤中,不同成分广泛地混合或被纤维性间质分隔。无性细胞瘤成分区域排列呈条索状,巢状或结节状。细胞丰富,形态一致,呈圆形或多角形,核染色质颗粒状,核仁小,胞浆透明空泡状或嗜酸粉染,少量细胞核异型明显,核分裂象易见,间质有多少不等的淋巴细胞浸润(图1)。若间质少,有血管浸润,仅有少量淋巴细胞浸润,细胞核多形性明显,核分裂多(>3/高倍视野)趋于较高侵袭性,为间变型无性细胞瘤。卵黄囊瘤成分区域主要为疏松网状结构,可见大小不等的囊腔,网眼中含有半透明黏液样基质,杂以腺管状结构,其上皮为扁平或立方状或黏液柱状上皮细胞,间质由疏松黏液样组织和血管组成,还可有“实性”、“腺泡-腺管”、“多囊状”或更为少见的肝板样结构或特征性的Schiller-Duval小体(图2)。胚胎性癌成分主要由卵圆形、核大呈空泡状、核仁明显且强嗜酸性的细胞构成,肿瘤细胞界限不清,常形成合胞体细胞团块伴有中央坏死。部分区域构成实性团块状、网状或腺管样结构,间质有出血坏死等改变。分化差的区域由成片及团块状多形原始细胞组成,显示极少或无器官样结构,核分裂像常见(图3)。未成熟性畸胎瘤成分可见原始神经管等未成熟成分;绒癌成分主要由异型增生的滋养叶细胞构成,伴有大片出血坏死。
3.免疫表型
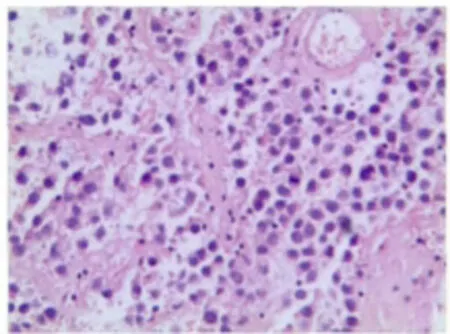
图1 无性细胞瘤区域排列呈条索状,巢状或结节状(HE×100)Fig.1 Dysgerminoma area arranged in cords,nests or nodular(HE×100)
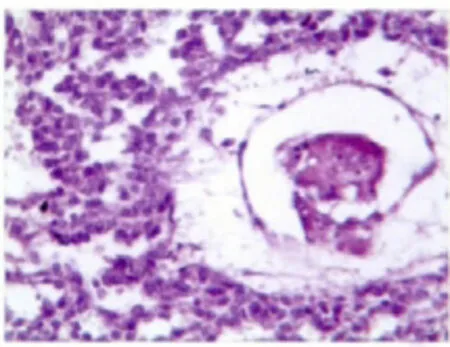
图2 卵黄囊瘤区域主要为疏松网状结构(HE×100)Fig.2 Yolk sactumor area was mainly loose reticular(HE×100)
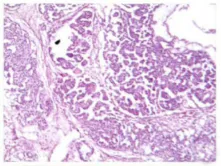
图3 胚胎性癌成分肿瘤细胞界限不清,构成实性团块状(HE×100)Fig.3 Tumor cells of Embryonal carcinomas had no evident boundary(HE×100)
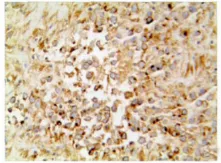
图4 PLAP在无性细胞瘤的阳性表达(Elivision法×400)Fig.4 Expression of PLAP was observed in Dysgerminoma(Elivision×400)
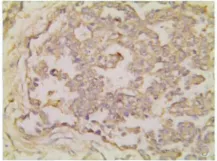
图5 AFP在卵黄囊瘤的阳性表达(Elivision法×400)Fig.5 Expression of AFP was observed in Yolk sactumor(Elivision×400)
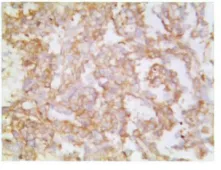
图6 CD30在胚胎性癌的阳性表达(Elivision法×400)Fig.6 Expression of CD30was observed in Embryonal carcinomas(Elivision×400)
免疫组化标记对混合性生殖细胞肿瘤的诊断起至关重要的作用。无性细胞瘤常显示PLAP(图4)和CD117胞膜强阳性。CD117胞膜强阳性是无性细胞瘤的特征性表现,尤其能鉴别其他肿瘤。胚胎性癌、卵黄囊瘤CD117阴性。AFP(图5)的斑片状胞质着色是卵黄囊瘤的特异性标记。AFP的阳性表达特别有助于一些罕见变异型卵黄囊瘤的诊断,例如子宫内膜样型和腺样型卵黄囊瘤;但不能区分肝样型卵黄囊瘤和卵巢肝样癌及转移性肝细胞癌。胚胎性癌区域CD30(图6)、OCT4、CK、EMA等抗体阳性,OCT4只在无性细胞瘤和胚胎性癌中表达。胚胎性癌CK和CD30弥漫阳性而CD117阴性可与无性细胞瘤鉴别。未成熟性畸胎瘤神经胶质成分表达GFAP,绒毛膜癌合体滋养叶细胞hCG阳性。肿瘤组织还不同程度的表达Ki-67、PCNA及P53等,其中胚胎性癌成分增殖活性较高。
4.治疗
所有病人都行手术治疗。术中探查发现对侧肿物2例,其中1例病理报告为成熟畸胎瘤。另1例为对侧受累 (含有无性成分)。手术分为两种:一种为保留生育功能手术,包括卵巢肿物剔除、一侧附件切除术。另一种为肿瘤细胞减灭术,包括全子宫双附件切除、大网膜切除、盆腹腔转移灶切除、盆腔淋巴结清扫。保留生育功能手术9例,占75%,肿瘤细胞减灭术3例,占25%。术后病人均行化疗。
5.随访
12例中4例为会诊病例,未获得随访资料。8例进行随访,其中保留生育功能手术6例中,复发二次手术3例,死亡2例。肿瘤细胞减灭术病例2例,复发死亡2例。
讨 论
卵巢MGCT是由人体内原始生殖细胞向多个方向分化形成的一组异质性肿瘤[1],多发生于年轻女性中,几乎全部在30岁以下,极少数可见于围绝经期女性。本组病例占我院同期卵巢恶性生殖细胞肿瘤的12.2% (12/98),患者年龄2-41岁,平均16.3岁。该组肿瘤早期症状常不明显,一旦发现肿物一般较大。本组病例肿瘤平均直径为15.6cm,最大直径达24.0cm。由于肿瘤体积大,生长迅速,实性或囊实性,易受重力变化发生扭转。因此腹痛、腹部包块为主要症状。
典型的病例诊断并不困难,但有时图像间的相似性易引起混淆要注意鉴别。无性细胞瘤的图像有时与胚胎性癌、幼年性颗粒细胞瘤,甚至弥漫大B细胞淋巴瘤相似。胚胎性癌是生物学上侵袭性肿瘤,大多有激素性症状(青春期早熟,异常阴道流血等),显微镜下细胞核多形性明显,细胞质嗜双色而非透明,细胞可围绕腺样裂隙有方向排列,使其呈上皮样的外观(这些细胞可产生甲胎蛋白)或可出现更像原始间叶组织的区域。细胞形态不典型时免疫组化标记可帮助诊断。胚胎性癌AFP、CK阳性而无性细胞瘤两者阴性。幼年性颗粒细胞瘤与无性细胞瘤有相似的发病年龄,但前者弥漫分布的大多角形细胞往往形成“微滤泡”“巨滤泡”“小梁状”或“岛屿状”结构,性索间质的免疫标记阳性。卵黄囊瘤有时要和卵巢透明细胞癌鉴别。后者发病年龄偏大,高峰年龄为50岁,组织学上显示较多规则的管状、乳头状结构,缺乏卵黄囊瘤的蜂窝网状囊腔和管,与前者的多形性原始细胞对比,透明细胞癌内衬细胞有丰富的透明胞质或鞋钉状膨出入腔的核。胚胎性癌也要注意与未分化癌鉴别。后者没有原始间叶合体滋养层巨细胞,免疫组化标记前者hCG、AFP,PLAP阳性,EMA阴性。后者hCG、AFP,PLAP阴性,EMA阳性。
在我们进行病例收集的过程中,还发现有生殖细胞与性索间质成分混合的病例。一位22岁女性的右侧卵巢切除标本中,大部分区域呈卵黄囊瘤的图像,但肿瘤间质内可查见散在簇状分布,胞浆丰富的嗜酸性细胞,免疫组化calretinin+,a-inhibin+,提示伴有Leidig样间质细胞分化。该例可放入非性腺母细胞型生殖细胞-性索-间质肿瘤。此类肿瘤系生殖细胞与性索间质不同方式混合,但往往以其中一种类型占优势。通常发生于性腺发育正常,染色体组型为46,XX的女性。生殖细胞方向分化的细胞大多类似卵黄囊瘤或无性细胞瘤的形态。性索间质成分多倾向衍化为支持细胞或粒层细胞前身。除此之外还有更为少见的性腺母细胞瘤及两性母细胞瘤。性腺母细胞瘤系生殖细胞混杂性索间质组成,常伴性腺发育异常,可出现男性化征象和男性化表型,90% 的病例可检测到Y染色体,染色体组型通常为46,XY或45,X。大体上瘤体较小,很多只有在显微镜下才能发现,1/3为双侧性,常有钙化。肿瘤具有特殊排列的瘤巢,同心圆钙盐沉着,可伴有一种或一种以上的其它原始生殖细胞肿瘤。两性母细胞瘤由粒层细胞和支持细胞两种成分构成缺乏生殖细胞成分。
可见,对于卵巢MGCT的诊断,一定要仔细进行镜下图像的观察,恰当运用免疫组化标记,对图像相似的肿瘤进行相应的鉴别诊断。考虑到混合性生殖细胞肿瘤后,最好补取材,多取材,避免漏诊其他肿瘤成分。临床信息及血清学检测对诊断也很有帮助。含有卵黄囊瘤和绒毛膜癌成分时,血清肿瘤标记物AFP及hCG会增高。但要注意hCG增高不一定提示绒癌,孤立性合体细胞滋养层细胞作为胚胎性癌、多胚瘤或无性细胞瘤的一部分也可以产生这种激素。即使肿瘤中相应成分极少,血清指标也可异常增高。本组病例中含卵黄囊瘤的8例中6例AFP增高,含绒癌的1例中hCG也增高。有一例初次诊断为未成熟性畸胎瘤,因血清AFP异常升高,经反复取材后确诊为混合性生殖细胞肿瘤,因此血清肿瘤标记物的测定,可提示病理医生寻找多种成分的病灶,得出客观准确的结论。因为不同成分MGCT的生物学行为和预后不同,其治疗方案也有差异[2]。如未成熟性畸胎瘤合并无性细胞瘤不影响预后,而合并胚胎性癌或绒毛膜上皮癌时预后较差。另外绒癌、卵黄囊瘤或恶性畸胎瘤占肿瘤成分1/3以上也提示预后较差[3]。故MGCT应多取材,诊断时须注明所含肿瘤成分和占优势的成分。以恶性度最高的成分及所占构成比估计预后。
恶性混合性生殖细胞肿瘤的所有成分都可发生广泛的转移播散,形成的转移瘤可有一种或多种肿瘤性生殖细胞成分。肿瘤的所有成分对铂类化疗剂呈高反应性,化疗方案应基于恶性程度最高的成分。较多的文献报道[4]:保留生育功能的手术之后辅以有效的联合化疗,患者预后良好而且能建立正常月经周期,并恢复正常卵巢功能。故很多学者主张[5]:在不伤及脏器完整性的情况下,初次手术尽可能切除肉眼可见的肿瘤,保留对侧正常附件及子宫。术后早期、足量、足疗程的应用化疗,以减少术后复发危险。
混合性生殖细胞肿瘤除可发生于女性的卵巢,也可见于男性睾丸及性腺外器官如纵隔、颅内等人体中线部位。相应部位的肿瘤应与该部位其他常见肿瘤相鉴别。病理诊断一定不能仅凭镜下图像,要结合患者的年龄、临床情况及各项实验室检查,适当的运用免疫组织化学及其他技术手段,才能得出正确结论。
[1]Rosai J著,回允中主译.阿克曼外科病理学.第9版,北京:北京大学医学出版社,2006,1704-1705
[2]王彤,孔为民,段微.卵巢恶性混合型生殖细胞肿瘤诊断治疗分析(附18例).MODERN ONCOLOGY,2010,(18)8:1614-1616
[3]Khi C,Low JJ,Tay EH,et al.Malignant ovarian germ cell tumors:the KK Hospital experience.Eur J Gynaecol Oncol,2002,23(3):251-256.
[4]El-Lamie IK,Shehata NA,Abou-Loz SK,et al.Conservative surgical management of malignant ovarian germ cell tumors:the experience of the Gynecologic Oncology Unit at Ain Shams University.Eur J Gynaecol Oncol,2000,21(6):605-609.
[5]李璡,李子庭,吴小华.卵巢恶性生殖细胞肿瘤复发相关因素分析.中国癌症杂志,2006,16(11).903-906
