小鼠脊髓损伤模型的建立及神经干细胞移植后运动功能恢复情况的研究
2014-07-05张海滨王春芳李鹏飞张振山呼钟理
张海滨 王春芳 李鹏飞 刘 佳 张振山 呼钟理 李 宵
(1山西医科大学实验动物中心;2山西医科大学科研实验中心,太原 030001;3武警山西总队直升机大队卫生所,太原 031818;4太原市中医医院,太原 030002)
脊髓损伤(spinal cord injury,SCI)是由各种原因所导致的脊髓部位受损,主要有损伤初期的原发性损伤和其后由于局部缺血、缺氧、水肿、炎症等造成的继发性损伤。是一种高致残率的严重损伤。多年研究证实,神经细胞凋亡所致的神经元大量丢失是脊髓损伤的重要病理机制[1],而脊髓损伤后会导致损伤部位以下神经支配区域肢体出现截瘫,如何有效抑制受损部位神经细胞的凋亡、促使神经细胞再生、轴突再生、准确定位轴突生长方向及恢复受损部位功能是目前治疗脊髓损伤面临的主要困难[2]及研究方向。神经干细胞(neural stem cells,NSCs)是一类存在于中枢神经系统内具有高度增殖、自我更新及分化能力,在一定条件下能分化形成神经细胞、星形胶质细胞和少突胶质细胞的原始母细胞。正常状态下NSCs处于相对静止状态,在一定诱导条件下可发生增殖、迁移和分化,具有高度自我更新能力、多潜能分化、低免疫原性和迁移功能等特性[3]。Nestin即巢蛋白,是一种胚胎中间丝(intermediate filament)蛋白,常用来标记干细胞或祖细胞[4]。是神经上皮干细胞的特异性抗原[5],在神经发生过程中一过性表达,被认为是NSCs的标志。
SCI后局部组织情况复杂,目前的临床治疗手段尚未能够起到显著地治疗作用,但随着技术的进步和仪器的改良,干细胞移植为治疗SCI提供了新的思路。本文即通过改良的Allen's法模拟一种贴近、可靠、简便、重复性好的小鼠脊髓损伤模型,并通过损伤局部注入NSCs研究其对小鼠脊髓损伤恢复的影响。
材料和方法
1.主要材料与试剂
FVB小鼠、昆明鼠(山西医科大学实验动物中心);DMEM/F12培养基、EGF、FGF、荧光定量PCR试剂(Life Technologies);脑立体定位仪(深圳沃瑞德);微量注射器(33G,10μl,瑞士汉密尔顿);Stepone Plus PCR扩增仪(ABI);荧光显微镜、倒置显微镜(OLYMPUS);体视显微镜(COIC);HE染色试剂盒(北京索莱宝);Nestin兔抗鼠一抗、Cy3标记的羊抗兔二抗(北京博奥森)。
2.小鼠SCI模型的建立
将脑立体定位仪持物杆取下,代以特制内含10 g砝码的重物打击杆,将砝码用线相连并将线上标明长度,线上升距离即砝码升高距离,以此控制打击高度和重量,制成改良Allen's脊髓打击模型(图1)。成年FVB小鼠50只,雌雄不拘,体重25-30g,随机分为空白组(5只)、模型组(15只)、对照组(15只)、治疗组(15只)。空白组不予任何处理;模型组只进行脊髓打击损伤;对照组损伤后局部注入PBS;治疗组进行NSCs移植。用10%水合氯醛3mg/kg小鼠腹腔注射,麻妥后,用电剃刀剔除背部正中被毛。俯卧位固定小鼠四肢,常规消毒,沿肋骨可触及到第13肋所对第13胸椎,由此向上约1cm做纵向切口,分离皮肤,皮下组织,颈部可见脂肪组织,沿肌肉走行分离脊椎旁肌肉组织,暴露T9、10、11椎体(T9棘突向尾部延伸、T11棘突向头部延伸),用鼠齿镊略夹起T9椎体上段,沿T11节段用小纹式钳掰除椎板,暴露T9至T11节段脊髓,术中可用体视显微镜协助操作。将充分暴露的脊髓置于改良Allen's打击模型下,用10g×1.5cm对脊髓打击,以小鼠痉挛性摆尾,双下肢及躯体回缩扑动后双下肢瘫痪为造模成功标志。迅速移开打击物。此时可见硬脊膜完整,脊髓充血呈暗红色(图2)。造模成功后检查出血并止血,温盐水冲洗伤口,逐层缝合肌肉、皮肤,伤口消毒,每日2次腹腔注射青霉素2U。每日3次按摩膀胱,协助排尿。
3.NSCs的分离、培养、鉴定
取孕14-16d昆明鼠,麻醉后取胎鼠,于体视显微镜下沿背侧正中取出胎鼠脊髓,放入4℃预冷DHanks液中,冲洗、吸管吹打,使脊髓分离成单个细胞或组织团块,将细胞悬浊液1500r/min离心5 min,弃上清,沉淀加入含EGF、FGF各20ng/ml的DMEM/F-12中培养,重悬计数后按4×105/ml接种于培养瓶中,于37℃、5%的CO2孵箱中培养,每3d半量换液。待形成神经干细胞克隆球后进行Nestin免疫荧光检测。
4.NSCs移植
模型制备后对照组于打击局部注入5μl PBS,治疗组局部注入5μl浓度约为2×106/μl的NSCs,采用10μl微量注射器,向头侧45°进针,深度1.5mm,于5min注射完毕,留针5min。
5.病理学检测
于损伤后7d麻醉小鼠,4%多聚甲醛心脏灌注后取出T9-T11节段脊髓,4%多聚甲醛固定24h,常规梯度酒精脱水、二甲苯透明、浸蜡、包埋,切片。
HE染色:切片常规脱蜡至水,苏木素染液5 min,蒸馏水冲洗,分化液分化30s,蒸馏水浸泡15 min,伊红染液2min,蒸馏水冲洗,无水乙醇脱水,二甲苯透明,中性树胶封片。
免疫荧光检测:切片常规脱蜡至水,热修复15 min,PBS洗涤5min×3次,5%山羊血清封闭20 min,加Nestin抗体(1∶200)50μl,4℃过夜。PBS洗涤5min×3次,加二抗(1∶200),室温孵育1.5h,PBS洗涤5min×3次,hochest(1∶1000)复染30 min,PBS洗涤5min×3次,甘油封片,荧光显微镜观察。
6.Nestin检测
组织RNA提取:移植7d后将损伤节段脊髓组织取出,Trizol充分混匀,静置5min,加200μl氯仿,震荡,待乳化后静置3min,12 000g离心15 min,将上层无色液体移至新EP管中,加入500μl异丙醇,混匀,室温静置10min,12 000g离心10 min,弃去上清液,加入75%酒精1ml,悬浮沉淀,7500g离心5min,弃上清,常温干燥5min。
反转录:将得到的组织RNA等比例加入Oligo(dt)18primer 1μl,RNase free d H2O 5μl,RNA 1 μl,70℃保温10min,冰上急冷2min,等比例加入5×M-MLV Buffer 2μl,dNTP Mixture 0.5μl,RNase Inhibitor 0.25μl,RTase-MLV 0.25μl,42℃保温1h,70℃保温15min,冰上急冷,得到的cDNA于-20℃保存备用。
PCR检测:本实验引物采用ABI Primer express3.0软件设计,序列如下:

Gene Primers sequences(5'-3')Nestin Forward:GGTCACTGTCGCCGCTACTC Reverse:GGTCACTGTCGCCGCTACTC β-actin Forward:CCAGTTCGCCATGGATGAC Reverse:ATGCCGGAGCCGTTGTC
利用ABI Stepone Plus定量PCR以进行PCR扩增,反应液为:SYBR Select Master Mix 10μl,引物0.6μl,dH2O 9μl,cDNA 0.4μl。每空设置2个重复,以β-actin为内参,扩增条件为:95℃2min,后95℃15Ls,58℃30Ls,72℃1min重复40次循环,应用Applied Biosystems StepOneTM Real-Time PCR Sys-tem Software所提供的Study软件进行定量分析。
7.统计学处理
实验数据用SPSS13.0软件进行统计学分析,数据以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
1.脊髓损伤模型的建立及行为学变化
所有实验小鼠在打击后均出现痉挛性摆尾,双下肢及躯体回缩扑动后双下肢瘫痪,损伤节段脊髓硬膜完整、出血、水肿(图2)。模型制作中死亡小鼠6只,后续补上。
所有麻醉后小鼠于术后2h左右苏醒,出现双下肢瘫痪,运动、感觉功能丧失,依靠双上肢移动躯体,头颈部活动正常。术后1d小鼠BBB评分均小于1分,活动明显减少,进食、饮水量减少,45只脊髓损伤小鼠中33只(73.3%)出现排尿困难,需协助排尿。7d后大部分小鼠恢复自主排尿功能,可见下肢关节轻微活动,治疗组评分高于模型组及对照组(P<0.05)。模型组和空白组之间无显著差异。
表1 不同时间点各组BBB评分比较(±s)Table1 Comparision of BBB scores in each group(±s)

表1 不同时间点各组BBB评分比较(±s)Table1 Comparision of BBB scores in each group(±s)
注:*与对照组相比P<0.05;#与模型组相比P<0.05*P<0.05,compared with control group;#P<0.05,compared with model group.
分组Groups 1d 3d 7d 14d 21d空白组Blank group 21 21 21 21 21模型组 Model group 0.80±0.78 1.33±0.72 1.40±0.63 2.20±0.78 2.53±1.06对照组control group 0.47±0.52 1.07±0.59 1.27±0.80 2.20±0.77 2.27±0.88治疗组Treatment group 0.53±0.64 1.13±0.64 1.53±0.74 3.07±1.03*# 3.93±0.96*#
2.NSCs的鉴定
采用免疫荧光法检测所培养至第三代NSCs,可见大量Nestin表达阳性细胞呈细胞球样聚集(图3),说明所培养为神经干细胞。

图3 图3:免疫荧光染色可见神经干细胞球内细胞胞浆呈Nestin阳性(绿色)×400Fig.3 Fluorescent image of NSCs was showed the cytoplasm immunopositive for Nestin(green)×400
3.组织学鉴定
3.1 HE染色
于损伤节段中央管周围、灰白质交界处可见空白组脊髓结构形态完整,组织结构致密,神经纤维排列整齐,神经细胞胞核圆大,核仁清晰,未见明显炎性细胞浸润(图4A)。脊髓损伤后可见脊髓实质内灶、片状出血,神经细胞核碎裂,组织结构疏松、水肿,灰质、白质界限模糊并有大量空泡变性。损伤处可见胶质细胞增生、神经细胞凋亡及炎性细胞浸润(图4B、C)。治疗组较模型组及对照组结构致密,细胞数量增多,出现体积小、分化程度低的有核细胞,且部分胞浆向神经细胞不同阶段分化(图4D)。
3.2 免疫荧光检测
治疗组Nestin荧光检测可见散在分布的阳性细胞,较空白组、模型组、对照组显著增多(图5)。
4.Nestin检测
实时定量PCR结果显示:四组样本中治疗组表达量最高,模型组及对照组较空白组表达量高,且治疗组与其他各组两两间均存在统计学差异(P<0.05)。
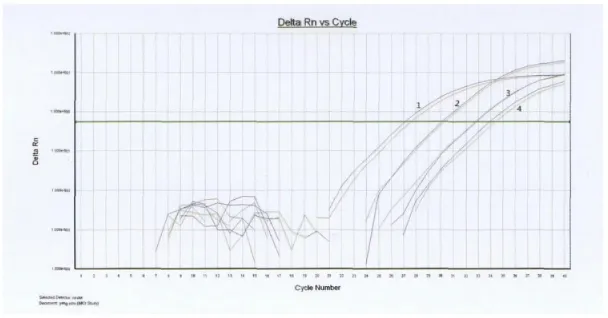
图6 Nestin扩增曲线。(1:对照组;2:治疗组;3:空白组;4:模型组)Fig.6 The PCR amplification cure of Nestin.(1:Control group;2:Treatment group;3:Blank group;4:Model group)
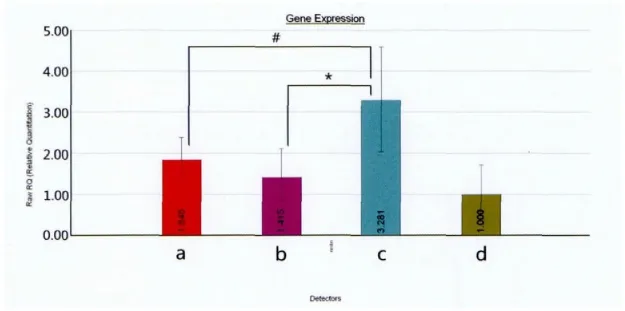
图7 Nestin相对定量结果。(a:模型组;b:对照组;c:治疗组;d:空白组)*与对照组相比P<0.05;#与模型组相比P<0.05。Fig.7 The relative quantitative results of gene Nestin.(a:Model group;b:Control group;c:Treatment group;d:Blank group)*P<0.05,compared with Control group;#P<0.05,compared with Model group.
讨 论
SCI后发生肢体截瘫是医学界多年来难以攻克的治疗难题,大量研究表明,SCI后的截瘫与局部神经元及胶质细胞坏死、凋亡,轴突出现脱髓鞘和变性密不可分[6]。如何提高损伤部位神经细胞的存活率,防止神经细胞丧失成为近年来研究的热点。很长一段时间,人们认为神经细胞是非可再生细胞,但各种干细胞的出现给了研究者对神经细胞再生修复的希望。随着科学技术的发展,人们对NSCs的研究已不止于内源性NSCs的调控和诱导再生作用,虽然内源性NSCs可以避免免疫排斥和致瘤作用[7],但成年动物NSCs存在于神经系统较深部位且数量极少,以致NSCs的分离困难较大且对机体本身的损伤极大。故目前的研究热点更倾向于外源性NSCs的移植。通过分离胚胎或成年动物中枢神经系统NSCs,体外培养并诱导分化,促进其增殖并向特定方向生长,使细胞处于不断循环往复的增殖周期中,形成可供大量使用的神经干细胞系[8]。但与此同时,如何模拟损伤后脊髓局部情况并准确把握NSCs移植的部位、时间,减低NSCs在体内产生的免疫排斥及最大化发挥外源NSCs的修复和再生作用成为目前所面临的主要问题。
本实验采用改制的脑立体定位仪制备Allen's脊髓打击模型是目前最常用被公认的SCI研究模型[9]。该模型可准确进行高度测量并精确瞄准打击部位,很大程度上提高了制造SCI模型的一致性和标准性。实验中以小鼠脊髓打击后出现痉挛性摆尾,双下肢及躯体回缩扑动后出现瘫痪,损伤节段脊髓硬膜完整,但出血、水肿,术后1dBBB评分小于1分为造模成功标准,建立了稳定性好、重复性高的脊髓打击模型。将NSCs移植注入受损脊髓节段,7d后免疫荧光染色可见到Nestin表达阳性细胞增多,且在HE染色切片中受损部位出现核碎裂和组织空泡量减少,说明NSCs于损伤部位存活,并对局部起到修复作用。SCI后一段时间内BBB评分逐渐增高,且所有小鼠运动功能在一定程度上均有所恢复,说明受损部位脊髓存在自身修复作用,但局部注入NSCs的小鼠恢复速度较模型组和对照组显著加快(P<0.05),且最终后肢运动情况改善更明显,说明NSCs可以促进脊髓损伤修复甚至直接参与到损伤修复过程。通过荧光定量PCR检测也可看出SCI后外源性NSCs注入7d时Nestin表达量可达到空白组3倍多,也显著高于模型组和对照组。本实验为避免NSCs移植对小鼠脊髓的二次损伤,选择脊髓损伤后即刻移植NSCs,这在很大程度上减少移植带来的再次损伤作用,相关研究也证实了其可行性[10],但也有研究指出[11]:脊髓损伤后24h,损伤处出现急性炎症反应,各种有神经毒性作用的炎症因子(如白细胞介素-6(IL-6)、肿瘤坏死因子(TNF)等)含量急剧增高,这一时期进行NSCs移植存活率较低。脊髓损伤后1w左右移植,NSCs存活较好,并可分化成不同类型神经细胞,因为此时急性炎症已消退,微环境进入修复阶段,有神经生长、营养因子的表达及微血管的形成,有利于移植细胞的存活。还有研究发现,NSCs脑内移植后只有1%-3%细胞可以长期存活[12],可能是由于在一定时间窗内局部微环境不适合NSCs的存活,因此,选择最佳的时间窗以提高移植细胞在新环境中的存活率,对于研究NSCs移植治疗脊髓损伤具有重要意义。而且移植细胞的存活还与移植细胞的选择、移植部位、损伤部位及有效的细胞用量[13]有密切关系。
综上,实验成功建立了小鼠SCI模型,并通过外源性NSCs于损伤局部注射的方法帮助截瘫小鼠一定程度上恢复了运动功能,说明外源性NSCs可以在受损脊髓节段存活并参与脊髓损伤后局部组织修复的过程,更进一步证实了利用外源性NSCs治疗SCI的可行性。为以后进行下一步NSCs移植实验提供了基础,也提示我们在后续实验中需要对移植局部微环境调控进行深入研究,以期更大程度上提高NSCs移植后的存活率并促进运动功能进一步的恢复。
[1]Ratan RR,Noble M.Novel multi-modal strategies to promote brain and spinal cord injury recovery.Stroke,2009,40(3suppl 1):S130-S132
[2]Tewarie RSN,Hurtado A,Bartels RH,et al.Stem cell-based therapies for spinal cord injury.The journal of spinal cord medicine,2009,32(2):105
[3]Watt FM,Hogan BL.Out of Eden:stem cells and their niches.Science,2000,287(5457):1427-1430
[4]Lendahl U,Zimmerman LB,McKay RDG.CNS stem cells express a new class of intermediate filament protein.Cell,1990,60(4):585-595
[5]Toda H,Takahashi J,Iwakami N,et al.Grafting neural stem cells improved the impaired spatial recognition in ischemic rats.Neuroscience letters,2001,316(1):9-12
[6]Tewarie RSN,Hurtado A,Bartels RH,et al.Stem cell-based therapies for spinal cord injury.The journal of spinal cord medicine,2009,32(2):105
[7]Gage FH,Coates PW,Palmer TD,et al.Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain.Proceedings of the National Academy of Sciences,1995,92(25):11879-11883
[8]Shihabuddin LS,Ray J,Gage FH.Stem cell technology for basic science and clinical applications.Archives of neurology,1999,56(1):29
[9]Abematsu M,Tsujimura K,Yamano M,et al.Neurons derived from transplanted neural stem cells restore disrupted neuronal circuitry in a mouse model of spinal cord injury.The Journal of clinical investigation,2010,120(9):3255
[10]郭家松,曾园山,李海标等.移植神经干细胞促进脊髓全横断大鼠结构与功能修复的研究.解剖学报,2003,34:113-117
[11]Ogawa Y,Sawamoto K,Miyata T,et al.Transplantation of in vitro-expanded fetal neural progenitor cells results in neurogenesis and functional recovery after spinal cord contusion injury in adult rats.Journal of neuroscience research,2002,69(6):925-933
[12]Lendahl U,Zimmerman LB,McKay RDG.CNS stem cells express a new class of intermediate filament protein.Cell,1990,60(4):585-595
[13]Savitz SI,Rosenbaum DM,Dinsmore JH,et al.Cell transplantation for stroke.Annals of neurology,2002,52(3):266-275
