重复使用氯胺酮对成年猫视皮层神经元凋亡和BDNF表达的影响
2014-07-05陈翠云孙庆艳华田苗
朱 慧 陈翠云 李 鹏 孙庆艳 华田苗
(安徽师范大学生命科学学院,芜湖 241000)
最近的医学研究发现,常用麻醉剂氯胺酮急性注射能快速缓解抑郁症病人的抑郁症状,并维持较长的抗抑郁效应[1,2],因此有可能成为临床抑郁症治疗的候选药物。然而,长期使用氯胺酮是否会导致成年脑产生神经毒性尚不清楚。
以前的研究结果显示,单次或短期重复使用氯胺酮和其他麻醉剂会导致发育阶段脑内神经元大量凋亡和神经功能衰退,但对成年个体和成熟神经元的作用不明显[3,4],其原因尚不清楚。据相关研究报道,氯胺酮对成熟神经元的NMDA受体通道的抑制作用比发育中神经元的减弱,且作用的时程较短[5,6],这可能是短期使用氯胺酮对成年个体神经元不易产生毒害作用的一个重要原因,是否长期重复使用亦会对成年脑产生神经毒性尚无直接的实验证据。另一个可能的原因是,成年脑或发育成熟的神经组织在氯胺酮等麻醉剂的作用下,可能会启动神经保护机制,如增加神经营养因子的分泌与相应的受体活动[7],以对抗神经毒性作用。
脑源性神经营养因子(BDNF)是普遍公认的影响脑内神经元存活、神经可塑性及认知功能的一种重要神经营养因子[8,9],因此在麻醉剂引起的神经毒害作用中可能会对神经元产生保护作用。目前的研究证据显示,麻醉剂对发育中大鼠脑内BDNF表达的影响存在争议,有研究发现,使用阻断NMDA受体的麻醉剂会引起BDNF表达下调,并损害发育早期小鼠的学习记忆能力[10],但也有人报道重复使用氯胺酮会增加幼鼠脑中BDNF的表达[11],其结果的差异性可能与不同发育阶段的神经网络中兴奋性与抑制性递质的相互作用及神经活动有关[12,13]。长期重复使用麻醉剂氯胺酮是否会引起正常成年脑中BDNF表达发生改变尚不清楚,从最近对抑郁症病人的研究报道推测[1],使用氯胺酮可能亦会增加正常成年脑内BDNF的表达。
为证实以上推测,本研究使用氯胺酮对成年猫实施两个月的重复麻醉注射实验,以视觉皮层为研究对象,用Nissl染色法观察和统计视觉皮层内神经元密度,用TUNEL-原位杂交试剂盒检测凋亡细胞,用免疫组织化学方法标记BDNF免疫阳性细胞,通过与对照组比较来评价长期使用氯胺酮对大脑皮层神经元存活和BDNF表达的影响。
材料和方法
1.取材和组织准备
本研究采用的实验对象为6只健康的雄性成年猫,实验猫随机分为两组,盐酸氯胺酮处理组、正常对照组各三只。盐酸氯胺酮处理组的猫每3d肌肉注射盐酸氯胺酮1次,盐酸氯胺酮的基础剂量为40 mg/kg体重,实验时间持续2m,共注射20次。对照组猫每次肌肉注射等量的生理盐水。最后1次麻醉剂注射后等待4h,将猫深麻醉,立即开胸,经左心室插管至主动脉,灌注生理盐水,至肝脏发白后灌注4%多聚甲醛进行预固定。开颅取出视皮层,并移入含4%多聚甲醛、2.5%戊二醛和30%蔗糖的固定液中固定至组织沉底。冰冻切片机连续冠状切片,切片厚30μm,每隔20张切片取5张为一组,分别用于TUNEL凋亡细胞标记、BDNF免疫组织化学标记、阴性对照和尼氏染色,每只猫取10组切片进行细胞计数和数据分析。
2.神经元Nissl染色
Nissl染色采用0.1%焦油紫室温染色8min,蒸馏水冲洗,梯度酒精脱水,二甲苯透明,树胶封片。
3.原位凋亡检测(TUNEL)法
细胞凋亡检测试剂盒(POD)购于武汉博士德公司。冰冻切片用3%H2O2室温处理10min,TBS清洗后加标记缓冲液(LabelingBuffer),37℃标记2h。TBS清洗,封闭液室温封闭30min后,滴加抗体稀释液37℃反应30min,TBS冲洗,再滴加SABC室温孵育20min,DAB显色,脱水,透明,封片。
4.BDNF免疫组织化学染色
BDNF蛋白免疫标记按常规方法分别用3%H2O2、0.3%TritonX-100及5%胎牛血清处理,然后滴加BDNF一抗(兔抗鼠多克隆抗体,浓度为1∶100,博士德产品),4℃孵育24h,PBS冲洗后滴加生物素标记二抗(羊抗兔IgG工作液,博士德产品),室温孵育20min,PBS冲洗,再滴加三抗(SABC),室温孵育20min,DAB显色,脱水,透明,封片。阴性对照以PBS液代替一抗进行孵育,其余步骤相同。
5.数据统计与分析
染色及免疫标记的切片在Olympus BX-51显微镜下观察,用Image-Pro Express 6.0图像分析软件进行图像采集,定量统计并分析。每张尼氏染色切片先在低倍镜下(×40)获取图像,再在高倍镜(×400)下分别于皮质各层选取10个视野(样方大小50μm×50μm)计数尼氏染色神经元和BDNF免疫阳性细胞数,取平均值并换算成细胞密度(cells/mm2)。从每张细胞凋亡标记切片中随机选取80个凋亡阳性细胞,用图像分析软件测定光密度值,取平均值代表凋亡神经元阳性反应强弱。从每张免疫标记切片中随机选取80个BDNF阳性细胞,用图像分析软件测定光密度值,取平均值代表免疫阳性细胞的免疫反应强弱。
所有数据用平均值±标准差()表示,用SPSS13.0统计软件进行组间数据差异性的ANOVA检验,P<0.05为差异具有统计学意义。
结 果
1.神经元密度统计与分析
尼氏染色切片中,视皮层层次分明,神经元结构清晰,细胞形态、大小各异,胞体和突起被染成蓝紫色或浅蓝色。根据尼氏染色结果,可将猫视皮层分为6层,从外向内依次为分子层(I)、外颗粒层(Ⅱ)、外锥体层(III)、内颗粒层(IV)、内锥体层(V)和多形层(VI)(图1:A-B)。
光镜下观察并统计氯胺酮处理组和对照组切片中视皮层灰质第I、II-III、IV、V、VI层的神经元密度。单因素方差分析结果显示,各组内视皮层尼氏染色神经元密度存在显著的层次差异性(P<0.05),表现为第I层尼氏染色神经元密度相对较低,II-III、IV、V、VI层神经元密度相对较高,第IV层神经元密度相对小于第II-III、V 和 VI层,但II-III、V、VI层之间的神经元密度无明显差异(表1)。神经元密度在组内个体间无显著差异(P>0.05)。视皮层各层的神经元密度在组间未发现显著差异(P>0.05),这表明实验组猫视皮层各层的神经元密度与对照组相比没有显著差异。

表1 示各组实验猫初级视皮层第I、II-III、IV、V、VI层尼氏染色神经元密度Table1 Show the density of Nissl-stained neurons in the layer I,II-III,IV,V and VI of the primary visual cortex in each group of cats
2.凋亡细胞阳性反应强度测量与分析
TUNEL法染色后,盐酸氯胺酮处理组和对照组切片中可见标记的凋亡细胞,形态学上表现为不同程度的核固缩,染色质凝聚,TUNEL染色呈棕黄色或黄褐色颗粒(图2:A-B)。
因凋亡神经元细胞核阳性反应程度有较大差异,有的反应强,而有的则很弱(图2:A-B),用阳性细胞密度不能合理地评价细胞凋亡状况,因此我们通过测定凋亡神经元TUNEL阳性反应的光密度值(IOD)来衡量细胞凋亡的程度。
对随机取样的凋亡细胞光密度值分析结果显示,氯胺酮处理组平均光密度值与对照组相比显著增加(P<0.01)(图3),表明长期重复使用氯胺酮麻醉会导致视皮层内神经元出现程序性凋亡。
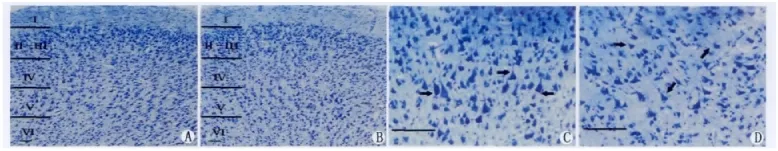
图1 示对照组(A、C)及盐酸氯胺酮处理组(B、D)猫的视皮层灰质各层中尼氏染色神经元。A、B示视皮层第I、II-III、IV、V、VI层,C、D示第III层锥体细胞。标尺为50μm。Fig.1 Show Nissl-stained neurons in each layer of the visual cortex in control(A,C)and ketamine-treated(B,D)cats.A and B display layer I,II-III,IV,V and VI in the visual cortex.C and D display pyramidal cells in the layer III.The scale bar equals to 50μm.

图2 示对照组猫(A)和盐酸氯胺酮处理组猫(B)的视皮层中细胞凋亡阳性神经元(圆圈指示)。Fig.2 Show apoptotic neurons(as circles indicated)in the visual cortex of control(A)and ketamine-treated(B)cats.

图3 示盐酸氯胺酮处理组和对照组猫的视皮层中TUNEL标记阳性神经元的平均光密度(IOD)值。盐酸氯胺酮处理组的IOD值比对照组显著增加(**P<0.01)。Fig.3 Show the average IOD (Integrated optical density)value of TUNEL-labeled neurons in the visual cortex of ketamine-treated and control cats.The mean IOD value in ketamine-treated cats was significantly increased when compared with that in control cats(**P<0.01).
3.BDNF免疫阳性细胞密度统计与分析
盐酸氯胺酮处理组和对照组视皮层中均有BDNF免疫阳性细胞分布,免疫阳性物质主要集中在胞体细胞质中,使胞体呈褐色或棕褐色,轴突和树突处染色较浅,呈棕色或浅棕色(图4:A-F)。
组内方差分析结果显示,各组实验猫视皮层BDNF免疫阳性神经元密度存在显著的层次差异性(P<0.05),表现为第I层BDNF免疫阳性细胞密度相对较低,第II-III、IV、V、VI层BDNF免疫阳性细胞密度相对较高;第IV层BDNF免疫阳性细胞密度相对小于II-III、V、VI层,而II-III、V、VI层之间的免疫阳性细胞密度无明显差异(表2)。BDNF免疫阳性细胞密度在组内个体间无显著差异(P>0.05)。
组间方差分析结果显示,氯胺酮处理组中视皮层各层BDNF免疫阳性细胞密度较对照组显著增加 (P<0.05)(图4:A-F;表2)。二组数据比较分析结果显示,麻醉剂氯胺酮会显著增加BDNF蛋白在视皮层各层的表达,与对照组相比,氯胺酮处理组中视皮层第I、II-III、IV、V、VI层 BDNF免疫阳性细胞密度显著增加(P<0.01)(表2)。

图4 示对照组(A、C、E)和盐酸氯胺酮处理组(B、D、F)猫的视皮层中BDNF免疫阳性神经元(圆圈指示)。A、B示视皮层灰质冠状切面整体观;C、D示第V/VI层BDNF免疫阳性神经元;E、F示第V层BDNF免疫阳性锥体细胞,标尺=50μm。Fig.4 Show BDNF immunoreactive neurons(as circles indicated)in the visual cortex of control(A,C,E)and ketaminetreated(B,D,F)cats.A and B are coronal sections showing aglobal view of the gray matter in the visual cortex.The scale bar equals to 50μm.C and D show BDNF positive neurons in the layer V/VI.The scale bar equals to 50μm.E and F show BDNF positive pyramidal neurons in the layer V.The scale bar equals to 50μm.

表2 示各组实验猫初级视皮层第I、II-III、IV、V、VI层BDNF免疫阳性神经元密度Table2 Show the density of BDNF-immunoreactive neurons in the layer I,II-III,IV,V and VI of the primary visual cortex in each group of cats
4.BDNF免疫反应强度测量与分析
光镜下观察,盐酸氯胺酮处理组中BDNF蛋白免疫阳性神经元着色较深,而对照组BDNF阳性神经元着色较浅。
对各层内随机抽取的BDNF免疫阳性神经元进行平均光密度分析结果显示,盐酸氯胺酮处理组平均光密度值与对照组相比显著增加(P<0.01)(图5)。以上分析表明,重复盐酸氯胺酮麻醉能显著增加成年猫视皮层BDNF蛋白表达。

图5 示盐酸氯胺酮处理组和对照组猫的视皮层中BDNF免疫阳性神经元的平均光密度(IOD)值。盐酸氯胺酮处理组的IOD值比对照组显著增加(**P<0.01)。Fig.5 Show the average IOD (Integrated optical density)value of BDNF immunoreactive neurons in the visual cortex of ketamine-treated and control cats.The mean IOD value in the ketamine-treated cats was significantly increased when compared with control cats(**P<0.01).
讨 论
随着现代临床医学和动物实验中麻醉剂使用日益增多,人们对麻醉剂可能引起的脑功能损伤问题越来越关注[14]。
氯胺酮是一种非竞争性NMDA受体通道的拮抗剂,它通过抑制兴奋性突触活动发挥镇静作用[15,16]。因为其对心脏和呼吸功能的影响很小,氯胺酮已成为临床和生理学试验中广泛使用的麻醉剂。以前的实验结果显示,单次或短期(3-4d)重复使用(<6次)麻醉剂量的氯胺酮可以引起发育中的灵长类和啮齿类动物脑内出现大量的神经元凋亡,并导致认知功能损伤[17,18],但对成年动物脑或成熟神经元的影响不明显[19]。膜片钳研究显示,氯胺酮对发育中神经元NMDA受体通道的抑制作用强,作用时程长,而对成熟神经元的抑制作用较弱且作用时程很短[6],因此单次或短期使用氯胺酮可能不会引起成年脑内出现类似未成熟脑中因NMDA受体的补偿性增生而导致的神经毒性和细胞死亡[5]。本研究结果发现,长期(60d)重复使用(20次)氯胺酮虽未引起成年猫视皮层神经元丢失,但神经元TUNEL阳性反应显著增强。综合研究文献和我们的研究结果推测,单次或短暂使用氯胺酮对成年脑的神经毒害作用很弱,但长期重复使用可能会产生累计效应,并启动程序性细胞凋亡进程。事实上,对发育中的脑可能也存在类似的累计效应,因为有研究发现,单次使用氯胺酮并不能引起幼鼠脑内出现明显的神经元凋亡,但重复使用氯胺酮即使是低剂量的也会显著增加凋亡的神经元数量[20]。
使用氯胺酮和其他麻醉剂易导致发育中脑内神经元凋亡,但对成年脑的影响作用较弱,其原因可能与脑内神经营养因子的分泌量有关,因为神经元的发育、存活、功能维持及神经可塑性均与神经营养因子特别是脑源性神经营养因子(BDNF)介导的信号通路的活动有直接关系[7,8]。有研究结果显示,使用NMDA受体的抑制剂(MK801)会导致幼年大鼠很多脑区出现大量的神经元凋亡,在注射后4h取样的脑组织中还伴随着神经营养因子特别是BDNF表达的下降以及ERK1/2-CREB信号活动减弱,而补充BDNF可完全阻止MK801诱导的神经元凋亡[21]。另有相似的研究结果显示,重复使用(7次)氯胺酮麻醉会导致幼鼠脑内神经元凋亡,但在麻醉注射15h后取样的脑组织中却出现BDNF表达的显著增加。由此推测,氯胺酮麻醉对幼鼠脑内未成熟神经元的抑制作用时程较长[6],导致BDNF的表达在麻醉后被长时间地抑制,以致发育中神经元的生长、分化和生存受到严重影响而出现凋亡。本研究用氯胺酮重复麻醉(20次)成年猫2m,发现视皮层内BDNF蛋白的表达比对照猫的显著增强,这与最近在抑郁症病人中使用氯胺酮引起的BDNF表达快速上调的报道相一致[1]。我们认为,氯胺酮麻醉引起成年脑中BDNF表达水平的增加可能是因为氯胺酮介导的NMDA受体抑制对成年脑中成熟神经元的作用较弱,且作用时程较短(1-6h)[10],因此BDNF的表达会长时间地维持在较高水平,它通过TrkB等受体信号通路使NMDA受体表达上调[22]和 GABAA受体活动抑制[23],以对抗氯胺酮对兴奋性突触活动的抑制,从而对神经元起保护作用。
总之,长期重复使用氯胺酮麻醉对成年猫视皮层神经元的数量影响不明显,但会引起部分神经元加快程序性凋亡的进程,同时视皮层内BDNF蛋白的表达出现显著上调,提示成年脑在氯胺酮的毒性影响作用下会启动神经保护机制,以抑制或减缓神经元的凋亡进程。该研究结果对临床医学以及动物慢性生理学实验中氯胺酮及其他麻醉剂的重复使用问题有重要的参考价值。
[1]Autry AE,Adachi M,Nosyreva E,et al.NMDA receptor blockade at rest triggers rapid behavioural antidepressant responses.Nature,2011,475(7354):91-95
[2]Tizabi Y,Bhatti BH,Manaye KF,et al.Antidepressant-like effects of low ketamine dose is associated with increased hippocampal AMPA/NMDA receptor density ratio in female Wistar-Kyoto rats.Neuroscience,2012,213:72-80
[3]Johnson SA,Young Cand Olney JW.Isoflurane-induced neuro-apoptosis in the developing brain of nonhypoglycemic mice.J Neurosurg Anesthesiol,2008,20(1):21-28
[4]Shen X,Dong Y,Xu Z,et al.Selective Anesthesia-induced Neuro-inflammation in Developing Mouse Brain and Cognitive Impairment.Anesthesiology,2013,118(3):502-515
[5]Liu F,Paule MG,Ali S,et al.Ketamine-induced neurotoxicity and changes in gene expression in the develo-ping rat brain.Curr Neuropharmacol,2011,9(1):256-261
[6]Jin J,Gong K,Zou X,et al.The blockade of NMDA receptor ion channels by ketamine is enhanced in developing rat cortical neurons.Neurosci Lett,2013,539:11-15
[7]Ichim G,Tauszig-Delamasure S,Mehlen P.Neurotrophins and cell death.Exp Cell Res,2012,318(11):1221-1228
[8]Numakawa T,Suzuki S,Kumamaru E,et al.BDNF function and intracellular signaling in neurons.Histol Histopathol,2010,25(2):237-258
[9]Robinet C,Pellerin L.Brain-derived neurotrophic factor enhances the hippocampal expression of key postsynaptic proteins in vivo including the monocarboxylate transporter MCT2.Neuroscience,2011,192(2011):155-163
[10]王华,张焰,张建楠等.氯胺酮对发育早期小鼠学习记忆及脑源性神经营养因子表达的影响.临床麻醉学杂志,2008,24(11):970-972
[11]Ibla JC,Hayashi H,Bajic D,et al.Prolonged exposure to ketamine increases brain derived neurotrophic factor levels in developing rat brains.Curr Drug Saf,2009,4(1):11-16
[12]Lu B.BDNF and activity-dependent synaptic modulation.Learn Mem,2003,10(2):86-98
[13]Marmigere F,Rage F,Tapia-Arancibia L.GABA-glutamate interaction in the control of BDNF expression in hypothalamic neurons.Neurochem Int,2003,42(4):353-358
[14]崔勇,刘丽华.麻醉是否对小儿智力产生影响.医学信息,2011,2011(04):1387-1388
[15]Kohrs R,Durieux ME.Ketamine:teaching an old drug new tricks.Anesth Analg,1998,87(5):1186-1193
[16]Hall RW,Shbarou RM.Drugs of choice for sedation and analgesia in the neonatal ICU.Clin Perinatol,2009,36(2):215-226
[17]Walker SM,Westin BD,Deumens R,et al.Effects of intrathecal ketamine in the neonatal rat:evaluation of apoptosis and long-term functional outcome.Anesthesiology,2010,113(1):147-159
[18]Ikonomidou C,Bosch F,Miksa M,et al.Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain.Science,1999,283(5398):70-74
[19]Hofacer RD,Deng M,Ward CG,et al.Cell-age specific vulnerability of neurons to anesthetic toxicity.Ann Neurol,2013,73(6):695-704
[20]Hayashi H,Dikkes P,Soriano SG.Repeated administration of ketamine may lead to neuronal degeneration in the developing rat brain.Paediatr Anaesth,2002,12(9):770-774
[21]Hansen HH,Briem T,Dzietko M,et al.Mechanisms leading to disseminated apoptosis following NMDA receptor blockade in the developing rat brain.Neurobiol Dis,2004,16(2):440-453
[22]Kim JH,Roberts DS,Hu Y,et al.Brain-derived neurotrophic factor uses CREB and Egr3to regulate NMDA receptor levels in cortical neurons.J Neurochem,2012,120(2):210-219
[23]Tanaka T,Saito H,MatsukiN.Inhibition of GABAA synaptic responses by brain-derived neurotrophic factor(BDNF)in rat hippo-campus.J Neurosci,1997,17(9):2959-2966
