采用GC测定调制乳中4种植物甾醇的检测方法
2014-07-02闫宁环陈伟钱文涛季国志李洪亮母智深
闫宁环,陈伟,钱文涛,季国志,李洪亮,母智深
(1.内蒙古化工职业学院,内蒙古呼和浩特011503,2.内蒙古蒙牛乳业(集团)股份有限公司,内蒙古呼和浩特011500)
采用GC测定调制乳中4种植物甾醇的检测方法
闫宁环1,陈伟2,*,钱文涛2,季国志2,李洪亮2,母智深2
(1.内蒙古化工职业学院,内蒙古呼和浩特011503,2.内蒙古蒙牛乳业(集团)股份有限公司,内蒙古呼和浩特011500)
对调制牛乳中植物甾醇的测定方法进行了研究。样品在2 mol/L乙醇氢氧化钾60℃超声水浴处理15 min后,在60℃水浴中处理45 min进行皂化处理,正庚烷萃取后,再通过吡啶及MSTFA,在80℃水浴保温10 min进行衍生化。处理好的样品利用气相色谱法进行测定。结果表明:按照该法,测定的调制牛乳中四种植物甾醇的含量为170 mg/100 g,标准品的回收率(以豆甾醇记)为86.59%~103.09%,此法操作简单,灵敏度高。
调制乳;β-谷甾醇;菜籽甾醇;菜油甾醇;豆甾醇;高效气相色谱
植物甾醇(phytohseterol or plant sterol)是一种植物中的活性成分,在结构上与动物甾醇如胆甾醇相似,主要包括β-谷甾醇、菜油甾醇、豆甾醇、菜籽甾醇和相应的烷醇等。植物甾醇和胆甾醇都是以环戊烷并全氢菲为骨架(又称甾核)的一种化合物,两者仅侧链不同。自然界中存在的植物甾醇有游离型和酯化型两种,酯化型更易溶于有机溶剂,其吸收利用比游离型约提高5倍,功能作用也更加广泛。纯的植物甾醇在常温下为白色结晶粉末,无臭无味,熔点可达130℃~140℃,大量研究表明,植物甾醇具有降低血液胆固醇、防治前列腺肥大、抗癌、类激素等多种生理功能[1]。
测定植物甾醇的方法较多,早期有毛地黄皂甙法、比色法、酶法等,这些方法只能测定植物甾醇的总含量,无法实现对各各甾醇组分进行分离定量。后来文献报道有化学法、薄层色谱法(TLC)、高新液相色谱法(HPLC)和气相色谱法(GC)等,在众多的方法中,气相色谱法(GC)具有分离效果好、分析速度快、灵敏度高、操作简便的特点,所以本研究在参照国外文献及国内对植物甾醇的测定方法的基础上[2-4],建立了调制乳中植物甾醇的测定方法,旨在为牛乳中添加植物甾醇提供监督和检验的依据。
植物甾醇在植物性食物中包括四种存在形式:即游离甾醇、甾醇酯、甾醇糖苷和酰化甾醇糖苷。因此,在分析研究样品中植物甾醇含量时,应根据样品中植物甾醇的存在形式来确定彻底分离这4种甾醇的预处理方法,以保证测定结果的准确性。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂
乙醇,分析纯;氢氧化钾(浓度C>86%),分析纯;无水硫酸钠,分析纯;庚烷,分析纯;吡啶,分析纯;MSTFA(氮甲基三甲基甲硅烷基三氟乙酰胺),分析纯;蒸馏水;β-谷甾醇(β-sitosterol),sigma公司生产,纯度≥98%;菜籽甾醇(brassicasterol),sigma公司生产,纯度100%;菜油甾醇(campestrol),sigma公司生产,纯度≥98%;豆甾醇(stigmasterol),sigma公司生产,纯度≥96.5%;2 mol/L乙醇氢氧化钾:称取65.0 g氢氧化钾(浓度C>86%)移入500 mL刻度烧瓶中,在氮气下用乙醇溶解,并定容至500 mL,在2℃温度条件下保存。
1.1.2 仪器与材料
1.1.2.1 牛乳
来源于内蒙古蒙牛乳业,乳中添加植物甾醇酯,并杀菌后无菌灌装。
1.1.2.2 仪器设备
具螺旋塞的20 mL玻璃试管;具螺旋塞的10 mL玻璃试管;1.5 mL的瓶盖可卷曲的小瓶(自动取样器的安瓿);玻璃滴管;IKA Vortex 4振动混合器;Hitachi CR21GIII离心机;KS-80D可加热的超声水浴:宁波海曙科生超声设备有限公司;Eurostar 100 Digital IKA高效搅拌器;KS-80D毛细柱气相色谱仪(带有FID检测器,7890):Agilent;毛细色谱柱:AT-5MS,60m×0.25mm/ DF=0.25 μm;注射器:1 μL。
1.1.2.3 气相色谱法条件
载气:氢气,流速5.0 mL/min;载气原始压力:42 psi(1 psi=6.895 kPa);注射器温度:310℃;检测器温度:350℃;分流:100 mL/min;升温程序:初始温度200℃,初始时间0.5 min,速率2℃/min;中间温度305℃,保持时间0 min,速率10℃/min;最终温度345℃,保持时间6min;总流动时间:63 min。
1.2 操作程序
1.2.1 标准品的处理
将β-谷甾醇(1 mg)用吡啶洗涤3次,分别称取4个标准品4 mg~5 mg(精确到0.01 mg),合并到10 mL容量瓶中,用吡啶定容并摇匀。
精密量取上述溶液0.5 mL置于2 mL进样瓶中,加入0.5 mL MSTFA,在80℃水浴条件下反应10 min,冷却即可,进样量为1 μL。
1.2.2 样品预处理
称取牛乳样品(约含1.00 mg植物甾醇)放入20 mL具螺旋塞(水解安瓿)的玻璃试管中,加入500 μL水,将试管在室温下超声水浴中处理5 min,加入1 mL 2 mol/L乙醇氢氧化钾,将试管在室温下超声水浴中处理5 min,再加入4 mL 2 mol/L乙醇氢氧化钾,密封试管,放60℃超声水浴处理15 min后,于60℃水浴中放置45 min,每隔15分钟取出,放在振动混合器中震摇2 min,冷却待用。
精确量取6.0 mL正庚烷和4 mL水,在振动混合器萃取5 min,然后在离心机中以4 300 r/min离心3 min,将上层有机液层用玻璃滴管转移到另一只20mL玻璃试管中(萃取安瓿)。
向水解安瓿中精确加入6.0 mL正庚烷,在振动混合器萃取5 min,然后在离心机中以4 300 r/min离心3 min,将上层有机液层用玻璃滴管转移到相应的萃取安瓿,加入1.5 g硫酸钠,在振动混合器将萃取安瓿震摇5 min,然后在离心机中以4 300 r/min离心3 min,将5 mL浓缩溶液转移到10 mL具螺旋塞试管,氮气流动下,在70℃~80℃温度条件下蒸发浓缩后,加入500 μL吡啶和500μLMSTFA,在80℃水浴条件下保温10min,转移到自动进样器安瓿,进样1 μL,按照气相色谱条件进行分析。
2 结果与分析
2.1 皂化温度
鲍忠定等[5],采用毛细管气相色谱法测定油中植物甾醇和胆固醇,并确定了样品皂化的最佳条件,并采用2.0 mol/L的氢氧化钾乙醇溶液在85℃水浴上皂化45 min,该法测定了芝麻油芝麻油,大豆色拉油,棕搁油,猪油中甾醇的含量。尹键等[6]利用气相色谱法测定烟草中的β-谷甾醇,研究发现直接将萃取组分进行气相色谱分析,不易实现分离,需将甾醇类酯化后再进行测定,可得出较好的分离测定结果,经过反复实验,确定酯化时间以24 h为佳。王江等[7]用GC测定了鹿角状灵芝和片状灵芝中植物甾醇(菜油甾醇、豆甾醇、β-谷甾醇)的含量。
冯妹元等[8],最终采用了饱和氢氧化钾进行皂化,皂化时间为沸水浴30 min。标准品采用BSTFA+TMCS试剂[双(三甲基硅烷基)三氟乙酰胺+三甲基氯硅烷]处理后,使甾醇的活性氢原子被硅烷基取代,使甾醇的热稳定性更高,更易挥发,同时其极性下降,检验灵敏度提高。
结合上述资料,本实验在不同碱浓度(1.0、1.5、2.0、3.0和4.0 mol/L),皂化温度(50、60、70、80、85℃)和皂化时间(15、30、45、60 min)条件下,测定牛乳中的植物甾醇。结果表明:加入1 mL 2 mol/L乙醇氢氧化钾,将试管在室温下超声水浴中处理5 min,加入4 mL 2 mol/L乙醇氢氧化钾,密封试管,放入60℃超声水浴处理15 min,另在60℃水浴中放置45 min,每隔15 min后取出,放在振动混合器中震摇2 min。调制乳中植物甾醇检测图谱如图1。
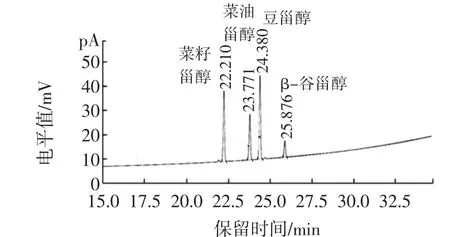
图1 标准样品GC-FID图谱Fig.1 The GC-FID spectrum of standard sample
2.2 样品回收率
采用加标回收法,在牛乳中加入一定量的豆甾醇标准品,按照样品测定方法进行处理后分析,结果表明,植物甾醇(以豆甾醇计)的平均回收率为86.59%~103.09%。
2.3 调制乳样品中植物甾醇含量测定
称取样品0.5 g左右(含1.00 mg植物甾醇),采用上述方法进行处理测定。记录色谱图,如图2所示。
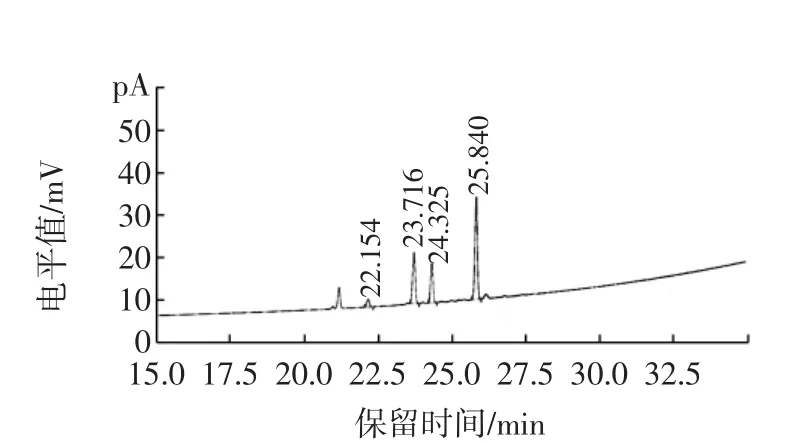
图2 调制乳中植物甾醇GC-FID图谱Fig.2 The plant sterol GC-FID spectrum of modified milk
分别计算β-谷甾醇、菜籽甾醇、菜油甾醇、豆甾醇与标样的峰面积比计算调制乳中β-谷甾醇、菜籽甾醇、菜油甾醇、豆甾醇的含量,将这四种甾醇的含量相加即为牛奶中总植物甾醇的含量,检测结果见表1。
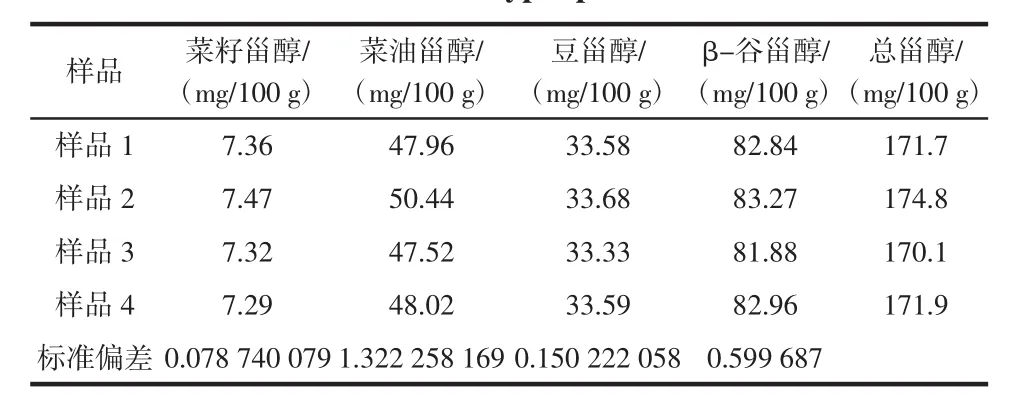
表1 调制牛乳中植物甾醇的含量测定Table 1 Determination of four types plant sterol in modified milk
3 讨论
1)牛乳中含有胆固醇,含量大约为10 mg/100 g,而胆固醇和植物甾醇的结构相似,因此在色谱图上也会出现牛奶自身含有的胆固醇,因此在计算植物甾醇(以总甾醇计)含量时,应将胆固醇含量去除。
2)植物甾醇种类较多,而其他种类甾醇含量较低且缺乏标准样品,因此本方法所测定的植物甾醇不包含全部甾醇,是以牛乳中含量较高的β-谷甾醇、菜籽甾醇、菜油甾醇、豆甾醇4种甾醇进行定量。如要测定牛乳中所含有的全部植物甾醇含量,需进一步研究验证。
[1] 韩军花,杨月欣.植物甾醇的性质、功能及应用[J].国外医学卫生学分册,2001,28(5):285-291
[2]Lena Normen,Susanne Bryngelsson,Monica Johnsson.The phytosterols content of some cereal food commonly consumed in Sweden and in the Netherlands[J].Journal of Food Composition and Analysis, 2002,15:693-704
[3]Vieno Piironen,Jari Toivo,Riitta Puupponen-Pimia.Plant sterols in vegetables,fruits and berries[J].Journal of the Science of Food and Agriculture,2003,83:330-337
[4]Jari Toivo,Katherine Phillips,Anna-Maija Lampi.Determination of sterols in foods:recovery of free,esterifiedand glycosidic sterols[J]. Journal of Food Composition and Analysis,2001,14:631-643
[5]鲍忠定,许荣年,张颂红.毛细管气相色谱法测定油中植物甾醇和胆固醇[J].分析化学,2002,30(12):1490-1493
[6] 尹键,魏万之,钟科军,等.气相色谱法侧定烟草中的β-谷甾醇[J].湖南大学学报,2000,27(6):22-27
[7]王江,昊荣,王辛.GC-测定灵芝中植物菌醉的含量[J].中国卫生检脸杂志,2004,14(2):217
[8]冯妹元,韩军花,刘成梅,杨月欣.常见精练油中植物甾醇测定方法的建立及含量分析[J].中国食品卫生杂志,2006,18(3):197-201
Determination of Four Types Plant Sterol in Modified Milk with Gas Chromatography
YAN Ning-huan1,CHEN Wei2,*,QIAN Wen-tao2,JI Guo-zhi2,LI Hong-liang2,MU Zhi-shen2
(1.Inner Mongolia vocational Institute of Chemical Technology,Hohhot 011503,Inner Mongolia,China;2.Inner Mongolia Vocational College of Chemical Engineering,Hohhot 011500,Inner Mongolia,China)
To research the sensitive method of determine the content of plant sterol in modified milk.Samples was disposed with hydroxide ultrasonic for 15 min in 2 mol/L ethanol potassium,and stayed it in 60℃water bath for 45 min,then extracting Plant sterol from liquid Heptanes,and then deriving through the Pyridine and MSTFA in 80℃water bath for 10 min.Finally,the sample was determined by Gas Chromatography.With this method,the total content of plant sterols was 170 mg/100 g,the average recovery of the standard(stigma sterol)was 86.59%-103.09%.This method was simple and accurate with high sensitivity.
modified milk;β-sitosterol;brassicasterol;campestrol;stigmasterol;Gas chromatography
10.3969/j.issn.1005-6521.2014.19.029
2013-03-19
闫宁环(1980—),女(汉),讲师,硕士,从事乳及乳制品生产工艺开发及成分研究的工作。
*通信作者:陈伟(1980—),男(汉),工程师,硕士,从事乳及乳制品生产工艺开发及成分研究的工作。
