肠膜明串株菌Leuco 4的筛选、鉴定及产糖条件的优化
2014-07-02韩瑨吴正钧季红高彩霞游春苹
韩瑨,吴正钧,季红,高彩霞,游春苹
(乳业生物技术国家重点实验室,光明乳业股份有限公司,上海200436)
肠膜明串株菌Leuco 4的筛选、鉴定及产糖条件的优化
韩瑨,吴正钧,季红,高彩霞,游春苹
(乳业生物技术国家重点实验室,光明乳业股份有限公司,上海200436)
以M17蔗糖培养基为筛选模型,从云南泡菜中筛选得到一株高产多糖的菌株Leuco 4,经鉴定为肠膜明串珠菌(CGMCCNO.6432)。对该菌株进行产糖条件优化实验后发现:在脱脂乳浓度10%(质量分数)、蔗糖浓度5%(w/v)、接种量2%(v/w)、发酵温度28℃的条件下,180r/min摇床培养80h后发酵液中多糖含量可达到11g/L以上。
肠膜明串珠菌Leuco 4;脱脂乳蔗糖培养基;产糖条件优化
微生物胞外多糖是指某些特定微生物(如乳酸菌[1-2]、土壤杆菌[3]、根瘤菌[4-5]等)在生长代谢过程中分泌到细胞壁外的一类糖类化合物,其中,依附于微生物细胞壁外的多糖被称为荚膜多糖,而黏液多糖则以渗透于生长环境中的形式存在。微生物胞外多糖不但可以赋予发酵乳制品特殊的风味[6],还具有一定的降血压[7]、降血脂、免疫调节和抗肿瘤等保健功能[8-9]。随着生活质量的不断提高,食品添加剂(如增稠剂、乳化剂、稳定剂等)的安全问题越来越受到消费者的重视,因此,寻找来源明确、产量稳定、功能多样的新型食品添加剂越来越受到研究者的重视。
明串珠菌(Leuconostoc)是一类乳品生产中重要的商业化菌株,属于革兰氏阳性菌。前期的研究表明,明串珠菌具有调节肠道紊乱[10]、代谢果糖生成甘露醇[11]、合成K族维生素[12]、水解α-半乳糖苷[13]、产细菌素[14]等益生功能,同时有助于形成干酪孔眼[15]、产生风味物质[16]。更重要的是,明串珠菌可在糖基转移酶的作用下,利用蔗糖为底物合成右旋葡聚糖(dextran,多糖的一种)[17],具有增黏、稳定、乳化水体系以及持水性等特性[18],可作为天然来源的稳定剂或增稠剂来替代现有的合成添加剂应用于食品工业,因此,明串珠菌及其产糖特性已受到广泛的重视。
本文报道了肠膜明串株菌Leuco 4的筛选、鉴定与产糖条件优化的过程,并比较了该菌株在脱脂乳蔗糖培养基和化学合成培养基中的产糖能力,旨在为明串珠菌的开发与应用提供理论依据。
1 材料与方法
1.1 试验材料
试验材料:云南泡菜,M17琼脂/液体培养基(OXOID LTD.,英国),脱脂乳粉(Foterra,新西兰),蔗糖,蛋白胨,酵母抽提物,K2HPO4,MgSO4·7H20,MnSO4,NaCl,CaCl2,FeSO4,三氯乙酸(上述材料均来自国药集团化学试剂有限公司,上海)。
1.2 主要仪器设备
108H型电炉:Fisherscientific;HVE-50型高压灭菌锅:HIRAYAMA公司;SG-402TX型超净工作台:THE BAKERCOMPANY公司;XW-80A型漩涡混合仪:上海青浦沪西仪器厂;AVANTIJ30I型高速冷冻离心机:美国BECKMANCOULTER公司;FreeZone 12型真空冷冻干燥机;美国LABCONCO公司;DK-8D型电热恒温水槽、GNP-9270型隔水式恒温培养箱:上海精宏实验设备有限公司;PHS-25型pH计:美国奥立龙公司。
1.3 方法
1.3.1 菌种的筛选、保藏与鉴定
选取云南泡菜1 g放入50 mL无菌蒸馏水中,振摇2 min后,依次用无菌蒸馏水以10倍稀释法逐管稀释成10-1、10-2、10-3、10-4、10-5系列浓度,通过涂布的方式将稀释液均匀涂布于无菌的M17蔗糖琼脂培养基上,28℃好氧培养48 h后选取拉丝性好,菌落光滑有明显突起的菌落反复接种于M17蔗糖琼脂培养基上培养以达到纯化的目的。用接种环挑取纯化后的单菌落重悬于10%(质量分数)脱脂乳中,经冷冻干燥后-80℃保藏。
采用生理生化实验结合16S rDNA基因序列比对的方法对菌株进行鉴定。
1.3.2 发酵种子的制备
将肠膜明串珠菌Leuco 4的冻干粉以少量无菌蒸馏水溶解,用接种环挑取一环划线于M17蔗糖琼脂培养[以5%(w/v)蔗糖取代M17培养基中0.5%(w/v)的乳糖,在120℃下灭菌20 min即得]上,28℃好氧培养24 h取出,用接种环挑取单菌落接入1 mL M17蔗糖液体培养基中,采用涡旋混合仪将细胞均匀分散后,28℃、180 r/min摇床培养48 h取出,再以2%(体积分数)接种量接种于50 mL上述M17蔗糖液体培养基中,再次于28℃、180 r/min摇床培养48 h,将培养物15000r/min离心10 min,弃去上清,沉淀部分以无菌蒸馏水洗涤2次后,用原培养体积的无菌蒸馏水悬浮,得到发酵用的种子。
1.3.3 发酵培养基的制备
脱脂乳蔗糖培养基的制备:将6.0%~12.0%(质量分数)脱脂乳粉与2.5%~10.0%(w/v)蔗糖按一定配比与蒸馏水混匀,充分溶解后,在120℃下灭菌20 min即得所需浓度的无菌脱脂乳蔗糖培养基。
化学合成培养基的制备:将蛋白胨10 g、酵母抽提物5 g、蔗糖50 g、K2HPO420 g、MgSO4·7H20 0.2 g、MnSO40.01 g、NaCl 0.01 g、CaCl20.02 g、FeSO40.01 g与1 L蒸馏水混匀,充分溶解后,在120℃下灭菌20 min即得所需的无菌化学合成培养基。
1.3.4 多糖的制备
将发酵液在沸水浴30 min,冷却至室温后加入三氯乙酸,使其终浓度达到2%~4%(体积分数),16 h静置,15 000 r/min离心10 min,取上清,加入3倍(体积分数)的80%~100%乙醇于上述离心后的上清液中,静置过夜,15 000 r/min离心10 min,收集沉淀物并溶于蒸馏水,用截留量为10000U的透析袋在蒸馏水中透析48h,每8小时换水1次,袋内透析液经真空冷冻干燥即可。
1.3.5 产糖条件的优化
1.3.5.1 不同接种量对肠膜明串珠菌Leuco 4多糖产量的影响
分别将肠膜明串珠菌Leuco4种子液按0.5%、1.0%、2.0%、4.0%(体积分数)的接种量接入脱脂乳蔗糖培养基中,该培养基含脱脂乳10%(质量分数)、蔗糖5%(w/v),28℃、180 r/min摇床培养,并于不同的培养时间,取发酵液按1.3.4所述方法制备多糖并称重。
1.3.5.2 不同脱脂乳浓度对肠膜明串珠菌Leuco 4多糖产量的影响
分别将肠膜明串珠菌Leuco 4种子液以2%的接种量接入脱脂乳含量为6%、8%、10%、12%(质量分数),蔗糖含量为5%(w/v)的脱脂乳蔗糖培养基中,28℃、180 r/min摇床培养48 h,发酵终点处的发酵液按1.3.4所述方法制备多糖并称重。
1.3.5.3 不同蔗糖浓度对肠膜明串珠菌Leuco 4多糖产量的影响
分别将肠膜明串珠菌Leuco 4种子液以2%的接种量接入脱脂乳含量为10%(质量分数),蔗糖含量为2.5%、5.0%、7.5%、10%(w/v)的脱脂乳蔗糖培养基中,28℃、180 r/min摇床培养48 h,发酵终点处的发酵液按1.3.4所述方法制备多糖并称重。
1.3.5.4 不同发酵温度对肠膜明串珠菌Leuco 4多糖产量的影响
将肠膜明串珠菌Leuco 4种子液以2%(体积分数)接种量接入脱脂乳蔗糖培养基中,该脱脂乳蔗糖培养基中含脱脂乳10%(质量分数),蔗糖5%(w/v),分别置于25、28、31、34℃、转速为180 r/min的摇床培养48 h,发酵终点处的发酵液按1.3.4所述方法制备多糖并称重。
1.3.5.5 肠膜明串珠菌Leuco 4在脱脂乳蔗糖培养基和纯化学培养基中的产糖能力比较
将肠膜明串珠菌Leuco 4种子液以2%(体积分数)接种量接入脱脂乳蔗糖培养基和化学合成培养基中,该脱脂乳蔗糖培养基中含脱脂乳10%(质量分数),蔗糖5%(w/v),28℃、180 r/min摇床培养120 h,取不同培养时间的发酵液按按1.3.4所述方法制备多糖并称重。
2 结果与讨论
2.1 菌种的筛选与鉴定
纯化后获得的菌株Leuco 4在M17蔗糖琼脂培养基上呈乳黄色、黏性的菌落,见图1。进一步对其进行的生理生化实验结果见表1。
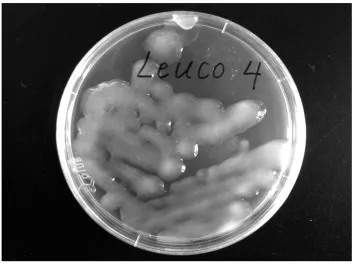
图1 肠膜明串珠菌Leuco 4在M17蔗糖琼脂培养基上的菌落形态Fig.1 Morphologic characteristic of Leuconostoc mesenteroides Leuco 4 growth on M17-sucrose media
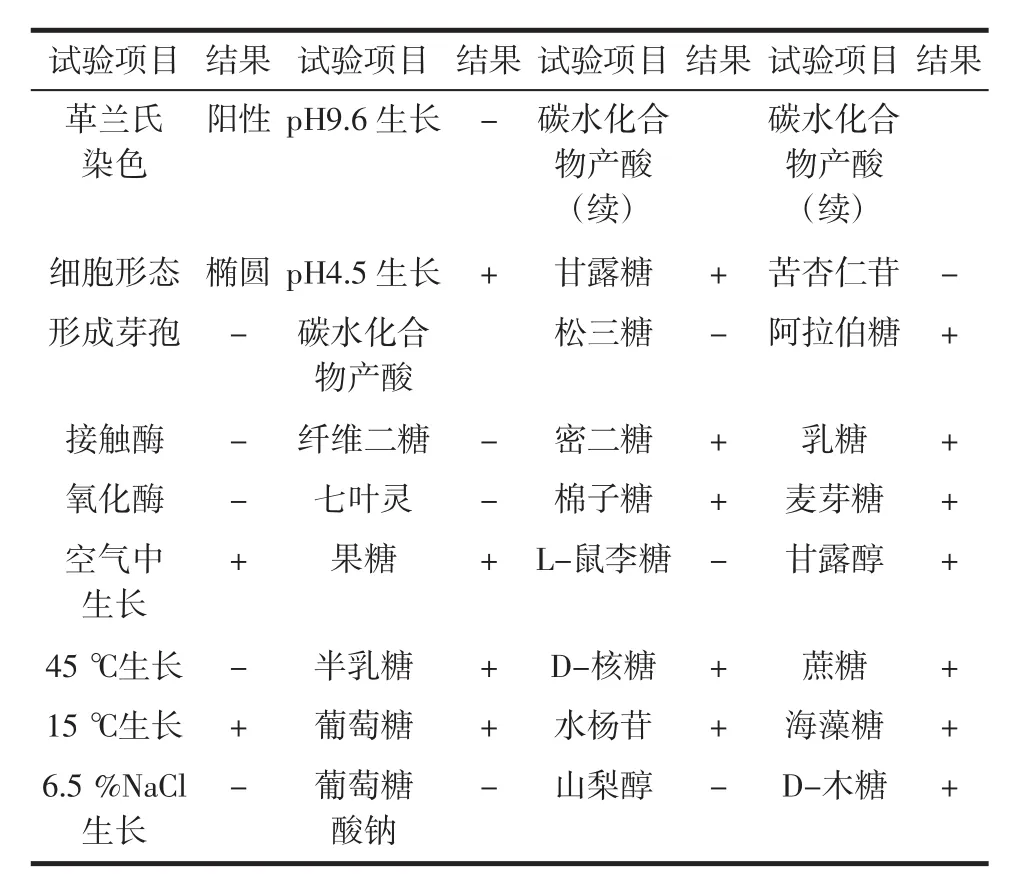
表1 肠膜明串珠菌Leuco 4的生理生化特性Table 1 Physiological and biochemical characteristics ofLeuconostoc mesenteroides Leuco 4
该结果结合其16S rDNA序列(未列出)显示Leuco 4为一株肠膜明串珠菌,现保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),编号为CGMCC NO.6432。
2.2 产糖条件的优化
2.2.1 接种量对肠膜明串珠菌Leuco 4多糖产量的影响
将肠膜明串珠菌Leuco 4的发酵种子液以不同接种量接入含有脱脂乳10%(质量分数)、蔗糖5%(w/v)的培养基中,28℃、180 r/min摇床培养,测定不同时间获得的发酵液中多糖的含量,接种量对肠膜明串珠菌Leuco 4多糖产量的影响见图2。
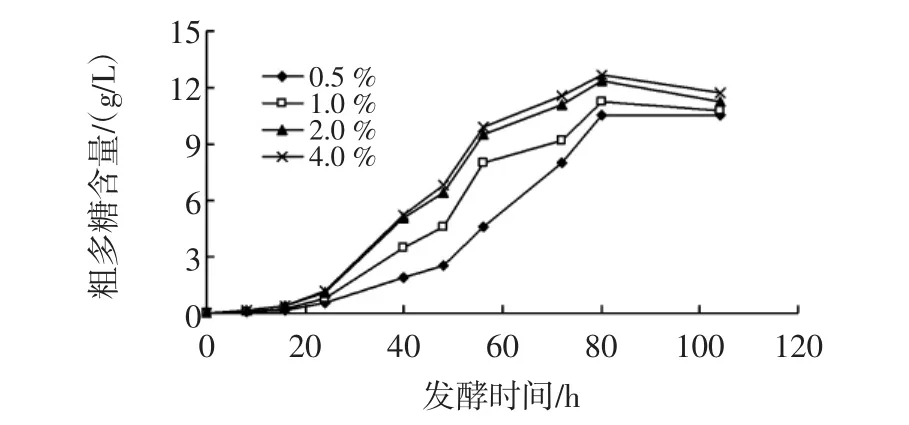
图2 接种量对肠膜明串珠菌Leuco 4多糖产量的影响Fig.2 Effect of inoculation ratio on polysaccharide-production of Leuconostoc mesenteroides Leuco 4
在发酵前20小时,不同接种量的发酵液中多糖含量差异不显著,说明在发酵初期,Leuco 4在脱脂乳蔗糖培养基中的增殖速率缓慢,不同接种量之间明串珠菌的生长差异不明显,因此产生的多糖含量相差不多。
随着发酵时间的延长,在20h至80h这段时间里,不同接种量的发酵液中多糖含量均呈明显上升趋势,菌株代谢蔗糖产多糖的能力逐渐增强。从图中可以看出,在相同的取样时间点,接种量越大的发酵液中多糖含量越高,如56h的各发酵液中多糖含量分别为:4.6g/L(0.5%)、8.0 g/L(1.0%)、9.5 g/L(2.0%)、9.9 g/L(4.0%)。
当发酵时间大于80 h时,各发酵液中累积的多糖总量不再增加,说明Leuco合成与消耗多糖的速率达到相对稳定状态,导致单位体积的发酵液中多糖总量也慢慢开始趋于稳定或减少量。
比对2.0%(体积分数)和4.0%(体积分数)接种量的发酵液中多糖含量后发现,两者对Leuco 4的产糖量影响无显著差异(P>0.05)。考虑到工业化生产的效率和经济因素,后续实验均采用2.0%(体积分数)接种量作为最适接种量。
2.2.2 脱脂乳浓度对肠膜明串珠菌Leuco 4多糖产量的影响
将肠膜明串珠菌Leuco 4的发酵种子液以2%(体积分数)接种量分别接入脱脂乳含量为6%、8%、10%、12%(质量分数),蔗糖含量为5%(w/v)的脱脂乳蔗糖培养基中,28℃、180 r/min摇床培养48 h,测定发酵终点处的发酵液中多糖含量,脱脂乳浓度对肠膜明串珠菌Leuco 4多糖产量的影响见图3。
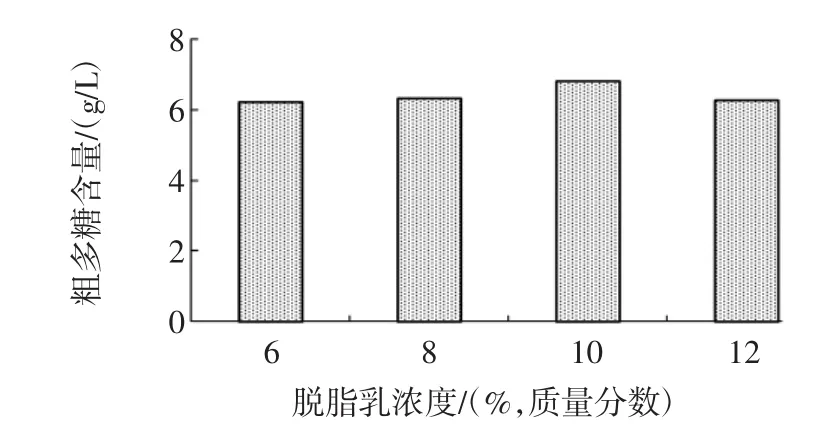
图3 脱脂乳浓度对肠膜明串珠菌Leuco 4多糖产量的影响Fig.3 Effect of skimmed milk concentration on polysaccharideproduction of Leuconostoc mesenteroides Leuco 4
不同脱脂乳浓度的发酵液中多糖含量处于同一水平,分别为:6.3 g/L(6%),6.4 g/L(8%),6.7 g/L(10%),6.2 g/L(12%),以上数据显示脱脂乳浓度对肠膜明串珠菌Leuco 4多糖产量的影响不显著(P>0.05),考虑到脱脂乳浓度10%(质量分数)的发酵液中多糖含量相对较高,因此,选用10%(质量分数)为最适脱脂乳浓度。2.2.3 蔗糖浓度对肠膜明串珠菌Leuco 4多糖产量的影响
分别将肠膜明串珠菌Leuco 4种子液以2%的接种量接入脱脂乳含量为10%(质量分数),蔗糖含量为2.5%、5.0%、7.5%、10%(w/v)的脱脂乳蔗糖培养基中,28℃、180 r/min摇床培养48 h,测定发酵终点处的发酵液中多糖含量,蔗糖浓度对肠膜明串珠菌Leuco 4多糖产量的影响见图4。
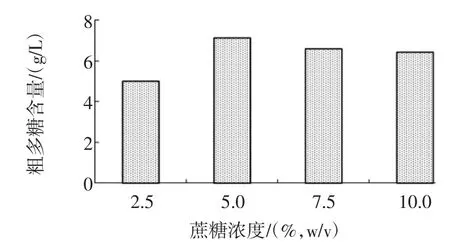
图4 蔗糖浓度对肠膜明串珠菌Leuco 4多糖产量的影响Fig.4 Effect of sucrose concentration on polysaccharideproduction of Leuconostoc mesenteroides Leuco 4
蔗糖浓度对肠膜明串珠菌Leuco 4多糖产量的影响可能与培养基中代谢底物充分度和渗透压大小的有关。不难理解,过低的蔗糖浓度会因代谢底物不充足而使多糖产量缩减,过高的蔗糖浓度则会因渗透压过高而降低Leuco 4细胞膜的通透性,从而降低了菌株的活力,同样会影响目标产物的合成。从图4中可知,肠膜明串珠菌Leuco 4在蔗糖浓度5%(w/v)的脱脂乳蔗糖培养基中代谢蔗糖产生的多糖含量最高,为7.1 g/L,说明蔗糖浓度5%(w/v)的培养基对肠膜明串珠菌Leuco 4而言代谢底物充沛、渗透压力适中,是Leuco 4发酵产多糖的最佳蔗糖浓度。
2.2.4 发酵温度对肠膜明串珠菌Leuco 4多糖产量的影响
将肠膜明串珠菌Leuco 4种子液以2%(体积分数)接种量接入上述方法制备的脱脂乳蔗糖培养基中,该脱脂乳蔗糖培养基中含脱脂乳10%(质量分数),蔗糖5%(w/v),分别置于25、28、31、34℃、180 r/min摇床培养48 h,测定发酵终点处的发酵液中多糖含量,发酵温度对肠膜明串珠菌Leuco 4多糖产量的影响见图5。
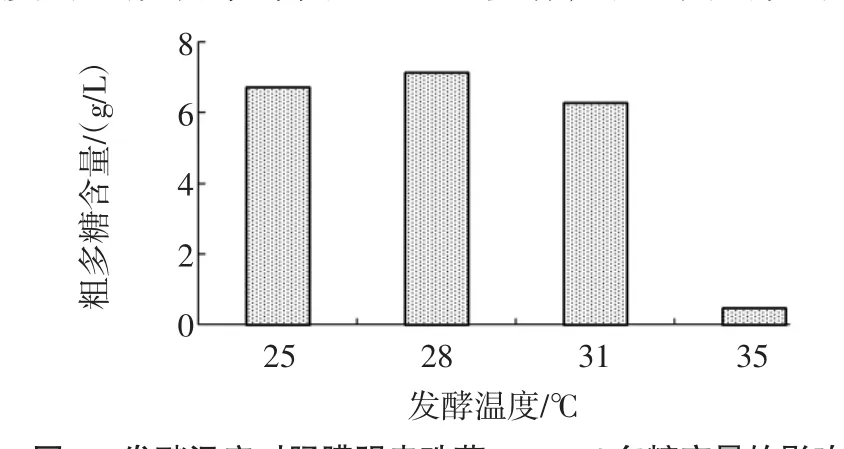
图5 发酵温度对肠膜明串珠菌Leuco 4多糖产量的影响Fig.5 Effect of fermentation temperature on polysaccharideproduction of Leuconostoc mesenteroides Leuco 4
如图5所示,肠膜明串珠菌Leuco 4在28℃条件下在相同浓度的脱脂乳蔗糖培养基中合成与积累多糖的能力最强。这可能是由于28℃发酵有利于Leuco 4利用蔗糖代谢产生胞外多糖。因此,28℃是肠膜明串珠菌Leuco 4的最优发酵温度。
2.2.5 肠膜明串珠菌Leuco 4在脱脂乳蔗糖培养基和化学合成培养基中的产糖能力比较
将肠膜明串珠菌Leuco 4种子液以2%(体积分数)接种量接入脱脂乳蔗糖培养基和纯化学培养基中,该脱脂乳蔗糖培养基中含脱脂乳10%(质量分数),蔗糖5%(w/v),28℃、180 r/min摇床培养120 h,测定不同时间获得的发酵液中多糖的含量,Leuco 4在不同培养基中的产糖能力比较见图6。

图6 肠膜明串珠菌Leuco 4在脱脂乳蔗糖培养基和化学合成培养基中的产糖能力Fig.6 Polysaccharide-production of Leuconostoc mesenteroides Leuco 4 fermenting in skimmed milk-sucrose meida and chemically defined medium
从发酵时间来看,肠膜明串珠菌Leuco 4在化学合成培养基中发酵产多糖的峰值出现在32 h,而在脱脂乳蔗糖培养基中达到峰值耗时80 h,上述数据表明Leuco 4在化学合成培养基中的增殖速率显著高于脱脂乳蔗糖培养基,这可能是两者组分构架的差异性造成的。在化学合成培养基中含有的营养成分相对全面和充足,蛋白胨、酵母抽提物等一应俱全,而脱脂乳中有营养组分相对单一和贫乏,只有乳蛋白、乳糖、乳矿物盐和少量维生素,因此,前者对Leuco 4促生长作用更强,其产糖量也随着菌株的迅速繁殖而大大增强。
从多糖产量来看,Leuco 4发酵化学合成培养基的多糖为9.5 g/L,而在脱脂乳蔗糖培养基中该产量可高达11.5 g/L,这可能是脱脂乳中的乳蛋白与乳矿物盐协同发挥了缓冲作用的结果,一定程度缓和了菌株代谢产酸破坏生境的状况,从而大大提高了菌株的存活率,因此,最终累积的多糖量更高。
3 讨论
从上个世纪中期开始,对明串珠菌进行了广泛的研究,包括化学合成培养基的设计[19]、细菌素的产生[20]、在乳中与乳球菌的共同发酵特性[21]等,这些研究成果为明串珠菌的应用提供了扎实的理论基础与技术支持。此外,随着各种高通量筛选模型的出现[22],具有各种功能的明串珠菌相继被发掘(Leuconostoc mesenteroides CMG713[23],Leuconostoc palmae sp.nov.TMW 2.694T[24],Leuconostoc mesenteroides FT045B[25]等)。
然而,有关提高明串珠菌多糖产量的报道相对较少。C Moulis(2006年)运用分子生物学的方法,利用大肠杆菌来表达Leuconostoc mesenteroides NRRL B-512F的蔗糖酶序列,获得了稳定、高活性的目标产物[26]。A Majumder则通过响应面法对化学合成培养基中的11种营养组分进行系统分析,发现吐温、蔗糖和H2PO4是影响Leuconostoc dextranicum NRRL B-1146蔗糖酶产量的关键因素[27],在蔗糖5.95%、蛋白胨0.52%、酵母抽提物2.9%的培养基中Leuconostoc dextranicum NRRL B-1146发酵产糖能力最强,为1 063 mg/L[28]。A Singh(2009) 借助紫外线照射的方法来诱导Leuconostoc dextranicum NRRL B-1146突变,最终筛选得到一株多糖产量高于出发菌株5倍的突变株[29]。不难发现,上述报道无一例外地以化学合成培养基为明串珠菌的发酵基料,而用天然食品为基料产糖至今无报道。
本文以一株自主筛选获得并保藏的肠膜明串株菌Leuco 4为基础,研究其在脱脂乳蔗糖培养基糖特性,结果表明,在脱脂乳浓度10%(质量分数)、蔗糖浓度5%(w/v)、接种量2%(v/w)、发酵温度28℃的条件下,180 r/min摇床发酵80 h的脱脂乳蔗糖发酵液中多糖含量可达到11 g/L以上,产糖量高于化学合成培养基,但产糖过程相对缓慢。鉴于这类天然产物来源的多糖在食品安全方面的应用潜力越来越大,有关明串珠菌Leuco 4快速发酵脱脂乳蔗糖培养基产糖的研究值得进一步的展开。
4 结论
采用M17蔗糖琼脂的方法,从传统发酵食品中筛选到一株高产多糖的明串菌株Leuco 4,经鉴定为肠膜明串珠菌(CGMCC NO.6432);该菌在脱脂乳浓度10%(质量分数)、蔗糖浓度5%(w/v)、接种量2%(v/ w)、发酵温度28℃的条件下,180 r/min摇床发酵80 h后,多糖产量可达到11 g/L以上。
[1]AI L Z,ZHANG H,GUO B H,et al.Preparation,partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J].Carbohydr Polym,2008,74(3):353-357
[2]PATEL S,MAJUMDER A,GOYAL A.Potentials of exopolysaccharides from lactic acid bacteria[J].Indian Journal of Microbiology, 2012,52(1):3-12
[3]RUFFING A M,CHEN R R.Transcriptome profiling of a curdlanproducing Agrobacterium reveals conserved regulatory mechanisms of exopolysaccharide biosynthesis[J].Microbial Cell Factories,2012, 11:17
[4]DJORDJEVIC S P,CHEN H,BATLEY M,et al.Nitrogen fixation ability of exopolysaccharide synthesis mutants of Rhizobium sp. strain NGR234 and Rhizobium trifolii is restored by the addition of homologous exopolysaccharides[J].Journal of bacteriology,1987, 169(1):53-60
[5]LEIGH J A,WALKER G C.Exopolysaccharides of Rhizobium:Synthesis,regulationandsymbioticfunction[J].Trends in Genetics,1994, 10(2):63-67
[6]VEDAMUTHU E R.The Dairy Leuconostoc:Use in Dairy Products [J].Journal of Dairy Science,1994,77(9):2725-2737
[7]AI L-Z,GUO B-H,ZHANG H,et al.Isolation and antihypertensive effect of exopolysaccharides from Lactobacillus casei LC2W[J]. Milchwissenschaft-Milk Science International,2008,63(1):3-6
[8]DE VUYST L,DEGEEST B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiology Reviews,1999,23(2):153-177
[9]RUAS-MADIEDO P,HUGENHOLTZ J,ZOON P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].International Dairy Journal,2002,12(2/3):163-171
[10]AGARWAL K N,BHASIN S K.Feasibility studies to control acute diarrhoea in children by feeding fermented milk preparations Ac-timel and Indian Dahi[J].European Journal of Clinical Nutrition, 2002,56:S56-S59
[11]VON WEYMARN N,HUJANEN M,LEISOLA M.Production of D-mannitol by heterofermentative lactic acid bacteria[J].Process Biochemistry,2002,37(11):1207-1213
[12]SYBESMA W,STARRENBURG M,TIJSSELING L,et al.Effects of cultivation conditions on folate production by lactic acid bacteria [J].Applied and Environmental Microbiology,2003,69(8):4542-4548
[13]HUANG D Q,PREVOST H,DIVIES C.Principal characteristics of alpha-galactosidase from Leuconostoc mesenteroides subsp.mesenteroides[J].Journal of Basic Microbiology,1994,34(2):87-95
[14]STILES M E.Bacteriocins Produced by Leuconostoc Species[J]. Journal of Dairy Science,1994,77(9):2718-2724
[15]HEMME D,FOUCAUD-SCHEUNEMANN C.Leuconostoc,characteristics,use in dairy technology and prospects in functional foods [J].International Dairy Journal,2004,14(6):467-494
[16]LIU S Q,ASMUNDSON R V,HOLLAND R,et al.Acetaldehyde metabolism by Leuconostoc mesenteroides subsp.cremoris under stress conditions[J].International Dairy Journal,1997,7(2/3):175-183
[17]MONCHOIS V,WILLEMOT R-M,MONSAN P.Glucansucrases: Mechanism of action and structure-function relationships[J].FEMS Microbiology Reviews,1999,23(2):131-151
[18]KORAKLI M,VOGEL R F.Structure/function relationship of homopolysaccharide producing glycansucrases and therapeutic potentialoftheirsynthesisedglycans[J].AppliedMicrobiologyandBiotechnology,2006,71(6):790-803
[19]KIM Y J,EOM H-J,SEO E-Y,et al.Development of a chemically defined minimal medium for the exponential growth of Leuconostoc mesenteroides ATCC8293[J].Journal of Microbiology and Biotechnology,2012,22(11):1518-1522
[20]H CHARD Y,D RIJARD B,LETELLIER F,et al.Characterization and purification of mesentericin Y105,an anti-Listeria bacteriocin from Leuconostoc mesenteroides[J].Journal of General Microbiology,1992,138(12):2725-2731
[21]BELLENGIER P,RICHARD J,FOUCAUD C.Associative growth of Lactococcus lactis and Leuconostoc mesenteroides strains in milk [J].Journal of Dairy Science,1997,80(8):1520-1527
[22]BENKERROUM N,MISBAH M,SANDINE W E,et al.Development and use of a selective medium for isolation of Leuconostoc spp. from vegetables and dairy products[J].Applied and environmental microbiology,1993,59(2):607-609
[23]SARWAT F,UL QADER S A,AMAN A,et al.Production&characterization of a unique dextran from an indigenous Leuconostoc mesenteroides CMG713[J].International Journal of Biological Sciences,2008,4(6):379-386
[24]EHRMANN M A,FREIDING S,VOGEL R F.Leuconostoc palmae sp nov.,a novel lactic acid bacterium isolated from palm wine[J].International Journal of Systematic and Evolutionary Microbiology, 2009,59:943-947
[25]PALMUTI BRAGA VETTORI M H,MARTINS FRANCHETTI S M, CONTIERO J.Structural characterization of a new dextran with a low degree of branching produced by Leuconostoc mesenteroides FT045B dextransucrase[J].Carbohydr Polym,2012,88(4):1440-1444
[26]MOULIS C,ARCACHE A,ESCALIER P-C,et al.High-level production and purification of a fully active recombinant dextransucrase from Leuconostoc mesenteroides NRRL B-512F[J].Fems Microbiology Letters,2006,261(2):203-210
[27]MAJUMDER A,GOYAL A.Enhanced production of exocellular glucansucrase from Leuconostoc dextranicum NRRL B-1146 using response surface method[J].Bioresource Technology,2008,99(9): 3685-3691
[28]MAJUMDER A,SINGH A,GOYAL A.Application of response surface methodology for glucan production from Leuconostoc dextranicum and its structural characterization[J].Carbohydr Polym,2009, 75(1):150-156
[29]SINGH A,MAJUMDER A,GOYAL A.Mutagenesis of Leuconostoc dextranicum NRRL B-1146 for higher glucan production[J].Inter J Microbiol,2009,7(1):1-7
Screening,Identification and Polysaccharide Biosynthesis Condition Optimization of Leuconostoc mesenteroides Leuco 4
HAN Jin,WU Zheng-jun,JI Hong,GAO Cai-xia,YOU Chun-ping
(State Key Laboratory of Dairy Biotechnology,Bright Dairy&Foods Co.,Ltd.,Shanghai 200436,China)
A bacterial strain Leuco-4 capable of expressing high yield of exopolysaccharide on M17-sucrose agar was isolated from pickles of Yunnan and was identified as Leuconostoc mesenteroides(CGMCC NO.6432).The optimized conditions for Leuco 4 to biosynthesize polysaccharides was found to be a combination of 10%(w/w)skimmed milk,sucrose concentration of 5%(w/v),inoculation ratio of 2%(v/w),fermentation temperature of 28℃,respectively.After cultivated aerobically at shaker of 180 r/min for 80 hours under the optimized conditions,the polysaccharide in the fermentation broth of L.mesenteroides Leuco-4 reached 11 g/L.
Leuconostoc mesenteroides Leuco 4;skimmed milk-sucrose media;polysaccharide
10.3969/j.issn.1005-6521.2014.19.030
2013-07-01
“十二五”国家科技支撑计划课题:发酵乳制品乳酸菌菌种与发酵剂的研究与开发(2013BAD18B01);“十二五”国家863项目:优良益生菌高效筛选与应用关键技术(2011AA100901)
韩瑨(1980—),男(汉),工程师,硕士,研究方向:乳品科学专业。
