匍枝根霉液态发酵产木聚糖酶培养基优化研究
2014-07-02汤文晶谢志皓张庆庆郑天柱
汤文晶,谢志皓,张庆庆,郑天柱,真 超
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
研究利用农副产品为主要碳源,液态发酵产木聚糖酶,提高农副产品的利用率.木聚糖酶[1-2]是指能够降解半纤维素木聚糖生成木寡糖和木糖的一组酶的总称,主要是由β-1,4-D-内切木聚糖酶和β-1,4-D-外切木糖苷酶组成.随着微生物工程技术的发展,国内外利用不同菌种来发酵产木聚糖酶.国内主要以黑曲霉、里氏木霉及绿色木霉为生产菌株,通过不同的诱导物诱导和发酵工艺的优化产生木聚糖酶,获得较高的产量,并应用于食品及工业;国外通过基因工程技术获得木聚糖酶基因,Dorra Driss等[3-5]通过提取青霉菌中的木聚糖酶基因,通过异源表达以及分离纯化,获得纯酶,César Rafael利用甘蔗渣、木薯片等优化培养基,获得较高的酶活.木聚糖酶的应用领域不断扩大,除了在造纸和纸浆工业领域外[6],木聚糖酶作为面包烘焙添加剂,可改善面包的弹性和硬度[7];添加木聚糖酶有助于小麦啤酒的过滤,增加啤酒酒香[8]等.
利用TP-02匍枝根霉亚种点头根霉,采用深加工农副产品为主要碳源,以成本低廉、来源丰富的玉米芯和麦麸作为原料,采用微生物液态发酵方式生产木聚糖酶,通过单因素实验,确定影响木聚糖酶酶活的主要因素和添加量,根据Box-Behnken实验设计原理,进行响应面分析实验,并借助Design Expert 8.0.5软件进行数据分析,确定最佳的发酵培养基,经过实验验证,木聚糖酶酶活得到较大提高,利用此方法生产木聚糖酶作为食品添加剂,为低成本利用生物质资源技术提供有利依据.
1 材料与方法
1.1 菌种与试剂
匍枝根霉亚种点头根霉(Rhizopus stolonifer var.reflexus TP-02),分离自黄山生态林腐木.木聚糖:桦木木聚糖(Sigma);其他试剂均为国药分析纯.
1.2 培养基和培养方法
菌种活化:将匍枝根霉亚种点头根霉在PDA斜面上30℃培养3~5d,4℃保存备用.
种子液培养:将活化好的菌株用无菌水洗下孢子用玻璃珠分散菌落,接入100mL 10%麦麸浸出汁(体积250mL三角摇瓶中)的种子培养基中,培养温度30℃,摇床转速为180r/min,恒温培养24h.
发酵基础培养基:麦麸4g,(NH4)2SO40.2g,KH2PO40.1%,MgSO4·7H2O 0.1%,CaCl20.2%,吐温-80 0.025%,微量元素液1%,灭菌后接种,在30℃,180r/min培养.
1.3 试剂配制及木聚糖酶测定方法
木糖标准液配制:配制浓度为1mg/mL.1%的木聚糖水解底物:取1%木聚糖用0.2mol/L醋酸-醋酸钠缓冲溶液(pH 4.6)溶解;微量元素液:FeSO4·7H2O,MnSO4·H2O,ZnSO4·7H2O,CoCl2.DNS显色液、木糖标准曲线的制作、木聚糖酶酶的测定方法参照文献[9],以每分钟每毫升酶液释放1umol木糖的量为1个酶活力单位(U·mL-1).酶活计算公式:(X·103)/(M·T·V)IU/mL.其中,X为标准曲线中的含糖量,mg;M为相对分子质量(木糖的相对分子质量为150.13);T为反应时间,min;V为粗酶液体积,mL.
1.4 单因素实验
以农副产品下脚料为碳源;以 NaNO3、(NH4)2SO4、NH4NO3、CO(NH2)2为氮源;以 KH2PO4、MgSO4·7H2O、CaCl2、Na2HPO4、FeSO4、MnSO4为无机盐;以SDS和吐温-80作表面活性剂;其他因素不变做单因子实验,通过实验研究确定最佳的碳源、氮源、无机盐表面活性剂及添加量.
1.5 Plackett-Burman实验
通过前期的单因素试验研究,确定匍枝根霉的影响因素为:X1,麦麸玉米芯粉混合添加量(4,6);X2,(NH4)2SO4(0.4,0.6);X3,KH2PO4(0.2,0.3);X4,MgSO4·7H2O(0.2,0.3);X6,CaCl2(0.4,0.6);X8,吐温 -80(0.07,0.105);X10,微量元素液(1,1.5);X5,X7,X9,X11,空项(-1,1),设计PB实验,以木聚糖酶酶活为响应值,用Design Expert软件对实验数据进行分析(括号内数字为PB实验低水平和高水平).
1.6 最陡爬坡实验
通过PB实验,确定发酵培养基0.2%KH2PO4,0.2%MgSO4·7H2O2,0.4%无水CaCl,1%的微量元素液,100mL的装液量,10%的接种量,选定麦麸玉米芯粉混合添加量、(NH4)2SO4、吐温-80 3个关键因素进行最陡爬坡实验.
1.7 Box-Behnken实验
由最陡爬坡实验可知,根据最陡爬坡实验2的条件为中心点,利用Design Expert软件设计响应面实验,因素及水平表如表1所示.
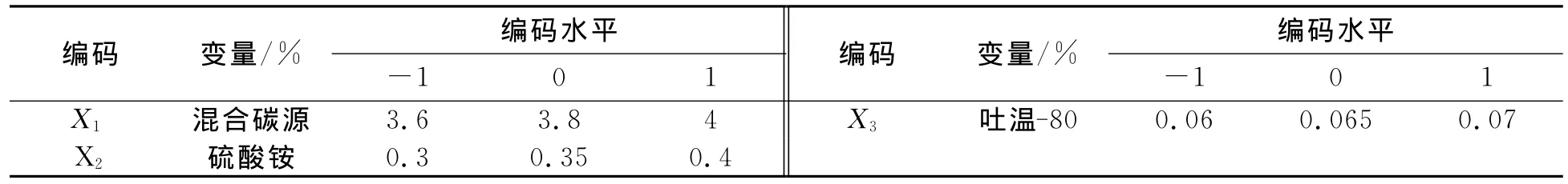
表1 Box-Behnken响应面实验因素水平表
1.8 验证试验
为检验响应面法回归方程预测是否可靠,采用响应面最佳培养基进行发酵培养,即:3.9%麦麸玉米芯,0.35%(NH4)2SO4,0.2%KH2PO4,0.2%MgSO4·7H2O,0.4%CaCl2,0.06%吐温-80,1%的微量元素液,装液量为100mL,pH自然,接种量为10%,在30℃,180r/min的摇床下培养.通过5次平行试验来确定培养基的可信度.
2 结果与分析
2.1 标准曲线确定及单因素试验结果
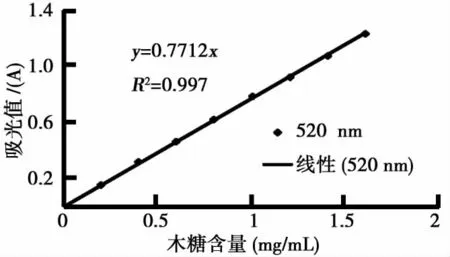
图1 木糖在520nm处标准曲线
木糖在520nm处标准曲线如图1所示.通过碳源对酶活影响分析,当以麦麸:玉米芯粉混合碳源为4%时,其产酶达到59.032U/mL;通过碳源的研究,确定(NH4)2SO4为最佳氮源,添加量为0.4%,产酶最高达55.322U/mL;通过无机盐的研究,当KH2PO4,MgSO4,CaCl2的添加量为0.2%时,其产酶达到61.970U/mL;通过表面活性剂对酶活影响的研究,添加吐温-80为0.07%时,其产酶达到68.974U/mL.
2.2 PB试验结果
根据1.6实验设计,通过软件设计及实验,Plackett-Burman试验设计结果如表2所示,其方差分析如表3所示,得到木聚糖酶酶活为响应值的线性回归方程:Y=63.86-8.63*X1-4.81*X2+0.51*X3-1.06*X4-2.53*X6-3.15*X8-2.33*X10.从各变量的系数可以看出,麦麸玉米芯粉混合添加量(X1),(NH4)2SO4(X2),MgSO4·7H2O(X4),无水 CaCl2(X6),吐温 -80(X8),微量元素液(X10),呈负效应,在后续实验中应取低水平;KH2PO4(X3)呈正效应,在后续实验中应增加其含量.方差分析模型的Prob(P)>F值为0.002 4,该模型相关系数R2=0.982 2,修正决定系数实验数据的变异性可用此回归模型来解释;表明所得回归方程达到极显著,即该模型在被研究的整个回归区域拟合很好.通过显著性研究,X1,X2,X8对木聚糖酶产量影响较大,通过爬坡实验和响应面实验进行优化研究.

表2 Plackett-Burman试验设计及结果

表3 影响因素的显著性分析
2.3 最陡爬坡实验结果
最陡爬坡实验设计及实验结果如表4如示.由表4可知,木聚糖酶的产量随着关键因素变化而变化,产量最高值出现在第2组,达到89.288U/mL,说明此时麦麸玉米芯粉的混合碳源、(NH4)2SO4、吐温-80的浓度最高值接近最优,故选择第2组作为中心点,进一步对培养基进行优化.
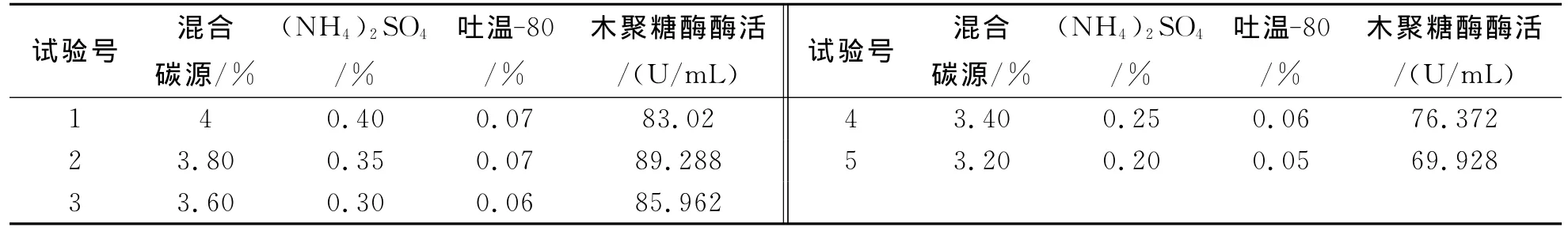
表4 最陡爬坡实验设计及实验结果
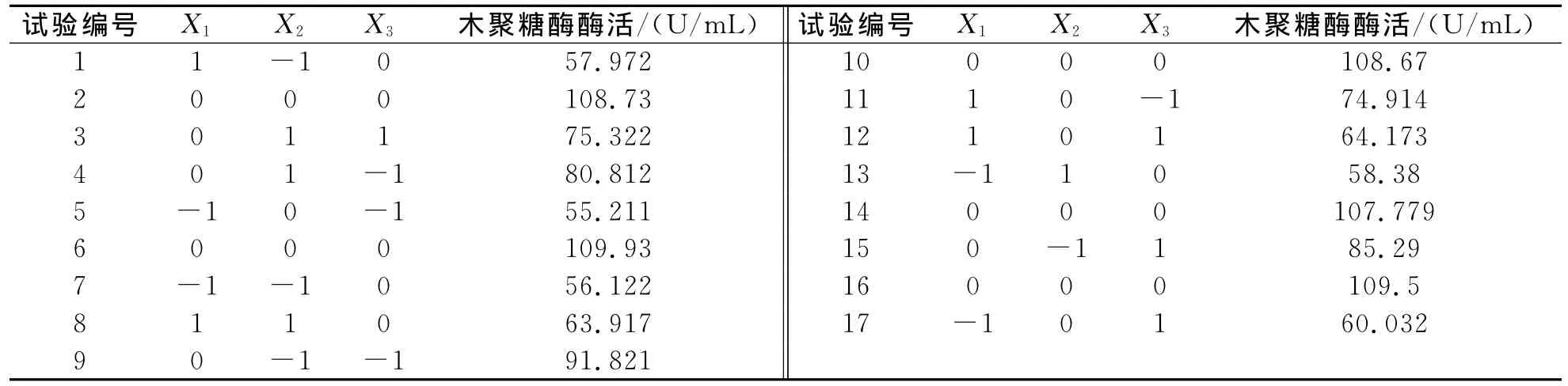
表5 Box-Behnken实验设计及结果
Box-Behnken实验设计及结果如表5所示.以木聚糖酶酶活为响应值,对表5中的实验结果进行二次回归分析,得到的回归方程:Y=108.92+3.9*X1-1.6*X2-2.24*X3+0.92*X1X2-3.89*X1X3+回归方程的方差分析如表6所示.该模型极显著,即Pr>F值<0.0001.在该模型各参数中,X1对木聚糖酶产量有较显著的影响,即麦麸玉米芯粉混合碳源是对实验结果影响较大的因子对木聚糖酶的产量影响也达到显著水平,说明(NH4)2SO4,吐温-80对木聚糖酶产量的影响也是二次关系.该模型相关系数R2=0.9802,修正决定系数表明该模型预测值和实测值拟合良好,可以很好地解释响应值的变化.

表6 Box-Behnken回归方程的方差分析
用Design expert 8.0.5软件对回归模型进行响应面分析,得到各响应面立体分析图和等高线图(见图2).由图2及软件分析可知,回归方程存在稳定点.通过分析可知,X1,X2,X3的编码值分别为3.9%,0.35%,0.06%,即麦麸玉米芯粉混合碳源,(NH4)2SO4,吐温-80的含量,此条件下预测得到木聚糖酶酶活为102.221U/mL.

图2 响应面法三维曲面和等高线图
2.4 验证试验
在最优条件下,通过5次平行试验,所得木聚糖酶平均酶活为101.697U/mL,方差分析如表7所示.与预测值相比,相对误差在1%以内,这表明响应面法拟合的方程可以用于预测实际的木聚糖酶产量.

表7 平行试验方差分析
3 结果与讨论
木聚糖酶在饲料、食品、纺织等诸多领域得到应用,玉米芯粉和麦麸是农业的副产物,具有较秸秆类半纤维素相对丰富,成本低来源广的特点,是一种生产畜牧饲料添加剂的重要发酵碳源.吐温-80具有低毒性的特点,适量的添加有助于酶的分泌.本研究筛选的匍枝根霉具有较高的木聚糖酶酶活,利用响应面法进行培养基优化,回归方程精确度高,使培养基优化更加合理性和科学性.
本研究利用响应面法优化匍枝根霉产木聚糖酶培养基,提高该菌株的产酶量.在单因素水平试验的基础上,结合PB设计试验及响应面分析,对各因素进一步优化,最终确定最佳发酵培养基为:3.9%麦麸玉米芯粉混合碳源,0.35%(NH4)2SO4,0.2%KH2PO4,0.2%MgSO4·7H2O,0.4%CaCl2,0.06%吐温-80,1%的微量元素液,pH自然,液体培养.在30℃,180r/min的摇床下培养.木聚糖酶酶活可达到101.696 3U/mL,其产量比优化前提高了3.5倍,得到了较高的木聚糖酶酶活,优于文献报道的匍枝根霉产木聚糖酶酶活.
[1] 聂国兴,王俊丽,明红.木聚糖酶的应用现状与研发热点[J].工业微生物,2008,38(1):53-59.
[2] 方微,单玉萍,李峰,等.木聚糖酶的作用机理及其在饲料中的应用[J].中国饲料,2011,21:21-24.
[3] 万红贵,武振军,蔡恒,等.微生物发酵产木聚糖酶研究进展[J].中国生物工程杂志,2010,30(2):141-146.
[4] Dorra Driss,Fatma Bhiri,Raoudha ghorbel,et al.Cloning and constitutive expression of His-tagged xylanase GH 11 from Penicillium occitanis Pol 6in Pichia pastoris X33:Purification and characterization[J].Protein Expression and Purification,2012,83:8-14.
[5] César Rafael Fanchini Terrasan,Beatriz Temer,Marta Cristina Teixeira Duarte,et al.Production of xylanolytic enzymes by Penicillium janczewskii[J].Bioresource Technology,2010,101:4 139-4 143.
[6] 毛连山,余世袁.木聚糖酶在纸浆漂白中应用的研究现状[J].中国造纸学报,2006,21(3):93-98.
[7] 张勤良,王璋,许时婴.中性木聚糖酶在面包制作中的应用[J].食品与发酵工业,2004,30(7):21-25.
[8] 杨观中.真菌木聚糖酶在小麦啤酒酿造中的应用[J].酿酒,2007,34(1):51-53.
[9] 王俊丽,聂国兴,曹香林,等.不同DNS试剂测定木糖含量的研究[J].食品研究与开发,2010,31(7):1-4.
