金针菇免疫调节蛋白基因fip-fve在毕赤酵母GS115中诱导型和组成型表达
2014-06-15林景卫贾佳钟鸣陈丽静李浩戈郭志富齐明芳刘立侠李天来
林景卫,贾佳,钟鸣,陈丽静,李浩戈,郭志富,齐明芳,刘立侠,李天来
农业生物技术
金针菇免疫调节蛋白基因fip-fve在毕赤酵母GS115中诱导型和组成型表达
林景卫1,2,贾佳2,钟鸣2,陈丽静2,李浩戈2,郭志富2,齐明芳1,刘立侠3,李天来1
1 沈阳农业大学园艺学院,辽宁 沈阳 110866
2 沈阳农业大学生物科学技术学院,辽宁 沈阳 110866
3 东北师范大学生命科学学院,吉林 长春 130024
为获得稳定来源并且具有生物学活性的重组金针菇免疫调节蛋白 (Fip-fve),将fip-fve基因转至毕赤酵母GS115中进行诱导型和组成型表达。用PCR方法从金针菇子实体基因组DNA中扩增fip-fve基因,连接至pPIC9构建诱导型表达载体pPIC9-FIP-fve,从毕赤酵母基因组DNA中扩增三磷酸甘油醛脱氢酶启动子(pgap),替换pPIC9-FIP-fve上乙醇氧化酶启动子 (paox1) 构建组成型表达载体pPIC9-PGAP-FIP-fve。将线性化的两种表达载体用PEG法转化毕赤酵母GS115,经组氨酸缺失培养基筛选和酵母菌落PCR鉴定后进行表达。结果表明,重组Fip-fve在以甲醇 (1%,V/V) 为碳源进行诱导型表达4 d达到最高,粗蛋白表达量为158.2 mg/L,在以葡萄糖 (10%) 和甘油 (1%,V/V) 为碳源进行组成型分别在表达第4天和第5天达到最高,粗蛋白分别为46.3 mg/L和29.5 mg/L。SDS-PAGE及Western blotting证明重组Fip-fve已正确表达,血细胞凝集活性检测初步证明重组Fip-fve具有良好生物学活性。
金针菇,免疫调节蛋白,毕赤酵母,组成型表达
金针菇免疫调节蛋白 (Fip-fve) 是上个世纪末从金针菇子实体中提纯的一种小分子功能蛋白质,隶属于真菌免疫调节蛋白 (Fip) 家族[1]。迄今为止,多种真菌免疫调节蛋白已被发现,包括灵芝、松杉灵芝、草菇、黑芝和紫芝等[2-5],该家族蛋白由110个左右氨基酸组成,分子量为12–13 kDa,具有免疫调节和抗肿瘤活性。Fip-fve由114个氨基酸组成,分子量为12.7 kDa,与第一个已知的真菌免疫调节蛋白——LZ-8具有63%的同源性[2],天然的Fip-fve为类似哑铃型的同源二聚体[6-7],在酸性和高低温条件下均能保持良好的生物学活性[8]。Fip-fve具有血细胞凝集活性,可以在体外凝集4种类型的人血细胞。Fip-fve还可以促进人外周血淋巴细胞增殖,并且明显增加多种细胞因子分泌包括白介素2和干扰素γ[9]。Fip-fve具有良好的抗过敏活性,有研究表明其可以完全抑制由牛血清蛋白 (BSA) 引起的小鼠系统过敏反应[1],能够抑制嗜酸性粒细胞引起的过敏性鼻炎[10],Fip-fve还可以抑制卵清蛋白 (OVA) 引起的食物过敏反应[11]和用来治疗羽刺皮癣螨2型抗原 (Dp-2) 引起的呼吸道炎症[12]。此外,Fip-fve还具有抗肿瘤活性[13],Chang等发现给患有肝癌的小鼠口服喂食Fip-fve可以延长患病小鼠的存活期[14],干扰素γ可能是起抗肿瘤活性的关键效应分子[15-16]。
从天然金针菇子实体中提纯Fip-fve过程繁琐,费时费力,而且产率较低[5],因此越来越多的研究学者尝试利用基因工程的手段在不同的表达宿主中重组表达Fip-fve,以期望得到高效表达的重组蛋白。1997年,Lin等首先将fip-fve基因转化至大肠杆菌TG1中,获得了谷胱甘肽-S转移酶融合的重组真菌免疫调节蛋白,表达水平分别5 mg/L, 但是其生物学活性仅为天然Fip-fve的一半[17]。之后,他们又将该蛋白在昆虫表达系统——Sf21细胞 (草地贪夜蛾Spodoptera frugiperda) 中进行表达,重组Fip-fve具有类似天然蛋白的生物学活性,但是产量依然较低,为6.25 mg/L (3.1 μg/1×106cells)[18]。毕赤酵母表达系统是近些年来兴起的一种外源蛋白表达系统,由于其兼有原核和真核表达系统的优点,在基因工程领域中得到日益广泛的应用,考虑金针菇免疫调节蛋白的特点和其他表达系统的不足,本研究以毕赤酵母为宿主,进行fip-fve基因诱导型和组成型两种重组表达,探究其在两种模式下的重组表达效率并检测重组Fip-fve的生物学活性。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与载体
大肠杆菌Excherichia coli TOP10感受态细胞和pGM-T载体购自北京天根生化有限公司;毕赤酵母Pichia pastoris GS115和表达载体pPIC9为本实验室保存;金针菇Flammulina velutipes子实体购自当地市场。
1.1.2 酶和试剂
限制性内切酶,DNA和蛋白质标准分子量为大连TaKaRa产品;Taq DNA聚合酶和T4 DNA连接酶为北京天根生化有限公司产品;Sephadex G-100为美国GE产品;人血红细胞由沈阳农业大学校医院志愿者提供;小鼠抗Fip-fve的多克隆抗体由天津天健生物制药有限公司制备;预染标准分子量蛋白质、PV膜、羊抗小鼠HRP-抗体和ECL荧光试剂盒为上海碧云天生物技术有限公司产品;酵母转化试剂盒为美国ZYMO产品。
1.1.3 培养基
LB培养基、YPD、BMM和MD培养基参考毕赤酵母表达手册[19]。毕赤酵母诱导型培养基改进为:YNB,6.7 g/L,酵母粉,0.1 g/L,蛋白胨,0.2 g/L。组成型培养基改进为:YNB,6.7 g/L,酵母粉,0.2 g/L,蛋白胨,0.4 g/L,葡萄糖/甘油,10%。
1.2 方法
1.2.1 基因克隆
按照程度等的方法提取金针菇及酵母的基因组DNA[20]。根据已知的金针菇免疫调节蛋白基因序列和酵母三磷酸甘油醛脱氢酶启动子序列分别设计fip-fve及pgap的扩增引物 (表1)。上述引物均由上海生工生物公司合成。fip-fve的PCR程序为:94 ℃ 3 min;94 ℃ 1 min,60 ℃1 min,72 ℃ 1 min,32个循环;72 ℃ 10 min。pgap的PCR程序为:94 ℃ 3 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃10 min。PCR产物进行琼脂条凝胶电泳,分别回收330 bp (fip-fve) 和 500 bp (pgap) 左右的片段,与pGM-T载体 (Amp+) 连接,转化大肠杆菌TOP10,经过蓝白斑筛选和菌落PCR检测,挑取阳性克隆送至上海生工生物公司测序。

表1 本研究所用相关引物Table 1 Primers used in this study
1.2.2 载体构建
提取含有fip-fve的pGM-T质粒DNA,与毕赤酵母表达载体pPIC9 (Amp+) 同时进行EcoRⅠ和NotⅠ双酶切,琼脂糖电泳,回收fip-fve和pPIC9片段,连接,转化,经Amp抗性筛选和菌落PCR检测得到阳性克隆,获得诱导型表达载体pPIC9-FIP-fve。提取含有PGAP的pGM-T质粒DNA,与诱导型表达载体pPIC9-FIP-fve (Amp+) 同时进行SacⅠ和BamHⅠ双酶切,琼脂糖电泳,回收pgap和pPIC9-FIP-fve片段,连接,转化,经Amp抗性筛选和菌落PCR检测得到阳性克隆,获得组成型表达载体pPIC9-PGAP-FIP-fve。
1.2.3 毕赤酵母转化与筛选
大量提取质粒pPIC9-FIP-fve和pPIC9-PGAP-FIP-fve (≥5 μg),用SacⅠ酶切,回收目的片段。酵母感受态制备和转化参考酵母转化试剂盒进行操作,将转化后的酵母菌液涂布于不含氨基酸的MD固体平板上,30 ℃培养2–3 d,直至长出酵母转化子。将不同酵母转化子重新接种至新MD平板,编号,以fip-fve引物进行酵母菌落PCR检测。
1.2.4 重组Fip-fve表达与检测
挑取PCR阳性的酵母菌落进行重组表达,转pPIC9-FIP-fve的进行诱导型重组表达,先将酵母接种YPD液体培养 (200 mL/500 mL 三角摇瓶,共10瓶),30 ℃、200 r/min培养16–18 h,离心收集菌体,再转入甲醇诱导液体培养基BMM (200 mL/500 mL 三角摇瓶,共2瓶) 中,继续培养5 d,每隔1天补加1%甲醇,同时取培养液离心收集上清。转pPIC9-PGAP-FIP-fve的酵母进行组成型表达,将PCR阳性的酵母菌分别接入含有葡萄糖和甘油的组成型液体培养基(200 mL/500 mL 三角摇瓶,各1瓶),30 ℃、200 r/min连续培养6 d,每隔1天取培养液离心收集上清。取10 μL上述培养液及野生型GS115培养液 (负对照) 上清与等体积二倍点样缓冲液混匀,沸水煮3 min,标准分子量蛋白质取5 μL,然后进行SDS-PAGE检测,其中浓缩胶为5%,分离胶为12%。取不同培养天数的10 μL诱导型重组表达的培养液上清进行Western blotting检测,其中一抗按1∶20 000稀释,二抗按1∶2 500稀释,ECL发光试剂盒中A、B液各取1 mL混匀,均有涂布于所转PV膜上,于暗室中进行X-光片曝光5–20 s。
1.2.5 重组Fip-fve血细胞凝集活性检测
取酵母发酵液,6 000 r/min离心5 min收集上清,加硫酸铵至95%饱和,12 000 r/min离心20 min,取蛋白质沉淀,重溶于PBS (pH 7.2,10 mmol/L),透析,超滤,上样于Sephadex G-100 (1.5 cm×60 cm)进行柱层析,得到初步纯化的重组Fip-fve。取健康人血细胞2 mL,2 000 r/min室温离心5 min。收集血红细胞,用10 mmol/L PBS (pH 7.2) 反复洗涤并离心3次,最终调整血细胞悬浮液为1.5% (V/V)。血细胞凝集反应液由25 μL血细胞悬浮液,25 μL重组Fip-fve (终浓度2 μg/mL) 蛋白液和50 μL明胶 (0.2%) 混合,加至96孔血凝板,同时以植物凝集素 (PHA,2 μg/mL) 和天然纯化的Fip-fve分别作为正对照,以PBS作负对照,置于37 ℃培养箱培养。于1.5 h和24 h后肉眼和显微镜下观察血细胞凝集结果[21]。
2 结果
2.1 表达载体的构建
从金针菇子实体基因组DNA中扩增fip-fve基因,连接至pGM-T载体,经测序验证正确后(结果未显示),再连接至pPIC9上构建出诱导型毕赤酵母表达载体pPIC9-FIP-fve,示意图见图1,并进行EcoRⅠ、BamHⅠ和KpnⅠ酶切电泳检测 (图2)。然后以pgap启动子替换原载体上的paox1构建组成型毕赤酵母表达载体pPIC9-PGAP-FIP-fve。
2.2 重组酵母转化子的获得与鉴定
将SacⅠ酶切后的线性表达载体pPIC9-FIP-fve和pPIC9-PGAP-FIP-fve转化至毕赤酵母GS115感受态细胞中,在不含氨基酸的MD培养基上进行筛选,获得的重组酵母转化子以fip-fve引物进行菌落PCR检测 (图3)。
2.3 重组Fip-fve的表达与检测
按着毕赤酵母表达手册方法[14],分别进行fip-fve的诱导型和组成型表达,培养基上清用于SDS-PAGE检测 (图4、5),与负对照相比,在14 kDa和17 kDa处明显有蛋白质条带。重组Fip-fve的表达量用凝胶扫描和分析系统(JYO4S-3C) 进行光密度吸收分析和目的重组
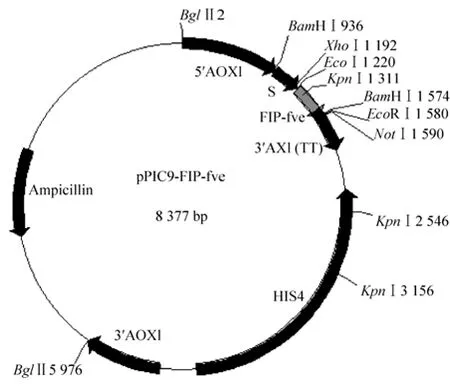
图1 诱导型毕赤酵母表达载体pPIC9-FIP-fve的示意图Fig. 1 Plasmid map of the inducible recombinant vector pPIC9-FIP-fve.
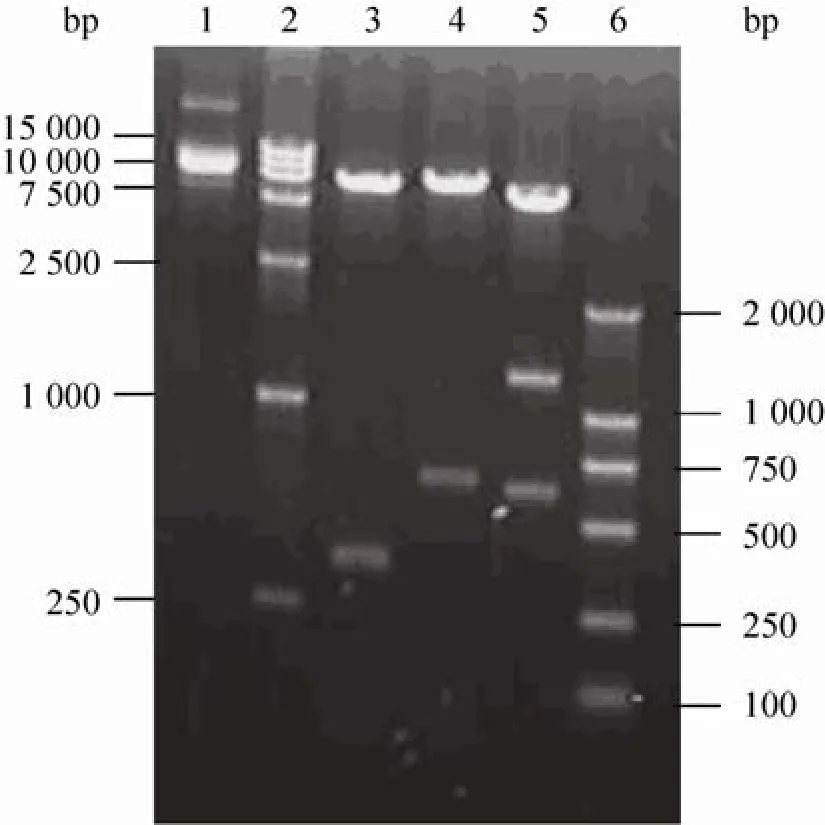
图2 诱导型毕赤酵母重组表达载体pPIC9-FIP-fve的酶切鉴定Fig. 2 Identification of the inducible recombinant vector pPIC9-FIP-fve by enzyme digestion. 1: recombinant vector pPIC9-FIP-fve; 2: the DNA marker DL15 000 (bp); 3: pPIC9-FIP-fve digested with EcoRⅠ; 4: pPIC9-FIP-fve digested with BamHⅠ; 5: pPIC9-FIP-fve digested with KpnⅠ; 6: DNA marker DL2 000 (bp).
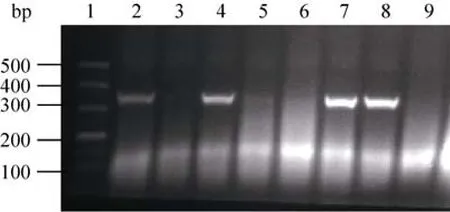
图3 菌落PCR电泳检测重组毕赤酵母转化子Fig. 3 Colony PCR and agarose electrophoresis of the recombinant P. pastoris transformants. 1: the DNA marker DL500 (bp); 2–9: different recombinant P. pastoris transformants.
Fip-fve含量的换算[22],在以甲醇为碳源的诱导型表达中第4天表达量最高,为158.2 mg/L,在以葡萄糖和甘油为碳源进行组成型表达分别在第4天和第5天达到最高,分别为46.3 mg/L和29.5 mg/L (结果未显示)。同时,以诱导型的重组Fip-fve进行Western blotting检测,结果如图6所示。
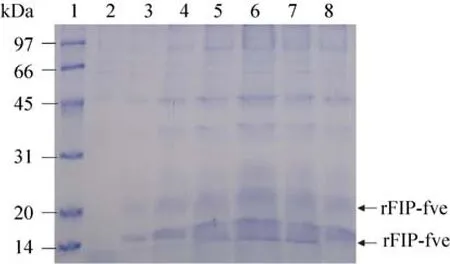
图4 以葡萄糖为碳源的组成型重组Fip-fve的SDS-PAGE检测Fig. 4 SDS-PAGE analysis of the constitutive rFip-fve using glucose. 1: the protein marker (kDa); 2: the sample of the wild-type P. pastoris GS115 as the negative control; 3–8: the samples of the constitutive culture at different day (1–6 d).
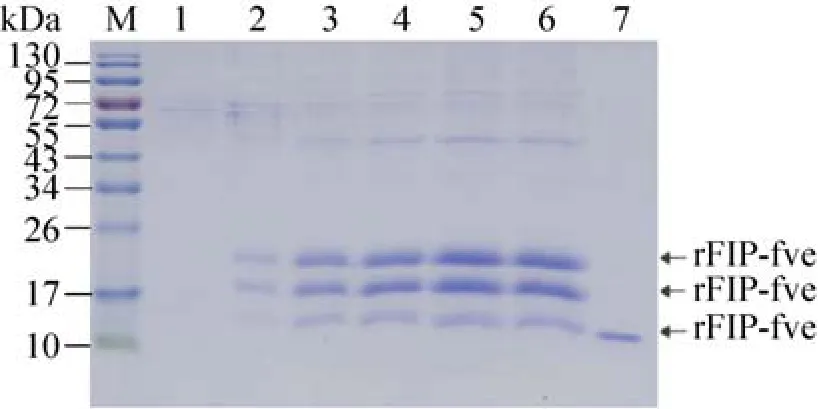
图5 以甲醇为碳源的诱导型重组Fip-fve的SDS-PAGE检测Fig. 5 SDS-PAGE analysis of the inducible rFip-fve using methanol. M: the protein marker (kDa); 1: the sample of the wild-type P. pastoris GS115 as the negative control; 2–6: the samples of the inducible culture at different day (1–5 d); 7: the native Fip-fve as the positive control.

图6 以甲醇为碳源的诱导型重组Fip-fve的Western blotting检测Fig. 6 Western blotting analysis of the inducible rFip-fve using methanol. M: the protein marker (kDa); 1: the sample of the wild-type P. pastoris GS115 as the negative control; 2–6: the samples of the inducible culture at different day (1–5 d); 7: the native Fip-fve as the positive control.
2.4 重组Fip-fve血细胞凝集活性的检测
重组Fip-fve经过硫酸铵沉淀和Sephadex-G-100凝胶柱层析纯化后,最后获得29 mg纯化重组Fip-fve,并进行人血细胞凝集试验初步检测其生物学活性。结果表明,重组Fip-fve在2 μg/mL就可以明显凝集人血细胞 (表2),说明重组Fip-fve具有良好的血细胞凝集活性。
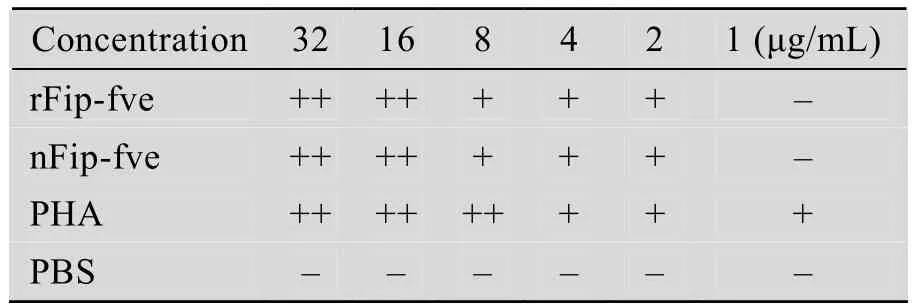
表2 重组Fip-fve血细胞凝集活性检测Table 2 Hemagglutination test of rFip-fve
3 讨论
从天然的金针菇子实体或者菌丝体中提取Fip-fve产量比较低,费时费力,同时也增大了成本。运用现代生物技术尤其是基因工程手段进行重组Fip-fve的生产将有效克服上述不足。Ko等曾在大肠杆菌中成功表达fip-fve,但是产量较低,只有5 mg/L,并且重组的Fip-fve仅具有天然蛋白生物学活性的一半[17]。Wu等又将fip-fve在昆虫细胞中进行表达,获得具有良好生物学活性的重组蛋白,但是产量依旧较低,仅有6.25 mg/L[18]。Zhang等将该基因引入组氨酸标签在大肠杆菌中也进行了融合表达与纯化,表达效率为22%[23]。而毕赤酵母具有原核细胞和核真核细胞的特点,成为功能蛋白质和药用蛋白质重组表达的理想宿主。
毕赤酵母表达有两种形式,一个是应用乙醇氧化酶启动子 (paox1) 的诱导型表达,该表达模式以甲醇为唯一碳源进行外源基因的诱导表达,其最大特点是表达量高,但是该模式需要更换碳源,同时在表达过程中需要使用甲醇具有一定的危害性和毒性。另外一种是应用三磷酸甘油醛脱氢酶 (pgap) 的组成型表达,该表达模式不需要更换碳源,可以是甘油、葡萄糖、油酸等,表达方式较简单、安全[19]。但是不同的目的蛋白用哪种表达方式效率更高还需要实际进行验证。吕等在毕赤酵母中同时进行了SAM合成酶 (SAMS)的重组表达,结果组成型SAMS表达量比诱导型高16.3%[24]。本文分别构建了诱导型和组成型表达载体,进行了fip-fve在毕赤酵母GS115中两种模式的表达,结果表明两种模式下均能有效重组表达,而诱导型表达产量 (158.2 mg/L) 是组成型表达产量 (46.3 mg/L) 的3.4倍。其原因可能是paox1的超强启动子功能,有报道称该启动子是目前已知的最强启动子[25],另外,诱导型表达过程中更换培养基,进行了酵母菌的富集。此外,在两种模式下表达的重组Fip-fve均有多条目的蛋白带的产生,可能是由于毕赤酵母进行了蛋白质翻译后的加工和修饰,尤其是糖基化修饰的缘故[26]。
经过初步纯化的重组Fip-fve表现出良好血细胞凝集活性,在2 μg/mL时就能明显凝集人血红细胞;这与天然Fip-fve一致,说明从毕赤酵母GS115获得的重组Fip-fve具有良好的血细胞凝集活性和初步的生物学活性,可以进行下一步的研究和开发。另外,我们还需要调整和优化表达体系和条件,以期获得更高产量的重组目的蛋白。
REFERENCES
[1] Ko JL, Hsu CI, Lin RH, et al. A new fungal immunomodulatory protein, FIP-fve isolated from the edible mushroom, Flammulina velutipes and its complete amino acid sequence. Eur J Biochem, 1995, 228: 244–249.
[2] Lin WH, Huang CH, Hsu CI, et al. Dimerization of the N-terminal amphipathic α-helix domain of the fungal immunomodulatory protein from Ganoderma tsugae (Fip-gts) defined by a yeast two-hybrid system and site-directed mutagenesis. J Biol Chem, 1997, 272: 20044–20048.
[3] Hsu HC, Hsu CI, Lin RH, et al. Fip-vvo, a new fungal immunomodulatory protein isolated from Volvariella volvacea. Biochem J, 1997, 332: 557–565.
[4] Li QZ, Wang XF, Chen YY, et al. Cytokines expression induced by Ganoderma sinense fungal immunomodulatory protein (FIP-gsi) in mouse spleen cells. Appl Biochem Biotechnol, 2010, 162: 1403–1413.
[5] Lin JW, Sun F, Zhang R, et al. Research on fungal immunomodulatory proteins. Chin J Immunol, 2005, 6: 477–450 (in Chinese).
林景卫, 孙非, 张韧, 等. 真菌免疫调节蛋白的研究进展. 中国免疫学杂志, 2005, 6: 477–450.
[6] Paaventhan P, Jeremiah SJ, See VS, et al. A 1.7 Å structure of Fve, a member of the new fungal immunomodulatory protein family. J Mol Biol, 2003, 332: 461–470.
[7] Seow SV, Kuo IC, Paaventhan P, et al. Crystallization and preliminary X-ray crystallographic studies on the fungal immunomodulatory protein Fve from the golden needle mushroom (Flammulina velutipes). ActaCrystallog Sect, 2003, 59(9): 1487–1489.
[8] Tong MH, Chien PJ, Chang HH, et al. High processing tolerances of immunomodulatory proteins Enoki and Reishi mushroom. J Agic Food Chem, 2008, 56(9): 3160–3166.
[9] Wang PH, Hsu CI, Tang YL, et al. Fungal immunomodulatory protein from Flammulina velutipes induces interferon-gamma production through p38 mitogen-activated protein kinase signaling pathway. J Agric Food Chem, 2004, 52: 2721–2725.
[10] Hsieh CW, Lan JL, Meng Q, et al. Eosinophil apoptosis induced by fungal immunomodulatory peptide-fve via reducing IL-5alpha receptor. J Formos Med Assoc, 2007, 106(1): 36–43.
[11] Hsieh KY, Hsu CI, Lin JY, et al. Oral administration of an edible-mushroom-derived protein inhibits the development of food-allergic reactions in mice. Clin Exp Allergy, 2003, 33: 1595–1602.
[12] Liu YH, Kao MC, Lai YL, et al. Efficacy of local nasal immunotherapy for Dp2-induced airway inflammation in mice: using Dp2 peptide and fungal immunomodulatory peptide. J Allergy Clin Immunol, 2003, 112: 301–310.
[13] Ding Y, Seow SV, Huang CH, et al. Coadministration of the fungal immunomodulatory protein FIP-fve and a tumour-assocated antigen enhanced antitumour immunity. Immunology, 2009, 128: 881–894.
[14] Chang HH, Hsieh KY, Yeh CH, et al. Oral administration of an enoki mushroom protein FVE activates innate and adaptive immunity and incuces anti-tumor activity against murine hepatocellular carcinoma. Int immunopharmacol, 2010, 10: 239–246.
[15] Chang HH, Sheu F. Anti-tumor mechanisms of orally administered a fungal immunomodulatory protein from Flammulina velutipes in mice. Nutr Immunol, 2006, 20: A1057.
[16] Liu YF, Chang SH, Sun HL, et al. IFN-r induction on carbohydrate binding module of fungal immunomodulatory protein in human peripheral mononuclear cells. J Agric Food Chem, 2012, 60: 4914–4922.
[17] Ko JL, Lin SJ, Hsu CI, et al. Molecular cloning and expression of a fungal immunomodulatory protein, FIP-fve, from Flammulina velutipes. J Formos Med Assoc, 1997, 96: 517–524.
[18] Wu CM, Wu TY, Kao SS, et al. Expression and purification of a recombinant Fip-fve from Flammulina velutipes in baculovirus-infected insect cells. J Appl Microbiol, 2008, 104: 1354–1362.
[19] Invitrogen. Pichia expression kit, a manual of methods for expression of recombinant proteins in Pichia pistoris. Version M, USA, 1997: 55–58.
[20] Cheng D, Huang XY, Li BJ. A method for preparation of high quality DNA from medical fungi and construction of a genomic library. Mycosystema, 2002, 21(1): 137–139 (in Chinese).
程度, 黄翔宇, 李保健. 药用真菌高质量总DNA的制备及基因组文库的构建. 菌物系统, 2002, 21(1): 137–139.
[21] Kino K, Yamashita A, Yamaoka K, et al. Isolation and characterization of a new immunomodulatory protein, Lingzhi-8 (LZ-8), from Ganoderma lucidum. J Biol Chem, 1989, 264: 472–478.
[22] Lin JW, Hao LX, Xu GX, et al. Molecular cloning and recombinant expression of a fuangl immunomodulatory protein from Ganoderma lucidum in Pichia pastoris. World J Microbiol Biotechnol, 2009, 25: 383–390.
[23] Zhang JC, Kong XH, Zhang PQ, et al. Clong and expression of FIP-fve in E. coli. J Jilin Agri Univ, 2007, 29(5): 495–498 (in Chinese).
张介驰, 孔祥辉, 张丕齐, 等. 金针菇免疫调节蛋白基因克隆及其表达. 吉林农业大学学报, 2009, 29(5): 495–498.
[24] Lü ZY, Qian JC, Chu J, et al. Combined use of AOX1 and GAP promoter to express SAM synthetase and enhance S-adenosylmethionie accumulation in Pichia pastoris. Ind Microbiol, 2008, 38(4): 24–30 (in Chinese).
吕中原, 钱江潮, 焗储, 等. 同时利用AOX1和GAP启动子表达SAM合成酶促进重组毕赤酵母中S-腺苷甲硫氨酸积累. 工业微生物, 2008, 38(4): 24–30.
[25] Clare JJ, Rayment FB, Ballantine SP, et al. High-level expression of tetanus toxin fragment C in Pichia pastoris strains containing multiple tandem integrations of the gene. Biotechnology, 1991, 9(5): 455–460.
[26] Bastiaan-Net S, Chanput W, Hertz A, et al. Biochemical and functional characterization of recombinant fungal immunomodulatory proteins (rFIPs). Int Immunopharmacol, 2013, 2013, 15(1): 167–175.
(本文责编 郝丽芳)
Inducible and constitutive expression of fip-fve from Flammulina velutipes in Pichia pastoris GS115
Jingwei Lin1,2, Jia Jia2, Ming Zhong2, Lijing Chen2, Haoge Li2, Zhifu Guo2, Mingfang Qi1, Lixia Liu3, and Tianlai Li1
1 College of Horticulture, Shenyang Agricultural University, Shenyang 110866, Liaoning, China
2 College of Biological Science and Technology, Shenyang Agricultural University, Shenyang 110866, Liaoning, China
3 School of Life Sciences, Northeast Normal University, Changchun 130024, Jilin, China
We transformed the fip-fve gene into Pichia pastoris GS115 for inducible and constitutive expression to obtain feasible bioactvie recombinant Fip-fve. The fip-fve gene was cloned from Flammulina velutipes fruting body by PCR and ligated to pPIC9 to construct inducible expression vector pPIC9-FIP-fve, and promotor pgap was used to replace the paox1 to construct constitutive expression vector pPIC9-PGAP-FIP-fve. These two vectors were used to transform P. pastoris by PEG method. The fip-fve was expressed after histamine-absence screening and yeast colony PCR. The inducible expression level reached 158.2 mg/L at the fourth day and the constitutive expression level was 46.3 mg/L and 29.5 mg/L using glucose and glycerol, respectively. The SDS-PAGE and Western blotting both proved the correctness of rFip-fve, and the hemagglutination test indicats the rFip-fve’s bioactivity.
Flammulina velutipes, immunomodulation, Pichia pastoris, constitutive expression
May 19, 2013; Accepted: August 20, 2013
Tianlai Li. Tel: +86-24-88487004; E-mail: tianlaili@126.com
林景卫, 贾佳, 钟鸣, 等. 金针菇免疫调节蛋白基因fip-fve在毕赤酵母GS115中诱导型和组成型表达. 生物工程学报, 2014, 30(3): 464−471.
Lin JW, Jia J, Zhong M, et al. Inducible and constitutive expression of fip-fve from Flammulina velutipes in Pichia pastoris GS115. Chin J Biotech, 2014, 30(3): 464−471.
Supported by: National Natural Science Foudation of China (No. 31000928).
国家自然科学基金 (No. 31000928) 资助。
时间:2013-9-13 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20130913.0912.002.html
