小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子及脂肪酸代谢的影响*
2014-06-15岳晶晶牛文彦
李 萍 岳晶晶 张 达 牛文彦 何 庆△
细胞与分子生物学
小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子及脂肪酸代谢的影响*
李 萍1岳晶晶2张 达3牛文彦3何 庆1△
目的 观察小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子及脂肪酸代谢的影响,探讨小檗碱改善胰岛素抵抗的分子机制。方法3T3-L1脂肪细胞经不同浓度小檗碱(0、5、10、20和40 μmol/L)处理24 h后,采用qRTPCR技术检测相关因子mRNA表达水平,包括白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、瘦素、脂联素和内脂素以及脂肪酸合酶(FAS)、乙酰辅酶A羧化酶(ACC)、脂肪组织甘油三酯水解酶(ATGL)、脂肪细胞型脂肪酸结合蛋白(AFABP)。同时用10 μmol/L小檗碱分别处理脂肪细胞0、4、8、24、48 h后,以相同方法测定上述指标mRNA表达水平。结果10~40 μmol/L小檗碱剂量组的脂肪细胞内IL-6、TNF-α、瘦素、FAS、ATGL、AFABP mRNA表达水平均低于0 μmol/L组,内脂素mRNA高于0 μmol/L组(P<0.05),各组间脂联素mRNA表达无明显差异(P>0.05)。8~48 h时间处理组细胞内IL-6、TNF-α、瘦素、AFABP、ATGL、FAS mRNA表达水平均低于0 h组,内脂素mRNA水平高于0 h组(P<0.05)。脂联素mRNA表达水平仅在48 h处理组降低(P<0.05)。各组间ACC mRNA表达无明显差异(P>0.05)。结论小檗碱能影响3T3-L1脂肪细胞炎症因子、脂肪因子和关键脂肪酶及蛋白mRNA的表达,且呈时间、剂量依赖效应,这可能是其改善胰岛素抵抗的重要分子机制。
小檗碱;胰岛素抵抗;白细胞介素-6;肿瘤坏死因子α;瘦素;脂联素;内脂素;乙酰CoA羧化酶;脂肪酸合酶;脂肪组织甘油三酯水解酶;脂肪细胞型脂肪酸结合蛋白;基因表达
近年来,2型糖尿病炎症学说备受关注,不少学者认为糖尿病是一种慢性低度炎症性疾病[1],其中脂肪组织可能扮演着重要角色。脂肪组织被认为是活跃的内分泌免疫器官,其能够通过影响脂肪因子及炎症因子的表达,导致胰岛素抵抗[2]。小檗碱作为传统中药黄连的主要成分,具有降糖、降脂及改善胰岛素敏感性等作用[3],尤其在脂肪组织中发挥的作用备受关注。本研究旨在观察小檗碱对脂肪细胞的脂肪因子、炎症因子及脂肪酸代谢关键蛋白转录水平的影响,探讨小檗碱改善胰岛素抵抗的分子机制。
1 材料与方法
1.1 材料和试剂 3T3-L1前脂肪细胞株由加拿大Amira Klip教授惠赠;小檗碱、1-甲基-3-异丁基-黄嘌呤(IBMX)、地塞米松、胰岛素、DEPC购自美国Sigma公司;胎牛血清(FBS)购自以色列Bioind公司;DMEM高糖培养基、胰酶购自北京天润善达生物科技有限责任公司;TRIzol购自美国Invitrogen生物科技公司;Hanks液购自天津圣东生物科技发展有限公司。高纯总RNA快速提取试剂盒(离心柱型)购自北京百泰克生物技术有限公司;荧光实时定量PCR试剂盒、cDNA第一链合成试剂盒、Premix ExTaq酶、Taq DNA聚合酶、DNA Marker DL2000、dNTP Mixture购自Takara宝生物工程(大连)有限公司;SYBR Green购自瑞士罗氏公司。
1.2 方法
1.2.1 3T3-L1前脂肪细胞株的培养与分化 将3T3-L1前脂肪细胞株用含10%FBS的高糖DMEM培养基在37℃、5%CO2条件下培养。待细胞长满培养瓶底壁时,将细胞接种于6孔培养板中,待细胞长满2 d后,加入含10%FBS的DMEM培养基及含0.5 mmol/L IBMX、0.25 μmol/L地塞米松、10 mg/L胰岛素的分化液,培养48 h,再以含10 mg/L胰岛素的培养液培养48 h,然后用含10%FBS的DMEM培养液继续培养,每隔2 d换液1次,诱导分化8~12 d后,待90%以上的3T3-L1细胞呈脂肪细胞表型再进行下一步处理。
1.2.2 分组及处理 将小檗碱溶于二甲基亚砜(DMSO)中,配成终浓度为0.04 mol/L的溶液。(1)按小檗碱剂量分组:0(对照组)、5、10、20和40 μmol/L的小檗碱剂量组,处理3T3-L1脂肪细胞24 h后,收集细胞备用,同时设立空白组(未加DMSO)。(2)按小檗碱作用时间分组:6孔板中分化成熟的3T3-L1脂肪细胞经10 μmol/L小檗碱分别处理0(对照组)、4、8、24、48 h后,收集细胞备用,同时设立空白组(未加DMSO)。
1.2.3 qRT-PCR检测脂肪细胞内相关因子表达水平 包括炎症因子[白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α]、脂肪因子(瘦素、内脂素、脂联素)及脂肪酸代谢相关酶或蛋白[脂肪酸合酶(FAS)、乙酰辅酶A羧化酶(ACC)、脂肪组织甘油三酯水解酶(ATGL)、脂肪细胞型脂肪酸结合蛋白(AFABP)]。使用TRIzol法分别提取上述各组脂肪细胞的总RNA,逆转录成cDNA,然后行qRT-PCR扩增,引物见表1。反应体系(25 μL):SYBR Green12.5 μL,Rnase-free水10 μL,上、下游引物各0.75 μL,cDNA工作液1 μL。95℃预变性10 min;95℃变性15 s,60℃退火/延伸30 s,循环45个周期,95℃变性15 s,60℃退火/延伸1 min,95℃变性15 s,60℃退火/延伸15 s。每次延伸步骤结束后,通过检测反应体系中SYBR Green与双链DNA结合后所发出的荧光强度,来定量检测PCR扩增产物的量。

Table 1 Gene primer sequences used for qRT-PCR表1 qRT-PCR引物序列
1.3 统计学方法 采用SPSS 17.0软件进行数据统计分析,定量指标采用±s描述平均水平,多组间比较采用单因素方差分析,组间两两比较采用最小显著差异法(LSD-t),以P<0.05为差异有统计学意义。
2 结果
2.1 不同剂量组小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子及脂肪酸代谢的影响 (1)炎症因子、脂肪因子。10~40 μmol/L小檗碱组的IL-6、TNF-α、瘦素mRNA表达水平均低于对照组,内脂素mRNA水平高于对照组(P<0.05)。对照组与空白组的IL-6、TNF-α、瘦素、脂联素、内脂素水平差异无统计学意义。各组间脂联素mRNA水平差异无统计学意义,见表2。(2)脂肪酸代谢。10~40 μmol/L小檗碱组的FAS、ATGL、AFABP mRNA表达水平均低于对照组(P<0.05),以20 μmol/L剂量组变化最明显,对照组与空白组的FAS、ATGL、AFABP mRNA表达水平差异无统计学意义,各组ACC mRNA水平差异无统计学意义,见表3。
Table 2 Effects of different concentrations of berberine on inflammatory factors and adipokines mRNA in 3T3-L1 adipocytes表2 不同剂量组小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子mRNA的影响 (n=3,±s)
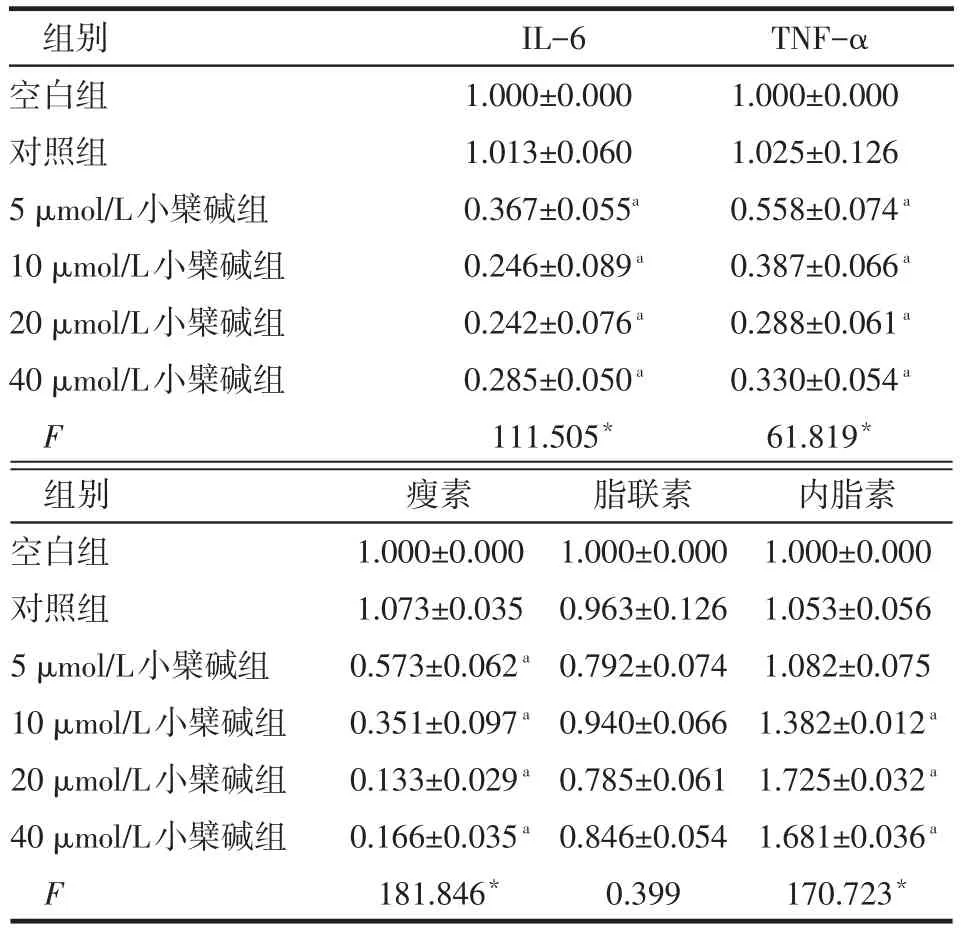
Table 2 Effects of different concentrations of berberine on inflammatory factors and adipokines mRNA in 3T3-L1 adipocytes表2 不同剂量组小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子mRNA的影响 (n=3,±s)
*P<0.05;a与对照组比较,P<0.05;表3~5同
组别空白组对照组5 μmol/L小檗碱组10 μmol/L小檗碱组20 μmol/L小檗碱组40 μmol/L小檗碱组F IL-6 1.000±0.000 1.013±0.060 0.367±0.055a0.246±0.089a0.242±0.076a0.285±0.050a111.505*TNF-α 1.000±0.000 1.025±0.126 0.558±0.074a0.387±0.066a0.288±0.061a0.330±0.054a61.819*组别空白组对照组5 μmol/L小檗碱组10 μmol/L小檗碱组20 μmol/L小檗碱组40 μmol/L小檗碱组F瘦素1.000±0.000 1.073±0.035 0.573±0.062a0.351±0.097a0.133±0.029a0.166±0.035a181.846*脂联素1.000±0.000 0.963±0.126 0.792±0.074 0.940±0.066 0.785±0.061 0.846±0.054 0.399内脂素1.000±0.000 1.053±0.056 1.082±0.075 1.382±0.012a1.725±0.032a1.681±0.036a170.723*
Table 3 Effects of different concentrations of berberine on fatty acid metabolism in 3T3-L1 adipocytes表3 不同剂量组小檗碱对3T3-L1脂肪细胞脂肪酸代谢的影响 (n=3,ˉ±s)
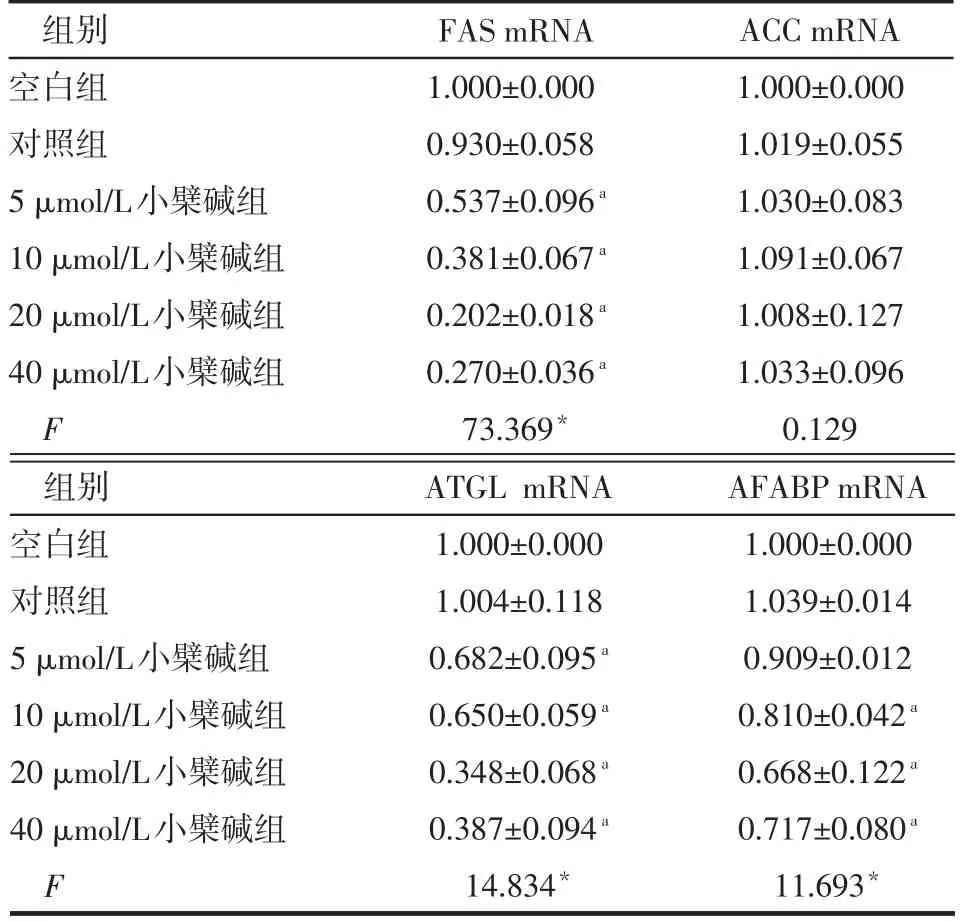
Table 3 Effects of different concentrations of berberine on fatty acid metabolism in 3T3-L1 adipocytes表3 不同剂量组小檗碱对3T3-L1脂肪细胞脂肪酸代谢的影响 (n=3,ˉ±s)
组别空白组对照组5 μmol/L小檗碱组10 μmol/L小檗碱组20 μmol/L小檗碱组40 μmol/L小檗碱组F FAS mRNA 1.000±0.000 0.930±0.058 0.537±0.096a0.381±0.067a0.202±0.018a0.270±0.036a73.369*ACC mRNA 1.000±0.000 1.019±0.055 1.030±0.083 1.091±0.067 1.008±0.127 1.033±0.096 0.129组别空白组对照组5 μmol/L小檗碱组10 μmol/L小檗碱组20 μmol/L小檗碱组40 μmol/L小檗碱组F ATGL mRNA 1.000±0.000 1.004±0.118 0.682±0.095a0.650±0.059a0.348±0.068a0.387±0.094a14.834*AFABP mRNA 1.000±0.000 1.039±0.014 0.909±0.012 0.810±0.042a0.668±0.122a0.717±0.080a11.693*
2.2 不同时点组小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子及脂肪酸代谢的影响 (1)炎症因子、脂肪因子。小檗碱处理4~48 h组的IL-6、TNF-α、瘦素mRNA表达水平均低于对照组,以48 h处理组降低最明显(P<0.05)。小檗碱处理8~48 h组的内脂素mRNA水平高于对照组,以24 h处理组升高最明显(P<0.05)。小檗碱处理48 h组的脂联素mRNA低于对照组(P<0.05)。对照组与空白组的各因子表达差异无统计学意义,见表4。(2)脂肪酸代谢。不同时点小檗碱组的AFABP mRNA表达水平较对照组均降低,FAS、ATGL mRNA水平分别在24 h、8 h开始降低(P<0.05),三者最大抑制效应均出现在48 h处理组。各组间ACC mRNA水平差异无统计学意义。对照组与空白组的各因子表达差异无统计学意义,见表5。
Table 4 Effects of different durations of berberine on inflammatory factors,adipokines mRNA in 3T3-L1 adipocytes表4 不同时点组小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子mRNA的影响 (n=3,ˉ±s)

Table 4 Effects of different durations of berberine on inflammatory factors,adipokines mRNA in 3T3-L1 adipocytes表4 不同时点组小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子mRNA的影响 (n=3,ˉ±s)
组别空白组对照组4 h小檗碱组8 h小檗碱组24 h小檗碱组48 h小檗碱组F IL-6 1.000±0.000 1.023±0.031 0.784±0.074a0.767±0.087a0.592±0.031a0.345±0.054a65.528*TNF-α 1.000±0.000 1.005±0.058 0.704±0.089a0.342±0.001a0.326±0.090a0.287±0.004a106.767*组别空白组对照组4 h小檗碱组8 h小檗碱组24 h小檗碱组48 h小檗碱组F瘦素1.000±0.000 1.010±0.051 0.821±0.021a0.797±0.057a0.624±0.071a0.476±0.096a39.065*脂联素1.000±0.000 0.991±0.077 0.968±0.132 0.930±0.113 0.897±0.156 0.658±0.087a4.323*内脂素1.000±0.000 1.084±0.105 0.978±0.071 1.560±0.036a1.660±0.151a1.451±0.071a23.451*
3 讨论
小檗碱传统上作为抗菌和止泻药物应用于临床。最近,有研究发现它还有降糖、降脂、抗炎、抗癌及改善抑郁症等作用[4]。药代动力学研究发现小檗碱可在脂肪组织中发挥降糖作用,但具体通过影响哪些因子发挥降糖作用,尚不明确[5]。
Table 5 Effects of different durations of berberine on fatty acid metabolism in 3T3-L1 adipocytes表5 不同时点组小檗碱对3T3-L1脂肪细胞脂肪酸代谢的影响 (n=3,ˉ±s)
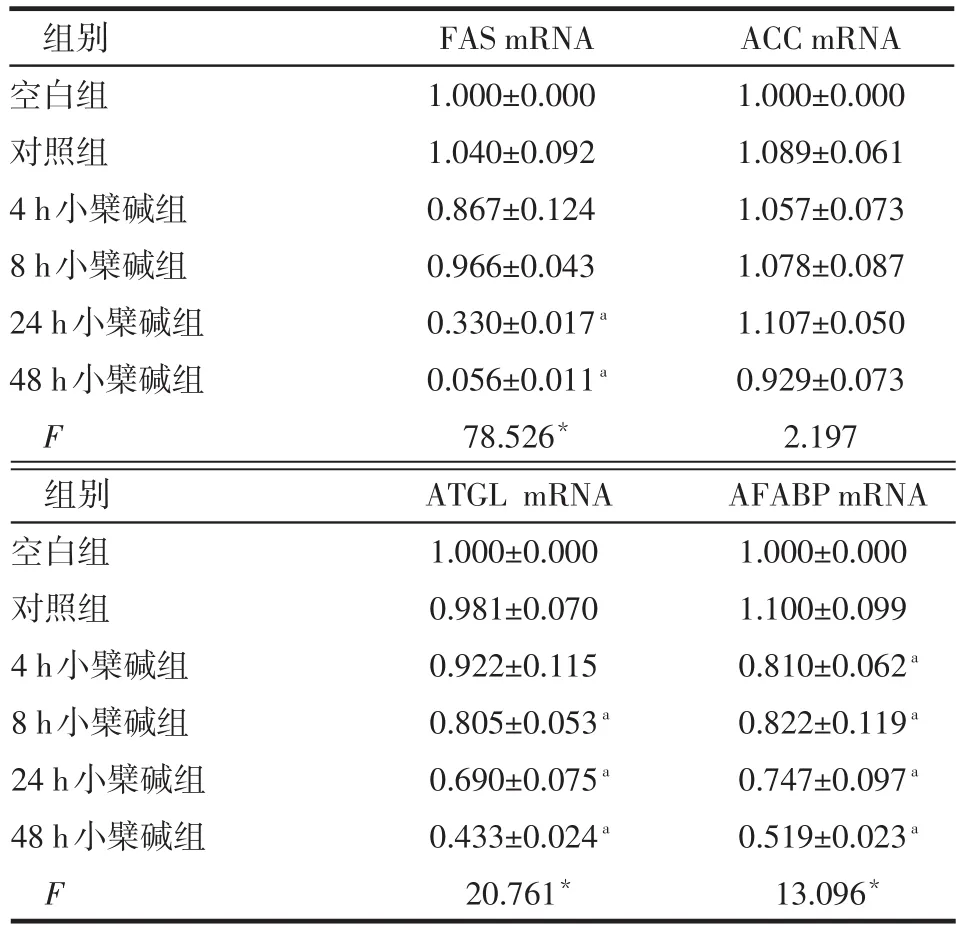
Table 5 Effects of different durations of berberine on fatty acid metabolism in 3T3-L1 adipocytes表5 不同时点组小檗碱对3T3-L1脂肪细胞脂肪酸代谢的影响 (n=3,ˉ±s)
组别空白组对照组4 h小檗碱组8 h小檗碱组24 h小檗碱组48 h小檗碱组F FAS mRNA 1.000±0.000 1.040±0.092 0.867±0.124 0.966±0.043 0.330±0.017a0.056±0.011a78.526*ACC mRNA 1.000±0.000 1.089±0.061 1.057±0.073 1.078±0.087 1.107±0.050 0.929±0.073 2.197组别空白组对照组4 h小檗碱组8 h小檗碱组24 h小檗碱组48 h小檗碱组F ATGL mRNA 1.000±0.000 0.981±0.070 0.922±0.115 0.805±0.053a0.690±0.075a0.433±0.024a20.761*AFABP mRNA 1.000±0.000 1.100±0.099 0.810±0.062a0.822±0.119a0.747±0.097a0.519±0.023a13.096*
近年来,慢性炎症与胰岛素抵抗的相关性已经逐渐得到学术界共识。炎症因子(IL-6、TNF-α)、脂肪因子(瘦素、内脂素、脂联素等)可能参与或加重肥胖、胰岛素抵抗的发生[6]。本研究以10 μmol/L小檗碱干预3T3-L1脂肪细胞,发现随着处理时间延长,IL-6、TNF-α、瘦素mRNA表达水平明显降低,内脂素mRNA表达水平明显升高,这与文献报道[5]基本一致。且当小檗碱作用时间为24 h时,以20 μmol/L剂量组效应最显著。提示小檗碱在转录水平能有效抗炎及调节脂肪因子的表达,并存在一定的剂量、时间效应关系。本研究发现10 μmol/L小檗碱在处理48 h后,脂肪细胞中的脂联素mRNA水平反而低于24 h,与谷卫等[7]的结果截然相反,可能与小檗碱抑制总脂联素的表达,而增加高分子质量脂联素的比例有关[8]。
游离脂肪酸升高是引起胰岛素抵抗的一个独立高危因素,与脂解增强、成脂减弱有关[9]。研究发现肥胖或胰岛素抵抗时,参与脂肪代谢的关键因子,如ACC[10]、FAS[11]、ATGL[12]、AFABP[13]等表达出现异常,这些指标可能成为2型糖尿病早期胰岛素抵抗的预测指标,甚至成为未来肥胖治疗的新靶点。本实验结果显示小檗碱能够显著抑制成熟3T3-L1脂肪细胞内FAS、AFABP、ATGL mRNA表达,且存在一定的量效、时效关系。另外,Bae等[14]还发现5 μmol/L小檗碱即能有效抑制分化过程中3T3-L1脂肪细胞多种成脂酶或蛋白的转录表达,其中在脂肪细胞分化第7天加入小檗碱,FAS mRNA表达几乎达到完全抑制。以上说明小檗碱对分化中、成熟的3T3-L1脂肪细胞成脂基因转录表达均有抑制作用。推论小檗碱在转录水平对脂肪细胞成脂的抑制效应显著,这可能是其最终阻碍脂肪形成,抑制脂肪细胞分化的机制之一。
[1]Hotamisligil,GS.Inflammation and metabolic disorders[J].Nature, 2006,444(7121):860-867.
[2]Odegaard JI,Chawla A.Pleiotropic actions of insulin resistance and inflammation in metabolic homeostasis[J].Science,2013,339 (6116):172-177.
[3]巢濠磊,王卫庆.小檗碱与糖脂代谢[J].国际内分泌代谢杂志, 2008,28(z1):23-25.
[4]Vuddanda PR,Chakraborty S,Singh S.Berberine:a potential phytochemical with multispectrum therapeutic activities[J].Expert Opin Investig Drugs,2010,19(10):1297-1307.
[5]Choi BH,Ahn IS,Kim YH,et al.Berberine reduces the expression of adipogenic enzymes and inflammatory molecules of 3T3-L1 adipocyte[J].Exp Mol Med,2006,38(6):599-605.
[6]曹竞文,何庆,张明,等.肿瘤坏死因子-α对脂肪细胞脂联素和炎症因子mRNA表达的影响[J].天津医药,2010,38(5):401-404.
[7]谷卫,曾文衡,胡海英.小檗碱对3T3-L1脂肪细胞脂联素表达的影响[J].中国中药杂志,2005,30(4):286-288.
[8]Li Y,Wang P,Zhuang Y,et al.Activation of AMPK by berberine promotes adiponectin multimerization in 3T3-L1 adipocytes[J]. Febs Letters,2011,585(12):1735-1740.
[9]Cusi K.The role of adipose tissue and lipotoxicity in the pathogenesis of type 2 diabetes[J].Curr Diab Rep,2010,10(4):306-315.
[10]Rosa G,Manco M,Vega N,et al.Decreased muscle acetyl-coenzyme carboxylase 2 mRNA and insulin resistance in formerly obese subjects[J].Obes Res,2003,11(11):1306-1312.
[11]Fernandez-Real JM,Menendez JA,Moreno-Navarrete JM,et al.Extracellular fatty acid synthase:a possible surrogate biomarker of insulin resistance[J].Diabetes,2010,59(6):1506-1511.
[12]Yao-Borengasser A,Varma V,Coker RH,et al.Adipose triglyceride lipase expression in human adipose tissue and musle.Role in insulin resistance andresponse to training and pioglitazone[J].Metabolism,2011,60(7):1012-1020.
[13]Tso AW,Xu A,Sham PC,et al.Serum adipocyte fatty acid binding protein as a new biomarker predicting the development of type 2 diabetes:a 10-year prospective study in a Chinese cohort[J].Diabetes Care,2007,30(10):2667-2672.
[14]Bae S,Yoon Y.Anti-adipogenic activity of berberine is not mediated by the WNT/β-catenin pathway[J].Phytother Res,2013,27(6): 937-943.
(2014-01-01收稿 2014-02-20修回)
(本文编辑 闫娟)
Effects of Berberine on Inflammatory Factors,Adipokines and Fatty Acid Metabolism in 3T3-L1 Adipocytes
LI Ping1,YUE Jingjing2,ZHANG Da3,NIU Wenyan3,HE Qing1
1 Department of Endocrinology,Tianjin Medical University General Hospital,,Tianjin 300052,China;2 Department of Internal Medicine 2,Wuhe County People’s Hospital,Anhui Province;3 Department of Immunology,Tianjin Medical University
Objective To observe the effects of berberine on inflammatory factors,adipokines and fatty acid metabolism in 3T3-L1 adipocytes,and to investigate the molecular mechanism underlying berberine’s role of improving insulin resistance.MethodsmRNA level of inflammatory molecules,adipokines,key enzymes and protein in fatty acid metabolism in 3T3-L1 cells were determined by quantitative real time polymerase chain reaction(qRT-PCR)after cells were treated with different concentrations of berberine(0,5,10,20,40 μmol/L)for 24 hours and with 10 μmol/L berberine at different durations(0,4,8,24,48 h).These factors mainly included interleukin-6(IL-6),tumor necrosis factor-α(TNF-α),leptin,adiponectin,visfatin,fatty acid synthase(FAS),acetyl-CoA carboxylase(ACC),adipose triglyceride lipase(ATGL)and adipocyte fatty acid binding protein(AFABP).ResultsIn 3T3-L1 adipocytes,transcription level of IL-6,TNF-α,leptin,FAS,ATGL,AFABP reduced with addition of berberine dosage at 10~40 μmol/L(P<0.05)while visfatin mRNA level increased(P<0.05)compared with the control group.No significant difference was found in expression of adiponectin(P>0.05).Transcription level of IL-6,TNF-α,leptin,AFABP,ATGL,FAS decreased with time after 10 μmol/L berberine intervention(8-48 h)compared with the control group(P<0.05).On the other hand,visfatin mRNA level increased(P<0.05)compared with the control group.Adiponectin mRNA decreased only after cells were treated with berberine for 48 h(P<0.05).No significant difference was found transcription of ACC between each groups treated with berberine(P>0.05).ConclusionmRNA level of inflammatory factors,adipokines,key enzymes and protein in fatty acid metabolism in 3T3-L1 adipocytes can be affected by berberine and this effect depend on its dose and time.This might be the mechanisms underlying berber-ine to improve insulin resistance.
berberine;insulin resistance;interleukin-6;tumor necrosis factor-alpha;leptin;adiponectin;visfatin; acetyl-CoA carboxylase;fatty acid synthase;adipose triglyceride lipase;adipocyte fatty acid binding protein;gene expression
R587.1
A
10.3969/j.issn.0253-9896.2014.06.001
*国家自然科学基金(项目编号:81170740);天津市科委科技支撑计划项目(项目编号:09ZCZDSF04500)
1天津医科大学总医院内分泌科(邮编300052);2安徽省五河县人民医院内2科;3天津医科大学免疫系
△通讯作者 E-mail:hech69@hotmail.com
