强力霉素对胃癌细胞增殖及Notch1、MMP-9表达的影响*
2014-06-15许敏李红
许 敏 李 红
强力霉素对胃癌细胞增殖及Notch1、MMP-9表达的影响*
许 敏 李 红△
目的 研究强力霉素对胃癌细胞BGC-823细胞的增殖及Notch1、基质金属蛋白酶-9(MMP-9)蛋白表达的影响,为胃癌的治疗提供新的抗肿瘤药物。方法分别以0、5、10、20、40 mg/L终浓度的强力霉素作用于人胃癌细胞系BGC-823,运用MTT法检测细胞增殖程度;流式细胞仪检测细胞周期分布的影响;Western Blot检测Notch1、MMP-9蛋白水平的表达。结果强力霉素能够抑制人胃癌细胞BGC-823细胞的增殖,且有剂量及时间依赖性(P<0.01);强力霉素能够改变胃癌细胞BGC-823周期的分布,随着浓度的增加,S期所占比例降低;并且随着浓度的增加,Notch1的表达增强,MMP-9的表达降低(P<0.01)。结论强力霉素能够抑制胃癌细胞BGC-823的增殖,促进Notch1上调为可能的机制之一。
胃肿瘤;细胞系,肿瘤;受体,Notch1;基质金属蛋白酶9;细胞增殖;细胞周期;强力霉素
胃癌是最常见的恶性肿瘤之一,其发病率和死亡率均较高,迫切需要寻找新的治疗方法。强力霉素是一种长效类四环素类抗生素,近年来发现强力霉素不但能够抑制细菌蛋白质的合成,还是基质金属蛋白酶(MMPs)的有效抑制剂,并且已经被应用于多种癌细胞的研究[1-2]。Notch信号通路作为一种进化保守的细胞间相互作用机制,在细胞的增殖和分化中起重要作用,与胃癌的发生发展有密切联系[3]。本研究观察强力霉素对人胃癌细胞系BGC-823细胞的增殖、细胞周期及Notch1、MMP-9表达的影响,初步探讨其可能的机制,为强力霉素治疗胃癌提供理论依据。
1 材料与方法
1.1 实验材料 人胃癌细胞株(BGC-823)由北京大学郁卫东老师馈赠。实验根据强力霉素浓度不同分为5组,分别为空白对照组,药物终浓度为5、10、20、40 mg/L组。
1.2 主要试剂 强力霉素(sigma公司),胎牛血清(杭州四季青生物工程材料有限公司),培养基(美国GiBico公司),青霉素、链霉素、胰蛋白酶(华美生物工程有限公司),Notch1抗体(ABCAM公司),MMP-9抗体(武汉博士德生物工程有限公司),二甲基亚砜(DMSO,Amresco公司),噻唑蓝(MTT,Amresco公司),PI染色液,70%乙醇,其余试剂均为国产分析纯。
1.3 方法
1.3.1 细胞培养 BGC-823细胞培养于含10%胎牛血清RPMI1640培养液中(100 U/mL青霉素、100 mg/L链霉素),在37℃、体积分数为5%CO2饱和湿度孵箱内进行传代培养。
1.3.2 药物对细胞增殖作用的测定 采用MTT法。将细胞浓度调整为每孔细胞数为4×104,每孔200 μL,接种于96孔板,37℃、5%CO2及饱和湿度条件下培养。过夜后,分别加入含有不同浓度强力霉素的培养液,终浓度分别为5、10、20、40 mg/L,对照组加入相同体积的培养液,每一浓度设6个复孔,分别继续培养24、48、72 h。实验结束前4 h,每孔加入MTT溶液(5 g/L)20 μL,继续培养4 h后,吸弃上清,每孔加入150 μL DMSO,振荡15 min,使结晶物充分溶解。在酶联免疫检测仪上,以波长570 nm测定各孔吸光度(A)值。强力霉素对细胞生长的抑制率(IR)=(1-实验组A570nm/对照组A570nm)× 100%。以时间为横轴,抑制率为纵轴绘制生长曲线,观察强力霉素对BGC-823细胞增殖的影响。
1.3.3 细胞周期分布检测 取对数生长期细胞,以不同浓度强力霉素作用于细胞,对照组加入相同体积的培养液,培养48 h后,收集各组细胞,离心后PBS洗2遍,每管加入70%乙醇1 mL,将细胞轻轻吹起。4℃固定12 h,离心、弃固定液,用PBS重悬细胞后转入流式管,再次离心、弃上清,将每管中加入PI染色液,室温避光染色15 min,流式细胞仪检测细胞周期。
1.3.4 Notch1和MMP-9蛋白表达测定 采用Western Blot法。以不同浓度强力霉素作用于细胞,对照组加入相同体积的培养液,培养48 h后,各组细胞中加入细胞裂解液RIPA,提取出细胞总蛋白,蛋白量根据Lowery法进行测定。以每个样品50 μg总蛋白的量准确点样,进行电泳,转膜。用含2%胎牛血清白蛋白(BSA)的Tris缓冲盐溶液(TBST)封闭2 h,加入一抗兔抗人Notch1 IgG(1∶1 000),兔抗人MMP-9 IgG(1∶100),4℃孵育过夜,用TBST洗膜3次,加入HRP标记的二抗羊抗兔IgG(1∶1 000),室温下水平摇动2 h,洗膜3次,用化学发光法(ECL)进行显色,曝光。以β-Actin抗体作为内参。
1.4 统计学方法 采用SPSS 13.0统计软件进行分析,计量资料用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析及重复测量资料的方差分析,组间多重比较采用SNK-q检验,相关性比较采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 强力霉素对细胞增殖能力的影响 在一定范围内,不同浓度、不同时间的强力霉素组处理后均对胃癌细胞的生长起抑制作用,差异有统计学意义(F分组=22.050,F时间=617.376,F交互=40.552,均P<0.001),且随着浓度的升高和作用时间的增强,其抑制作用加强,即强力霉素抑制胃癌细胞BGC-823呈时间、剂量依赖关系,见图1。
2.2 强力霉素对细胞周期的影响 强力霉素作用于胃癌细胞48 h后,5、10、20、40 mg/L组G0/G1期比例较对照组逐渐增加,而S期和G2/M期比例下降(P<0.05)。强力霉素可将BGC-823细胞阻滞于G0/ G1期,抑制细胞进入S期和G2/M期,见表1。
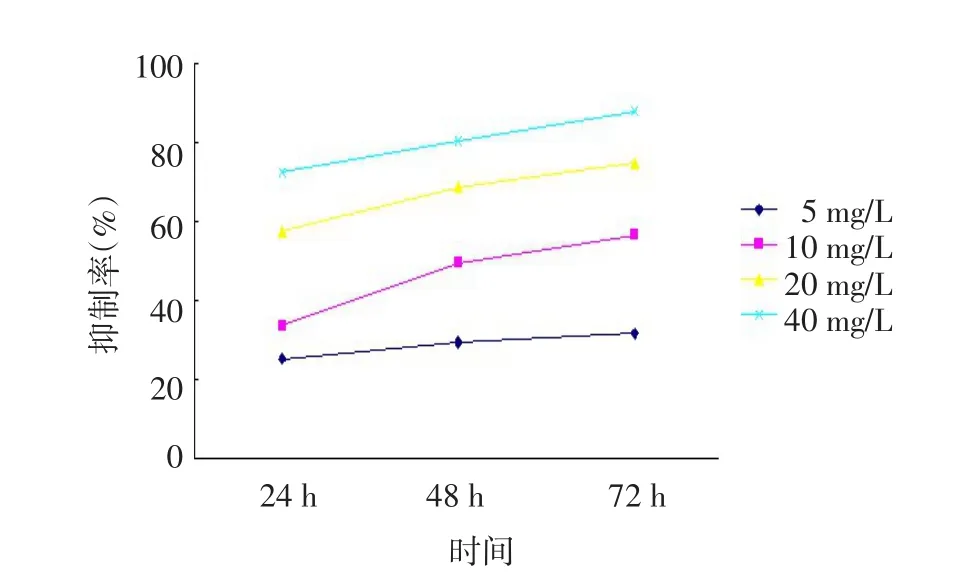
Figure 1 The inhibitory effect of doxycycline on BGC-823 cell line图1 强力霉素对BGC-823细胞的抑制效应
Table 2 Effect of different concentrations of doxycycline on cell cycle distribution表1 不同浓度强力霉素作用48 h后细胞周期分布检测结果 (n=6,%±s)

Table 2 Effect of different concentrations of doxycycline on cell cycle distribution表1 不同浓度强力霉素作用48 h后细胞周期分布检测结果 (n=6,%±s)
**P<0.01;a与(1)组比较,b与(2)组比较,c与(3)组比较,d与(4)组比较,P<0.05
组别对照组(1)强力霉素5 mg/L组(2)强力霉素10 mg/L组(3)强力霉素20 mg/L组(4)强力霉素40 mg/L组(5)F G0/G1期38.23±0.33 47.85±0.58a56.51±0.46ab62.25±0.57abc67.06±0.62abcd892.530**S期31.56±0.41 24.83±0.62a18.46±0.48ab15.72±0.37abc12.37±0.56abcd949.002**G2/M期30.21±0.61 27.32±0.57 25.03±0.66a22.03±0.61ab20.57±0.72abc139.190**
2.3 Notch1和MMP-9蛋白表达 不同浓度强力霉素作用胃癌细胞48 h后,在一定范围内随着强力霉素浓度增加,Notch1的表达增强,MMP-9的表达降低,见表2、图2。Notch-1与MMP-9表达呈负相关(r=-0.994,P<0.05)。
Table 2 The Expression of Notch1 and MMP-9表2Notch1和MMP-9蛋白表达结果(n=6±s)
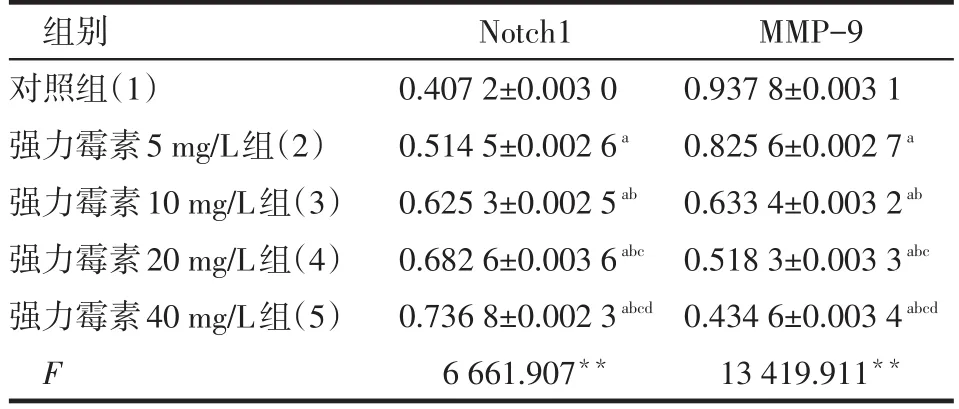
Table 2 The Expression of Notch1 and MMP-9表2Notch1和MMP-9蛋白表达结果(n=6±s)
**P<0.01;a与(1)组比较,b与(2)组比较,c与(3)组比较,d与(4)组比较,P<0.01
组别对照组(1)强力霉素5 mg/L组(2)强力霉素10 mg/L组(3)强力霉素20 mg/L组(4)强力霉素40 mg/L组(5)F Notch1 0.407 2±0.003 0 0.514 5±0.002 6a0.625 3±0.002 5ab0.682 6±0.003 6abc0.736 8±0.002 3abcd6 661.907**MMP-9 0.937 8±0.003 1 0.825 6±0.002 7a0.633 4±0.003 2ab0.518 3±0.003 3abc0.434 6±0.003 4abcd13 419.911**
3 讨论
3.1 强力霉素的作用机制 近年来,强力霉素的非抗菌作用得到了较多研究,已应用于肿瘤[1-2]、骨关节炎[4]和动脉粥样硬化治疗[5]等多方面。强力霉素是MMPs的有效抑制剂。MMPs是一种锌离子依赖性内肽酶,其中,MMP-9是MMPs中分子质量最大的酶,可降解基底膜,为血管内皮细胞的迁移和新生血管的延伸创造了必要条件,进而导致肿瘤的生长和扩散[6]。目前,强力霉素抑制MMPs的机制并不是十分清楚,有研究认为可能与强力霉素的Ca2+、Zn2+结合能力有关,其通过形成螯合物消除了MMPs的催化活化位点,从而抑制MMPs[7]。
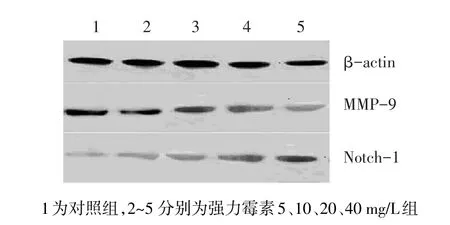
Figure 2 Effect of different concentrations of doxycycline on Notch1 and MMP-9 expression图2 不同浓度强力霉素对Notch1和MMP-9表达的影响
3.2 Notch1信号通路的可能作用机制 Notch信号通路的错误调节可引起人体较大范围的障碍,包括发育综合征、癌症[8]等。该信号通路有4种受体(Notch1~4)和5种配体(Jagged1、Jagged2、Deltalike1、Delta-like3、Delta-like4),其中Notch1与Jagged1为最重要的受体和配体。Notch1的胞外域与Jagged1结合后可促进Notch1胞内活性域NICD释放,NICD进入核内后诱导靶基因的转录。赵娜等[9]研究发现,Notch1低表达可能诱导核因子(NF)-κB高表达,进而导致胃癌的发生。并且通过对MMPs基因结构分析发现,在MMPs基因启动子近端调控区有特异性的NF-κB结合位点,去除NF-κB结合位点后可使MMPs表达降低[10]。
3.3 强力霉素通过Notch信号通路抑制胃癌细胞增殖可能性机制 本实验发现强力霉素对胃癌细胞的生长具有明显的抑制作用,并且具有时间、浓度依赖性,这与谢兆兰等[11]的报道一致;不同浓度强力霉素作用胃癌细胞48 h后,随着浓度的增加,强力霉素可以上调Notch1蛋白的表达,抑制MMPs的表达,因此推测强力霉素可能通过促进Notch信号通路来抑制NF-κB的表达,从而进一步抑制MMPs的表达来发挥抗癌作用。
本研究似可为胃癌治疗提供新的可能方法,然而将四环素类MMPs抑制剂应用于胃癌的临床治疗仍旧有很长的路需要探索。
[1]Wang H,Xu Y,Fang Z,et al.Doxycycline regulated induction of AKT in murine prostate drives proliferation independently of p27 cyclin dependent kinase inhibitor downregulation[J].PLoS One, 2012,7(7):413-430.doi:10.1371/journal.pone.0041330.
[2]Ferreri AJ,Govi S,Pasini E,et al.Chlamydophila psittaci eradication with doxycycline as first-line targeted therapy for ocular adnexae lymphoma:final results of an international phase II trial[J].J clin Oncol,2012,30(24):2988-2994.doi:10.1200/JCO.2011.41.4466.
[3]默娟,李红.Notch1信号通路对胃癌细胞增殖的影响[J].山东医药,2012,52(7):15-17.doi:10.3969/j.issn.1002-266X.2012.07.006.
[4]Gibson MB,Hashimoto K,Roach HI,et al.Progression of cartilage degradation in osteoarthritis may involve autocrine induction of IL-1 beta and loss of DNA methylation[J].J Bone Joint Surg Br Proceedings,2009,5(91):292.
[5]Jawien J,Toton-Zuranska J,Kus K,et al.The effect of AVE 0991, nebivolol and doxycycline on inflammatory mediators in an apoE-knockout mouse model of atherosclerosi[J].Med Sci Monit,2012,18(10):BR389-BR393.doi:10.12659/MSM.883478.
[6]Cho YB,Lee WY,Song SY,et al.Matrix metallopmteinase-9 activity is associated with poor prognosis in T3-T4 node-negative colorectal cancer[J].Hum Pathol,2007,38(11):1603-1610.doi:10.1016/j. humpath.2007.03.018.
[7]王丽娅,徐明娟,吴薇,等.多西环素抗肿瘤作用机制的研究进展[J].医学研究杂志,2012(8):14-16.doi:10.3969/j.issn.1673-548X.2012.08.006.
[8] Kopan R,Llagan MX.The canonical Notch signaling pathway:unfolding the activation mechanism[J].Cell,2009,137(2):216-233. doi:10.1016/j.cell.2009.03.045.
[9] 赵娜,周梅恺,叶玉伟,等.胃癌组织中Notchl、Jaggedl及NF-κB的表达及临床意义[J].南京医科大学学报(自然科学版),2012,32(8):1061-1065.
[10]Parodi FE,Mao D,Ennis T,et al.Suppression of experimental abdominal aortic aneurysms in mice by treatment with pyrrolidine dithiocarbamate,an antioxidant inhibitor of nuclear factor-kappaB[J].J Vasc Surg,2005,41(3):479-489.doi:10.1016/j.jvs.2004.12.030.
[11]谢兆兰,朱尤庆,林小玲,等.强力霉素对胃癌细胞SGC-7901基质金属蛋白酶-2和基质金属蛋白组织抑制因子-2表达的影响[J].胃肠病学,2006,11(4):202-206.doi:10.3969/j.issn.1008-7125. 2006.04.004.
(2013-11-08收稿 2014-02-14修回)
(本文编辑 李鹏)
Effect of Doxycycline on Gastric Cancer Cell Proliferation and Notch1,MMP-9 Expression
XU Min,LI Hong
Department of Biochemistry,Liaoning Medical College,Jinzhou,Liaoning 121000,China
ObjectiveTo investigate the effect of Doxycycline on gastric cancer cell line BGC-823 proliferation and Notch1,Matrix metalloproteinase-9(MMP-9)expression in order to shine a light on new anticancer drugs.MethodsFinal concentration of 0,5,10,20,40 mg/L doxycycline were added into human gastric cancer cell line BGC-823.Cell proliferation was detected by MTT;Cell cycle distribution was assessed by flow cytometry;Notch1,MMP-9 protein expression was revealed by Immunoblot.ResultsDoxycycline can inhibit proliferation of human gastric cancer cells line BGC-823, and its effect is dose and time-dependent(P<0.01).Doxycycline alters distribution of gastric cancer cell line BGC-823. With increasing drug concentration,the proportion of cells in S phase dropped(P<0.01).Notch1 expression rose and MMP-9 expression decreased(P<0.01).ConclusionDoxycyclinecan inhibited gastric cancer cell line BGC-823 proliferation and up-regulating Notch1 might be one mechanisms.
stomach neoplasms;cell line,tumor;receptor,Notch1;matrix metalloproteinase 9;cell proliferation;cell cycle;DOXYCYCLINE
R735.2
A
10.3969/j.issn.0253-9896.2014.06.006
*辽宁省自然科学基金资助项目(项目编号:201102125)
辽宁锦州,辽宁医学院生物化学教研室(邮编121001)
△通讯作者 E-mail:jzmu-lihong@sina.com
