ox-LDL对破骨细胞增殖及分化的影响*
2014-06-13亓文波
陈 雪 许 娟 亓文波
(1.泰山医学院,山东 泰安 271016; 2.泰山医学院附属泰山医院,山东 泰安 271000)
研究发现存在动脉粥样硬化病变的人群易致骨量的丢失,同时,骨质疏松人群较非骨质疏松人群更易发生动脉粥样硬化病变,提示骨质疏松和动脉粥样硬化之间可能存在着共同危险因素。
临床研究显示,氧化性低密度脂蛋白(ox-LDL)在整个动脉粥样硬化(AS)形成和发展过程中起了重要作用[2]。ox-LDL是血浆中LDL经动脉壁细胞氧化后产生多种活性醛类,再与LDL 载脂蛋白(apoB)中赖氨酸残基结合形成的产物[3],可被巨噬细胞的清道夫受体识别而快速摄取,促进巨噬细胞形成泡沫细胞,从而促进动脉粥样硬化的发生。而骨代谢的过程是依靠骨再建完成的。骨再建主要受破骨细胞(osteoclast cell, OC)的骨吸收与成骨细胞(osteoblast, OB)的骨形成之间相互作用、相互制约[5]。破骨细胞是目前发现的体内唯一专职骨吸收的细胞[6]。破骨细胞的活性改变是导致各种代谢性骨病的主要原因。目前少有研究观察ox-LDL对破骨细胞的影响。本实验就ox-LDL与破骨细胞增殖、分化的关系进行研究。
1 材料和方法
1.1材料 小鼠破骨前体细胞RAW264.7(凯基);抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(Sigma公司);胎牛血清(杭州四季青公司);小鼠重组细胞核因子kB 体活化因子配基(Sigma公司)。
1.2方法
1.2.1透析膜的处理 将剪下的30 cm的透析膜于过量的10 mmol/L的NaHCO3中浸泡并煮沸约5分钟,在10 mmol/L的乙二胺四乙酸(EDTA)中煮沸4分钟。用三蒸水冲洗数次。置于20%~50%乙醇溶液中,4℃的冰箱保存备用。
1.2.2LDL的制备及氧化 通过密度梯度离心法从正常人的血清中制得LDL提取液,并储存在含有0.01%乙二胺四乙酸(EDTA)的磷酸盐缓冲液中。氧化之前经过透析除去EDTA。调整蛋白浓度为50 mg/L。 通过人类低密度脂蛋白的铜氧化制得氧化性低密度脂蛋白,最后放入含EDTA 的PBS 中4℃透析24小时以终止氧化还原反应。通过测定TBA(硫代巴比妥酸)反应物质的含量(MDA药盒)鉴定其氧化修饰程度,将制备好的ox-LDL以0.22 μm滤膜过滤除菌,4℃保存备用。将上述最终反应物用RPMI-1640培养基定容,配置成25、50、100、150及200 mg/L ox-LDL溶液备用。
1.2.3Raw264.7细胞株的培养和诱导分化 将Raw264.7细胞株复苏后,用RPMI-1640培养基进行培养,每隔2~3天更换培养基一次(视细胞生长状况),换液之前观察细胞的形态、贴壁及生长情况,6天左右细胞贴满瓶底,用含EDTA的胰酶消化细胞,进行传代、冻存等。
将购买的RANKL溶于蒸馏水中,配置成100 ng/ml的存储液(含载体蛋白),混匀,分装,零下80℃保存。将RANKL 100 ng/ml加入RPMI-1640培养基(含10%FBS、青霉素100 U/ml、链霉素100 μg/ml),分装培养基,-20℃保存备用。待细胞培养至所需细胞数量后,更换含RANKL的培养基进行培养,诱导8天左右,分别进行观察和鉴定。
1.2.4Raw264.7细胞株培养后破骨细胞鉴定 (1)直接用倒置相差显微镜观察活细胞的形态和数量的变化;(2)参照TRAP染色试剂盒说明书对诱导前后细胞形态进行观察,光镜下计算TRAP阳性破骨细胞总数,细胞数大于等于3个为TRAP(+),染色阳性细胞为破骨细胞。
1.2.5细胞增殖能力测定 采用MTT法,将体外培养的破骨细胞用PBS冲洗2~3次,经胰蛋白酶消化、离心、弃上清,用含RANKL的RPMI-1640培养基配成细胞悬液,将96孔培养板每孔加入100 μl细胞悬液,对照组及实验组分别加入PBS(内含DMSO,使终浓度与实验组相同)和不同浓度的ox-LDL,总体积为200 μl,每一浓度重复5孔,置37℃,5%CO2培养箱中孵育24小时后,每孔弃上清液100 μl,加入5 mg/ml MTT液20 μl,震荡混匀,置37℃,5%CO2培养箱中孵育6小时后,加入100 μl二甲基亚砜(DMSO)终止反应,摇数分钟至混匀,置酶标仪波长490 nm下测定吸光度A值,并计算细胞相对抑制率。
1.3统计学处理 获得的结果均采用均数±标准差表示,统计软件用SPSS17.0,多组间用单因素方差分析,两组间比较用非配对t检验。
2 结 果
2.1LDL的氧化修饰度 LDL氧化结束后,在波长=532 nm处测得标准品、空白对照品和样品的吸收值分别为0.1352,0.0027及0.0228,蛋白浓度为50 mg/L,按照公式得出丙二醛的含量为27.73 μmol/g。
2.2破骨细胞诱导前后形态学观察 倒置相差显微镜观察Raw264.7细胞的一般特点,细胞形态呈圆形、椭圆形、梭形、星形或不规则形,圆形为主。细胞核1~2个,单个核多见。具有很强的贴壁性,胰酶-EDTA难以消化,常聚集生长。随诱导时间延长细胞体积逐渐增大,细胞形态以不规则形多见,圆形少见,细胞核为多个。诱导前TRAP染色后,细胞着色不明显。诱导后细胞胞浆呈玫瑰红色,细胞核为蓝紫色,多核细胞多见(如图1)。
2.3ox-LDL对破骨细胞增殖及分化的影响 MTT结果显示:不同浓度的ox-LDL 对破骨细胞的增殖及分化的影响有差别:ox-LDL浓度分别为100 mg/L,150 mg/L,200 mg/L时,破骨细胞抑制率为0.65±0.732,0.48±0.068,0.31±0.039,都较对照组破骨细胞的1.28±0.147低(P<0.05)。而ox-LDL浓度为25 mg/L及50 mg/L时,破骨细胞抑制率为1.134±0.120,1.189士0.112(P>0.05),见图2。
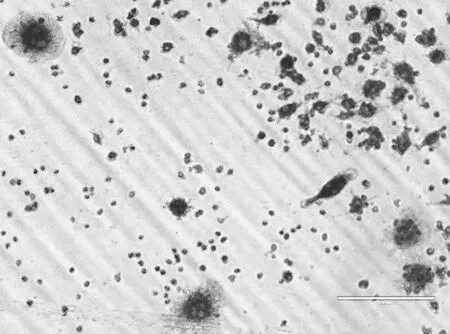
图1 破骨细胞诱导后形态学观察(×200倍)
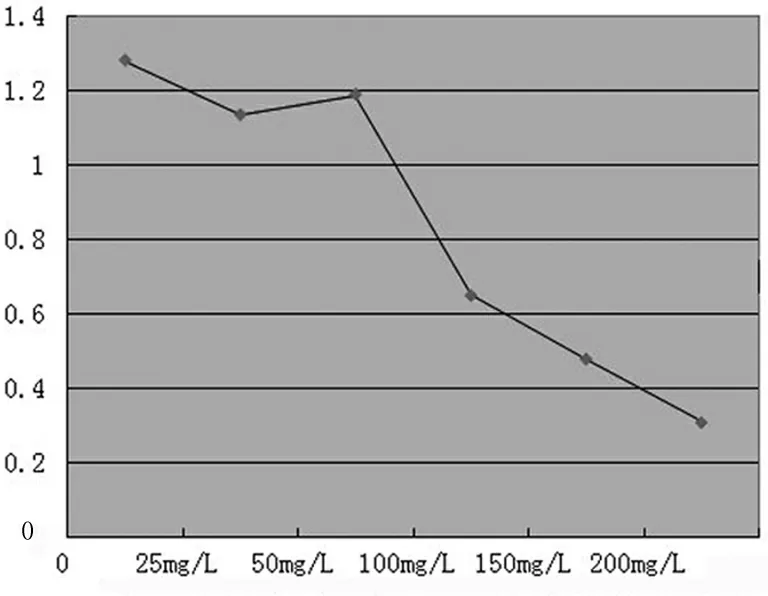
图2 ox-LDL作用24小时后对破骨细胞抑制率影响
3 讨 论
近年来研究表明,动脉粥样硬化与骨质疏松症的发病率越来越高,且常相伴随发生[7]。由此推测两种疾病之间可能有相同的致病因素存在。ox-LDL在动脉粥样硬化发生发展过程中起重要的作用。其作用机制包括:1)ox-LDL通过其细胞毒性作用引起血管内皮细胞功能障碍和内皮细胞损伤;2)ox-LDL通过直接吸引和激活内皮细胞等作用聚集单核细胞并诱导成为泡沫细胞;3)ox-LDL作为机体重要的抗原,刺激产生抗体,两者结合后形成抗原抗体复合物,促进动脉粥样硬化的形成;4)ox-LDL能抑制内皮细胞合成和释放NO,加速动脉粥样硬化的形成[8]。该实验通过肝素在pH 5.11 的状态下, 血浆中LDL 可与纤维蛋白原发生特异性的、且是最大程度的结合反应, 使LDL 沉淀下来, 而对血浆中其他蛋白无影响,并通过CuSO4氧化法成功制备ox-LDL。
骨质疏松的主要表现为低骨量和骨组织微结构退变,其发生的本质在于骨重建过程紊乱即破骨细胞介导的骨吸收大于成骨细胞介导[9]。破骨细胞在骨重建过程中起着启动和先锋作用。到目前为止,还没有成熟的破骨细胞株。RAW264.7细胞可认为是晚期分化阶段的破骨前身细胞[10]。该实验通过RANKL诱导RAW264.7细胞分化为成熟的有功能的破骨细胞同很多研究证实的一样。
该研究发现,不同浓度的ox-LDL作用于破骨细胞产生的增殖及分化作用是不同的。相同的作用时间下,低浓度的ox-LDL对破骨细胞的增殖及分化无明显变化,在一定范围内随着ox-LDL浓度的增加,可以促进破骨细胞的增殖及分化。因此推测,ox-LDL在骨质疏松症的发生发展中起一定的作用。该实验还有很多不足之处,比如没有深入探讨具体的细胞之间的作用机制,不同的作用时间下ox-LDL对破骨细胞产生的增殖及分化的影响及是否具有时间依赖性等。还有待于进一步研究以便为骨质疏松症的临床治疗提供理论依据。
[1] 陈玉群,魏富春,刘丹妍. 骨质疏松与代谢紊乱的相关性分析[J]. 检验医学与临床,2011,20(5):521-523.
[2] 吴永港. P38信号通路在氧化性低密度脂蛋白导致内皮祖细胞数量及功能改变方面的作用[D].中南大学,2009.
[3] 贺全国,蒋佩,严鹏科,等. 胆固醇流出对氧化性低密度脂蛋白诱导的巨噬细胞源性泡沫细胞凋亡的影响[J]. 中国现代医学杂志,2007,37(22):2724-2727.
[4] 蔡恒玲,刘应辉,刘娜娜. 西红花酸对动脉粥样硬化大鼠血脂及LOX-1表达的影响[J]. 中国现代医药杂志,2011,10(1):3-5.
[5] 顾建红,刘俊栋,翟必华,等. 钙磷对体外培养SD大鼠破骨细胞生成和活化的影响[J]. 中国兽医科学,2007,24(2):171-175.
[6] 李斌. 骨质疏松与动脉粥样硬化关系研究新进展[J]. 中国热带医学,2011,18(6):772-774.
[7] 陈月宁,区树阳,区洁新. 动脉粥样硬化相关危险因素临床分析[J]. 中国医药指南,2011,29(2):105-106.
[8] 顾建红,刘俊栋,刘学忠,等. 破骨细胞的形成和活化[J]. 江苏农业学报,2008,34(1):85-88.
[9] Lacey DL, Boyle WJ, Simonet WS, sey, et al. Bench to bedside: elucidation of the OPG-RANK-RANKL pathway and the development of denosumab[J]. Nat Rev Drug Discov,2012, 11:401-419.
[10] 肖新华,廖二元,董源媛,等. 小鼠单核细胞RAW264.7的细胞生物学特征[J]. 南华大学学报:医学版,2008,37(3):282-285.
