酶育牛黄的小鼠急性毒性实验研究*
2014-06-12邵明珠魏寅翼刘化侠
邵明珠 魏寅翼 刘化侠
(1.泰山医学院护理学院,山东 泰安 271016;2.山东大学齐鲁医院,山东 济南 250012)
天然牛黄由于资源奇缺,价格昂贵,而临床需求量大,开发牛黄代用品成为一种趋势。泰山医学院自行研制的酶育牛黄(calculus bovis cultivated by glucuronidase,CBCG)[1,2]。实验研究证明,CBCG生产工艺稳定,其胆红素含量,指纹图谱和胆酸类成分与天然牛黄类似[3-5]。动物实验证明,CBCG具有镇静、抗炎以及抗肿瘤作用[6,7]。但是其安全性有待研究。本实验通过灌胃给药的方法,观察酶育牛黄的安全性,为进一步实验提供参考依据。
1 材料与方法
1.1实验动物 昆明种小鼠36只,雌雄各半,体重20±2 g,清洁级,由泰山医学院实验动物中心提供。动物合格证号:scxk(鲁)2005 0015。饲养环境温度20~24 ℃,湿度45%~60%,自由摄食和饮水。实验前适应性饲养1周。小鼠标准颗粒饲料喂养,由泰山医学院实验动物中心提供。
1.2实验用药 CBCG,泰山医学院提供。CBCG淀粉混悬液的制备:将适量CBCG加入1%淀粉液中搅拌均匀制备不同浓度的CBCG淀粉混悬液。
1.3实验方法
1.3.1预实验 选取昆明种小鼠16只,雌雄各半,体重20±2 g。随机分为两组,每组8只。给药前禁食不禁水12 h。给予CBCG淀粉混悬液2 g/kg,0.2 ml/10g或是5 g/kg,0.4 ml/10 g,24 h内灌胃3次。常规饲养,灌胃后密切观察小鼠4 h,之后改为每天上午、下午各观察小鼠1次,连续观察14天。观察记录小鼠的行为活动、精神状态、进食量、排泄、皮毛,体质量变化以及死亡等情况。两组小鼠14天之内均未见死亡及异常反应,处死后解剖肉眼观察小鼠主要脏器,心、肝、脾、肾、胃、肠等均未发现明显异常改变。CBCG可供灌胃的最大浓度可达0.125 g/ml,所以5 g/kg,0.4 ml/10g已达CBCG灌胃的最大浓度和最大体积,预实验小鼠全部存活,无法测出该药物的半数致死剂量(LD50)。参照《药理实验方法学》[8],将用药量调整为5g/kg,0.4ml/10g进行正式实验。
1.3.2正式实验 选昆明种小鼠20只,雌雄各半,体重20±2 g,随机分为给药组和对照组(10只/组)。给药前禁食不禁水12 h。给药组给予CBCG淀粉混悬液5 g/kg,0.4 ml/10 g,对照组给予1%淀粉液灌胃,0.4 ml/10 g,24 h内灌胃3次。常规饲养,灌胃后密切观察小鼠4 h,之后改为每天上午、下午各观察小鼠1次,连续观察14天。小鼠死亡及毒性反应情况记录方法同预实验,末次观察小鼠后全部处死,解剖肉眼观察小鼠重要脏器是否有异常变化,并作肝脏、肾脏石蜡包埋、切片、HE染色。
1.4统计学方法
采用SPSS 13.0统计软件进行数据分析。计量资料用均数±标准差(Mean±SD)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1小鼠一般情况和存活情况
两组小鼠经灌胃后,多数小鼠会出现困倦现象,活动减少,呼吸加快现象,随后的4小时密切观察则困倦现象逐渐消失,呼吸逐渐平稳,灌胃后1-2天即可恢复正常。观察期间小鼠外观毛色、行为、分泌物、排泄物等一般状况均无明显异常。连续观察14天,CBCG组和对照组小鼠均未出现死亡。
2.2灌胃后小鼠进食量及体质量变化
两组小鼠仅在给药后3天内进食量减少,灌胃过程机械性刺激可能影响小鼠进食,随后的两组进食量没有明显的差异,比较无统计学意义(P>0.05,图1)。与对照组相比,给药组小鼠体质量未见明显减轻,增长正常,两组比较差异无统计学意义(P>0.05,表1)。
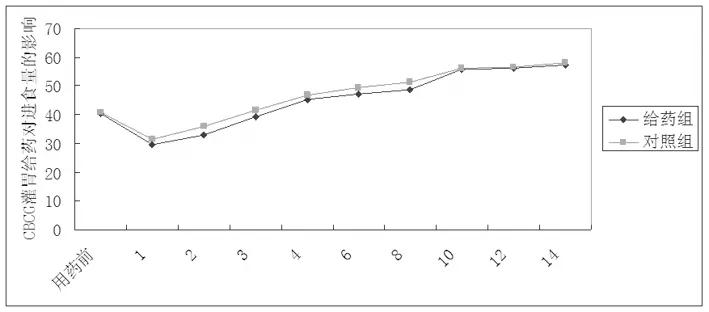
图1 CBCB灌胃给药对小鼠进食量的影响

表1 CBCG对小鼠体质量的影响(n=10)
2.3灌胃后小鼠重要组织脏器的变化
观察期结束后未出现小鼠死亡现象,解剖肉眼观察小鼠肝、肾、心、脾脏、肺等重要脏器颜色、质地等未见明显异常,仅见给药组部分小鼠有肠胀气情况。肝脏HE染色,细胞核圆、位于中央,胞浆染成红色,两组之间未发现明显差异;肾脏HE染色,组织结构清晰,细胞完整无损伤,两组之间未发现明显差异(图2)。
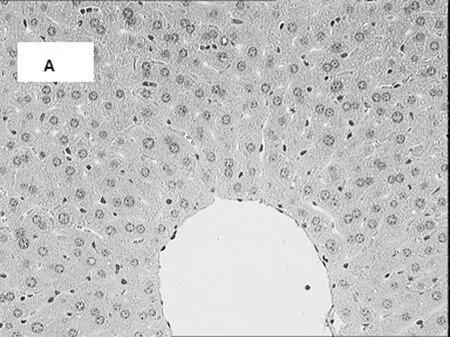



A:对照组肝脏;B:给药组肝脏;C:对照组肾脏;D:给药组肾图2 CBCG灌胃给药对小鼠肝肾组织形态学的影响
3 讨 论
急性毒性试验多进行LD50的测定。1995年在东京召开的国际标准试验规范协调会议上提出动物毒性试验不测LD50也可以。LD50不再是急性毒性试验的规范要求[9]。由于受小鼠灌胃体积和CBCG溶解度的限制,CBCG 5 g/kg,0.4 ml/10 g已达最大给药体积、最大给药浓度,预实验无法测出LD50。根据《中药、天然药物急性毒性实验研究技术指导原则》,因此正式实验时以CBCG 5 g/kg,0.4 ml/10 g灌胃给药。
正式实验给药组小鼠未出现死亡,未见明显毒性表现。与对照组相比,给药组小鼠在行为活动、精神状态、排泄、皮毛等方面无明显差异,体重增长也无明显差异。两组小鼠进食量仅在灌胃后3天有所下降,其原因可能是灌胃机械性刺激,3天后小鼠进食量增加,两组进食量无明显差异。与对照组比较,解剖观察发现给药组小鼠部分出现肠胀气。两组肝脏、肾脏、肺、脾脏等重要脏器外观、质地等未见明显异常,肝脏肾脏HE染色无明显差异。CBCG用药量在5g/kg时未见明显毒性反应。因此,CBCG淀粉混悬液小鼠灌胃最大耐受量为≥5 g/kg。
感谢泰山医学院药学院高云生教授给予的指导,感谢泰山医学院动脉粥样硬化研究所提供的研究平台。
[1] 周广礼,高允生,赵晓民,等.一种化学法工业化生产牛黄的方法[P].中国, ZL2009 10013647.7[P].2011-6-8.
[2] 周广礼,张丰雪,朱长义.以大肠杆β-菌葡萄糖醛酸酶培育牛黄实验研究[J].泰山医学院学报,1991,12(1):13-14.
[3] 李珂,王唯红,齐永秀.6种胆酸类成分的HPLC-ELSD测定法及在两种牛黄中的含量比较[J].中国药学杂志,2010,45(8):626-629.
[4] 李珂,齐永秀,于秀玲.酶促牛黄与牛黄HPLC指纹图谱比较研究[J].中成药,2011:33(1):1-5.
[5] 李珂.酶育牛黄与天然牛黄化学成分的比较研究[D].山东大学,2010.
[6] 刘化侠, 魏寅翼,胡晓旭.酶育牛黄对肉瘤S180的抑制作用及免疫调节作用的初步研究[J].泰山医学院,2012,33(10):701-704.
[7] 张艳英,李娜.酶促牛黄对小鼠抗炎作用的观察[J].养生保健指南,2012,(3):53-54.
[8] 徐叔云,卞如濂,陈修.药理实验方法学[M].第3版.北京:人民卫生出版社,2001:227-229.
[9] 周宗灿.毒理学基础[M].北京:北京医科大学出版社,2000:65-74.
