5-BrdU标记骨髓间充质干细胞对顺铂耳中毒豚鼠耳蜗的保护作用
2014-06-12张翠翠
张翠翠
以顺铂为代表的铂类化合物主要用于肿瘤化疗,其最常见的毒副反应是以听功能下降为表现的耳毒性,因此如何有效预防和治疗顺铂耳毒性成为研究的热点。目前治疗顺铂耳毒性主要是用活血化瘀类药物如川芎嗪等,而骨髓间充质干细胞(mesenchymal stem cells,MSCs)是体内具有更新能力和分化潜能的细胞,可诱导分化为其他细胞。本实验将5-BrdU(5-bromo-2-deoxyuridine)标记的MSCs通过鼓阶注射法移植入顺铂耳毒性模型豚鼠耳蜗内,探讨其在顺铂耳毒性模型豚鼠耳蜗内的存活、分化及细胞增殖情况,以期为顺铂耳毒性细胞疗法的研究提供依据。
1 材料与方法
1.1实验动物和主要试剂 选择健康8周龄清洁级豚鼠 20只,听力无异常,体重250 g左右,雌雄不限,购于潍坊医学院实验动物中心。胰蛋白酶、鼠抗BrdU,抗鼠BrdU抗体 (武汉博士德生物工程有限公司) 二氨基联苯胺(DAB) 显色试剂(武汉博士德生物工程有限公司)。
1.2方法
1.2.1MSCs体外分离、培养及纯化 随机取抽4只豚鼠的骨髓,采用颈椎脱臼处死豚鼠,打开双侧股骨、胫骨,D-Hank液冲洗骨髓腔多次,筛网(100目)过滤,按密度梯度离心法[1]将MSCs分离,将Percoll(密度为1.073 g/ml)置于试管的底部,然后沿管壁缓慢滴加骨髓悬液(Percoll与骨髓比例 1:1),离心(离心力为 400 g,时间25 min),分离出位于界面层灰白色的细胞,用 L-DMEM(10%胎牛血清、 100 mg/L青霉素、100 mg/L链霉素)离心洗涤 2 次(800 r/min,5 min),接种在培养液中(密度3.0×105/cm2),放入CO2培养箱,48 h 后首次换液,培养液每 3 d 更换。传代培养待细胞接近80%铺满瓶底,将原培养液弃去,用 D-Hank 液冲洗 3次,加入 0.25%的胰蛋白酶和 0.02%的 EDTA 消化细胞,显微镜下当细胞收缩变圆时终止消化,加入含少量血清的培养液,轻轻吹打细胞,收集细胞悬液,离心(800 r/min,5 min),弃上清液。加入完全培养液充分吹打成单细胞悬液,而后按1∶3传代于培养瓶内,待细胞铺满瓶底后,重复上述操作,培养至第3代。
1.2.25-BrdU标记MSCs 细胞出现80%融合时,弃掉旧的培养基,用浓度为10 g/ml 5-BrdU标记培养基,置于37 ℃, 5% CO2培养箱中培育15 min。弃去培养基,PBS冲洗后,备用。
1.2.3豚鼠ABR检测 16只豚鼠建立顺铂耳毒性模型,建模前后及细胞移植前后分别行ABR检测。腹腔注射1 %戊巴比妥钠(30 mg/kg)[2]麻醉豚鼠,将豚鼠固定后在隔声屏蔽室内检测。采用短声(10次/秒)刺激,由声刺激器电脉冲(输入波宽 0.1 ms)经耳机输出 (耳机紧靠豚鼠耳廓,距离外耳道约 0 .5 cm左右)。放大器带通滤波为80~3 000 Hz,增益2 000,叠加200次。记录电极置于颅顶正中部,参考电极与接地电极分别放于给声耳及对侧耳乳突部。以波IV刚出现时的刺激声强度为反应阈。
1.2.4顺铂耳毒性模型的建立及内耳细胞移植 ABR检测完后,采用腹腔注射顺铂4 mg/kg-1·d-1,连续7 d,建立豚鼠顺铂耳毒性模型。建模后,1%戊巴比妥钠(30 mg/kg)麻醉豚鼠,消毒后,在右耳后上部切开,暴露并打开听泡,用电钻在耳蜗底开孔透过耳蜗骨壁进入鼓阶打开直径0.1 mm 的圆孔,随即可见清亮外淋巴液流出,在微量泵(TJ-1A Syringe Pump Controller) 控制下将0.1 μl 5-BrdU标记的MSCs注入右耳,将上述造孔处用医用耳脑胶封闭,缝合切口。左耳为对照耳,手术同右耳;然后注射生理盐水后封闭凿孔,缝合切口。术后肌注青霉素(华北制药股份有限公司)预防感染,1 次/日,持续给药 3天。
1.2.5内耳标本处理 豚鼠在移植结束后第1、4 w检测ABR后各处死8只,水合氯醛麻醉后快速断头,分别取左耳和右耳听泡,第1、4 w取出的左、右耳听泡均分成两部分:一部分用于硝酸银染色,开放前庭窗和蜗窗;一部分用于免疫组织化学染色,放入固定液中过夜,10% EDTA中脱钙14 d。梯度酒精脱水、二甲苯透明,平行蜗轴方向用石蜡包埋,切片,厚约5 μm。
1.2.6硝酸银染色 打开前庭窗和蜗窗的听泡,用硝酸银溶液(0.5%新鲜配制)从蜗尖处灌注,然后灌注4%多聚甲醛溶液,并于多聚甲醛溶液固定2 h后,在解剖显微镜下剥离耳蜗基底膜,铺片,中性树胶封片。光镜下判定毛细胞缺失情况。
1.2.7BrdU免疫组织化学染色 根据抗原热修复技术中贴片改良法,用阳离子玻片(购于三顿公司)捞片,过夜后,放至装有加热到95 ℃的枸橼酸钠溶液(0.01 M)的50 ml烧杯中,用恒温水浴锅热修复30 min后冷却至室温。清洗后,置于盐酸(2 mol/L)中变性30 min,PBS 漂洗(5 min×3次),用3 %双氧水以去除内源性过氧化物酶15 min,室温下用 5% BSA封闭 1 h,采用SABC法行免疫组织化学染色,一抗为小鼠抗BrdU单克隆抗体(武汉博士德生物工程有限公司,1:1 000),室温孵育过夜,二抗为生物素化兔抗小鼠IgG(武汉博士德生物工程有限公司,1:200),37 ℃孵育2 h, ABC 复合物(武汉博士德生物工程有限公司,1:200)37 ℃孵育1 h,用0.05 %DAB(武汉博士德生物工程有限公司)显色。梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察耳蜗内BrdU染色阳性细胞判断移植后细胞增殖和分布情况。
2 结果
2.1动物存活情况 术后24小时实验豚鼠死亡1只,解剖死亡动物的内耳,未见出血、化脓。
2.2造模前后及植入MSCs后1、4 w ABR反应阈 豚鼠顺铂耳毒性造模前后ABR反应阈和内耳注射后1周、4周ABR反应阈见表1,可见,左耳注射生理盐水后ABR阈值较造模前均升高(P<0.05),而右耳注射MSCs后4 w ABR反应阈较造模后明显降低(P<0.05),表明鼓阶注射MSCs可修复大鼠听功能损伤。
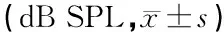
表1 豚鼠造模前后及MSCs注射后1、4 w左、右耳 ABR反应阈
注:*与右耳造模后比较,P<0.05,△与各自造模前比较,P<0.05
2.3耳蜗毛细胞铺片 光镜下显示,右侧耳蜗移植5-BrdU标记的MSCs 1 w后,MSCs细胞生长、增殖,排列规则(图1a),4 w后,MSCs细胞进一步生长、增殖,排列规则整齐,边界清楚,且无缺失及损伤(图1b);左侧耳蜗注射生理盐水后于1 w后见毛细胞肿胀,结构紊乱(图2a),4 w后明显损伤,毛细胞肿胀,结构紊乱,排列不整齐,外毛细胞缺失数目增加,甚至成片缺失(图2b)。
2.4蜗内移植细胞免疫化学结果 右侧耳蜗移植5-BrdU标记的MSCs 1 w后耳蜗内见BrdU染色阳性细胞,胞浆呈棕黄色,细胞呈纺锤形或卵圆形,排列不规则(图3a),BrdU染色阳性细胞主要分布于耳蜗的外淋巴;4 w后耳蜗内BrdU染色阳性细胞逐渐增多,细胞呈圆形且细胞核大,排列逐渐规则(图3b)。左侧耳蜗注射生理盐水后1、4 w均未见BrdU染色阳性细胞(图4)。
3 讨论
目前,顺铂的耳毒性一直缺乏有效的药物治疗手段。骨髓间充质干细胞(MSCs)具有很强的分化潜能。动物实验证实,MSCs在特定条件下可以诱导分化为神经元样细胞[3],能够修复缺血性脑损伤大鼠的神经细胞[4],在体内能够增殖并分化从而修复已受损神经[5]。MSCs在特定条件下还可以诱导分化为内耳功能细胞[6]。耳蜗移植MSCs治疗耳聋是目前研究的热点,目前耳蜗内移植MSCs采用经耳蜗鼓阶微造孔法注射[7]。MSCs经鼓阶打孔注射[8]导入耳蜗最为合适。实验研究表明MSCs既能在内耳中表达毛细胞从而使受损的耳蜗恢复功能又不影响耳蜗原有的功能[9]。BrdU结构与胸腺嘧啶脱氧核苷类似,在DNA合成时能取代胸腺嘧啶整合到新细胞核DNA中。干细胞治疗的研究中主要采用BrdU标记及示踪技术,BrdU标记具有不影响MSCs生长的优点,能准确反映移植细胞的增殖、细胞分化及其迁移过程[10],是可靠的示踪方法[11]。
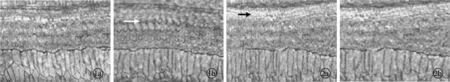
图1a 右侧耳蜗移植后1 w MSCs细胞生长、增殖,排列规则 (×400)图1b 右侧耳蜗移植后4 w MSCs细胞生长、增殖,排列规则边界清楚(×400) 图2a 左侧耳蜗移植后1 w毛细胞毛细胞肿胀结构紊乱(×400)图2b 左侧耳蜗移植后4 w毛细胞排列排列不整齐,甚至成片缺失(×400)
图3a 右侧耳蜗1 w BrdU染色阳性细胞(×200)图3b 右侧耳蜗4 w BrdU 染色阳性细胞 (×200) 图4a 左侧耳蜗1 w未见BrdU染色阳性细胞(×200)图4b 左侧侧耳蜗4 w未见BrdU 染色阳性细胞 (×200)
本实验采用耳蜗毛细胞铺片和BrdU免疫组织化学染色发现,与左侧耳蜗(注入生理盐水)相比,右侧耳蜗(移植BrdU标记的MSCs)MSCs细胞生长、增殖,排列规则;右侧耳蜗在不同时间段内均可见BrdU标记后的MSCs在耳蜗内存活,增殖,随着时间延长阳性细胞逐渐增多,进一步证明了细胞的增殖能力;ABR检测显示,实验耳在术后28 d ABR阈值能够恢复到造模前正常水平,说明5-BrdU标记的MSCs植入顺铂耳中毒豚鼠耳蜗中能存活、增殖生长,从而对豚鼠听功能起到保护作用。
本研究采用的MSCs移植为将来在人工耳蜗植入术的同时实施细胞移植或基因治疗提供了可能,以期能为顺铂耳毒性细胞疗法的临床应用提供基础研究依据。
4 参考文献
1 许峰,李宝平,张雷,等. 全骨髓贴壁改良法分离培养人骨髓间充质干细胞及标记鉴定[J]. 中国医学工程,2012,20:62.
2 严星,谢南屏,马敬,等. 不同剂量戊巴比妥钠对豚鼠听性脑干诱发电位的影响[J].甘肃科技,2007,23:188.
3 Deng J,Petersen BE,Steindler DA,et al.Mesenchymal stem cells spontaneously express neural proteins in culture and are neurogenic after transplantation [J].Stem Cells,2006,24:1 054.
4 韩聪,段炼.骨髓间充质干细胞治疗缺血性脑卒中的机制研究[J].立体定向和功能性神经外科杂志,2011,24:125.
5 李轶,张重功,马杰,等.骨髓间充质干细胞移植治疗脑梗死的研究进展[J]. 神经疾病与精神卫生,2006,6:470.
6 刘谦虚,谢鼎华,陈观贵.脑源性神经营养因子基因转染骨髓间充质干细胞体外诱导分化为神经元样细胞初步观察[J].听力学及言语疾病杂志,2009,17:252.
7 陈观贵,徐惠清.干细胞移植豚鼠耳蜗形态结构及听力的变化[J]. 中国组织工程研究与临床康复,2011,15:7 525.
8 郭维,杨仕明,翟所强. bFGF/Math1 基因表达载体的构建及在大鼠耳蜗中的表达[J].听力学及言语疾病杂志,2005,13:107.
9 Matsumoto M,Nakagawa T,Kojima K,et al. Potential of embryonic stem cell-derived neurons for synapse formation with auditory hair cells[J]. Neurosci Res,2008,86:3 075.
10 Seaberg RM,van der Kooy D. Adult rodent neurogenic regions: the ventricular subependyma contains neural stem cells,but the dentate gyrus contains restricted progenitors [J]. Neurosci,2002,22:1 784.
11 余文洪,刘登群,谭力,等.两种干细胞体外标记及体内示踪方法的比较研究[J].成都医学院学报,2012,7:15.
