甲硫氨酸对噪声性听力损失的预防作用研究
2014-06-12葛振民马枢贾晓青
葛振民 马枢 贾晓青
噪声性听力损失(noise-induced hearing loss,NIHL)是指生产、生活以及军事活动中因接触噪声刺激所引起的感音神经性听力减退,大量的研究发现氧化应激是导致耳蜗毛细胞凋亡引起噪声性听力损失发生的重要机制[1],而且动物实验也已经证实抗氧化剂,如:甲硫氨酸等,对噪声性听力损失具有明确的保护作用[2,3]。本研究旨在探讨口服甲硫氨酸片对健康成人噪声性听力损失的保护作用。
1 资料与方法
1.1研究对象与分组 选择解放军某部健康男性军人203名作为研究对象,年龄19~35岁,平均21.5±7.2岁,随机分为试验组113例和对照组90例,既往均无明确噪声接触史,无听力减退、耳部疾病或其它影响听力的疾病(如高血压、糖尿病、耳毒性药物使用等)病史。本研究经医院伦理委员会批准同意,所有受试者于实验前均签署了知情同意书。
1.2噪声暴露及给药方法 噪声暴露条件:自动武器实弹射击训练,噪声为脉冲噪声,峰值160~170 dB SPL,连续暴露1.5小时。于噪声接触前3天,试验组给予甲硫氨酸片(成都利尔药业有限公司,0.25 g×36片/盒)口服,750 mg/次,2次/日,对照组给予等量安慰剂(食用淀粉)口服,均连续服药3天。
1.3听力检测方法 两组对象于噪声暴露前、暴露后1、7天分别行纯音听阈测试、ABR检查。
1.3.1纯音听阈测试 由同一名检查者按GB规定的测试方法,对每位受试者进行0.5、1.0、2.0、4.0 kHz频率的常规纯音听阈测试。仪器采用丹麦生产的MadsenOB 922型临床听力计,测试在环境噪声<25 dB A的隔声室内进行。
1.3.2ABR检测 ABR测试仪器选用日本光电诱发电位仪,测试在隔声屏蔽室进行,记录电极置于颅顶,参考电极置同侧乳突处,前额发际接地。短声刺激,带通滤波100~3 000 Hz,分析时间10 ms,叠加1 000次;刺激强度从70 dB nHL开始,以10 dB步距递减,以能引出可重复波Ⅴ的最小刺激声强作为ABR波Ⅴ反应阈值,记录ABRⅠ-Ⅴ波间期(Ⅰ-Ⅴ IPL)及波Ⅴ反应阈。
1.4统计学方法 所有检测结果使用SPSS11.0软件进行统计学处理。同组试验前后差异比较采用配对t检验分析,组间差异比较采用成组t检验分析。
2 结果
两组受试者噪声暴露前、暴露后1、7天纯音听阈见表1,ABR反应阈及I-V波间期见表2。可见,噪声暴露前两组的纯音听阈、ABR反应阈及I-V波间期差异无统计学意义(P>0.05);噪声暴露后1天(P<0.01)、7天(P<0.05)试验组纯音听阈、ABR反应阈及I-V波间期均低于对照组。与噪声暴露前相比较,噪声暴露后1天两组纯音听阈、ABR反应阈及I-V波间期均升高(P<0.05或P<0.01),试验组与对照组差异有显著统计学意义(P<0.01);噪声暴露后7天试验组与暴露前无差异(P>0.05),而对照组仍较暴露前升高(P<0.05);对照组于噪声暴露7天后按照噪声性聋治疗方案给予治疗,远期(1年以上)随访,听力基本恢复正常。
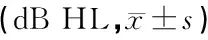
表1 噪声暴露前、后两组受试者各频率纯音听阈比较
注:与对照组同频率比较,*P<0.05,**P<0.01;与同组暴露前比较,△P<0.05,△△P<0.01
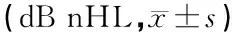
表2 噪声暴露前、后两组受试者ABR反应阈和I-V波间期(ms)比较
注:与试验组同时间点比较,★P<0.05,▲P<0.01;与同组暴露前比较,※P<0.05,◆P<0.01
3 讨论
噪声暴露后多种机制参与噪声性听力损失的发生,包括耳蜗血流减少、谷氨酸的兴奋毒性、钙离子平衡改变及氧化应激等[4],其主要表现为听敏度下降和听阈改变。噪声暴露可引起耳蜗血流的剧烈变化和高代谢活动,产生过多的活性氧和活性氮等自由基,超过了细胞抗氧化系统的清除能力,蓄积的活性氧和活性氮等自由基损害DNA、脂质和蛋白质,从而引起耳蜗细胞的坏死或凋亡[5]。同时,许多研究已经证实使用抗氧化剂能够调节耳蜗抗氧化状态,减轻噪声性听力损失和耳蜗毛细胞损伤,具有保护听力的作用[4,6~8],故本研究探讨口服甲硫氨酸片对噪声性听力损失的预防作用。
甲硫氨酸为氨基酸类药,是体内胆碱生物合成的甲基供体,其释放出活性甲基,阻断自由基的连锁反应,保护抗氧化酶的活性,同时还能够增加还原型谷胱甘肽的活性,增加机体抗氧化能力,通过抗氧化机制可发挥预防噪声性聋的作用[2]。动物实验证实甲硫氨酸对噪声、顺铂和氨基糖苷类药物引起的听力减退具有保护作用,Kopke等[9]利用沙鼠研究发现噪声暴露前、后或暴露后7小时静脉使用甲硫氨酸可减轻永久性阈移和耳蜗外毛细胞死亡;许多研究者将其应用于小鼠、豚鼠噪声性听力损失的研究也得到了相同的结果[ 10]。从本研究结果看,噪声暴露前3天给予甲硫氨酸片口服,能有效减轻噪声暴露对听力的损伤,且噪声暴露后7天,试验组的纯音听阈及ABR反应阈仍低于对照组(P<0.05或P<0.01),提示甲硫氨酸对听力的保护作用在停止用药后仍可持续一段时间,与Alexander等[11]的实验结果一致。推测甲硫氨酸可能通过直接清除自由基,保持过氧化氢酶、谷胱甘肽还原酶、超氧化物歧化酶的水平,阻止耳蜗细胞凋亡,从而预防噪声性听力损失的发生。
前期研究证实N-乙酰半胱氨酸作为还原型谷胱甘肽补充物前体能够减轻噪声对听力的损伤[7],验证了还原型谷胱甘肽参与噪声性暂时性阈移主要的细胞内抗氧化途径;Yamasoba等[12]研究发现噪声暴露能够改变耳蜗还原型和氧化型谷胱甘肽的比例,氧化型谷胱甘肽增加,还原型谷胱甘肽减少,而前者参与活性氧引起的耳蜗细胞损伤;Campbell[13]、Grondin[14]等研究证实甲硫氨酸能减轻顺铂引起的谷胱甘肽还原酶活性降低,预防顺铂对听力的损伤;本研究发现预服甲硫氨酸片在噪声暴露后7天其仍具有听力保护作用,推测甲硫氨酸也可能通过后期修饰,硫化为半胱氨酸的中间物腺苷甲硫氨酸,增加还原型谷胱甘肽水平而发挥抗氧化作用,从而减轻噪声对听力的损伤。
目前,已经开始了几种抗氧化剂预防噪声性聋的临床试验,包括甲硫氨酸、维生素A、C、E和镁剂,N-乙酰半胱氨酸以及依布硒[10],本研究证实噪声暴露前口服甲硫氨酸片可一定程度地减轻噪声性听力损失的发生,但噪声暴露前口服甲硫氨酸的最佳使用时机还需要进一步探讨。
4 参考文献
1 Henderson D, Bielefeld EC, Harris KC, et al. The role of oxidative stress in noise-induced hearing loss[J]. Ear Hear, 2006, 27:1.
2 Alagic Z, Goniny M, Canlon B. Protection against acoustic trauma by direct application of D-methionine to the inner ear[J]. Acta Otolaryngol, 2011,131:802.
3 Prell L, Johnson A, Lindblad A, et al. Increased vitamin plasma levels in Swedish military personnel treated with nutrients prior to automatic weapon training[J]. Noise Health, 2011,13:432.
4 OishiI N, Schacht J. Emerging treatments for noise-induced hearing loss[J]. Expert Opin Emerg Drugs, 2011,16:235.
5 Evans P, Halliwell B. Free radicals and hearing. Cause, consequence, and criteria[J]. Ann N Y Acad Sci, 1999, 884:19.
6 Campbell K, Leprell C. Potential therapeutic agents[J]. Seminars in Hearing, 2012, 33:97.
7 葛振民,马枢,贾晓青,等. N-乙酰半胱氨酸对噪声性聋的预防作用研究[J]. 临床耳鼻咽喉头颈外科杂志,2011,25:1 040.
8 Rewerska A, Pawelczyk M, Raukowska E, et al. Evaluating D-methionine dose to attenuate oxidative stress-mediated hearing loss following overexposure to noise[J]. Eur Arch Otorhinolaryngol, 2013, 270:1 513.
9 Kopke RD, Coleman JK, Liu J, et al. Candidate's thesis:enhancing intrinsic cochlear stress defenses to reduce noise-induced hearing loss[J]. Laryngoscope, 2002, 112:515.
10 Clifford RE , Coleman JK , Balough BJ , et al . Low-dose D-methionine and N-acetyl-L-cysteine for protection from permanent noise-induced hearing loss in chinchillas[J]. Otolaryngol Head Neck Surg , 2011, 145:999.
11 Alexamder D, Claussen D, Aniel J, et al. D-methionine pre-loading reduces both noise-induced permanent threshold shift and outer hair cell loss in the chinchilla[J]. Int J Audiol, 2013, 52:801.
12 Yamasoba T, Harris C, Shoji F, et al. Influence of intense sound exposure on glutathione synthesis in the cochlea[J]. Brain Res, 1998, 804:72.
13 Campbell K, Claussen A, Meech R, et al D-Methionine (Dmet) significantly rescues noise-induced hearing loss: timing studies[J]. Hear Res, 2011, 282:138.
14 Grondin Y, Cotanche DA, Manneberg O, et al . Pulmonary delivery of d-methionine is associated with an increase in ALCAR and glutathione in cochlear fluids[J]. Hear Res, 2013, 298:93.
