多孔半互穿温敏水凝胶点击反应固定化酶
2014-06-11丁齐邢晓东李丽霞
丁齐,邢晓东,李丽霞
(南京理工大学化工学院,江苏 南京 210094)
聚N-异丙基丙烯酰胺(PNIPAM)水凝胶是一种典型的温敏水凝胶,当外界温度低于最低临界溶解温度(LCST)时,亲水基团通过氢键与水分子结合,凝胶吸水溶胀。温度高于LCST时,氢键作用减弱,疏水基团间的相互作用加强,凝胶失水收缩[1]。以PNIPAM温敏型水凝胶固载酶,可以利用其可逆的相转变过程,在其LCST附近升降温度,凝胶收缩溶胀吸入或吐出底物使反应进行或中断,起到一个“开关”的作用,而且温度高时凝胶收缩疏水,有利于保护酶不会高温下失活;同样的原理,还可以利用温敏凝胶的这种特性来固定化酶,温度低时,凝胶溶胀将酶溶液吸入内部,进行固定化反应,温度高时,凝胶收缩将没有反应的溶液排出。半互穿聚合物网络(semi-IPN)技术可以改善水凝胶的性能,在 semi-IPN水凝胶中两种组分间没有化学结合,各组分具有相对独立性,这种结构可以提高每个分子链的相容性,增加网络密度,增大相互间结合力[2]。Alves等[3]以N-异丙基丙烯酰胺、海藻酸钙制备了 pH/温度敏感的半互穿水凝胶,并分别研究了其pH值、温度响应性。Guo等[4]以羧甲基壳聚糖和聚(N-异丙基丙烯酰胺)制备了半互穿网络的水凝胶聚合物,并研究了该聚合物的药物释放性能。
巯基是蛋白质氨基酸残基中最活泼的反应性基团[5],其与马来酰亚胺的迈克尔加成反应是经典的点击化学反应。该反应在三乙胺催化下具有反应选择性、活性高及反应条件温和的特点[6-7]。已有的文献,大多是以戊二醛为交联剂进行酶的固定化的,很少有研究者利用点击反应进行酶的固定化研究。本工作以甲基丙烯酸-β-羟乙酯(HEMA)和N-异丙基丙烯酰胺(NIPAM)为原料制备了温敏型的多孔半互穿水凝胶,然后引入马来酰亚胺基团修饰,得到新型固定化酶载体:水凝胶Ⅰ和Ⅱ,研究了其溶胀性能,然后利用马来酰亚胺与巯基的点击反应进行酶的固定化[8],并全面考察了固定化酶的性能。
1 实验部分
1.1 试剂与仪器
N-异丙基丙烯酰胺(NIPAM)(≥98%),偶氮二异丁腈(AIBN)(99%),顺丁烯二酸酐(马来酸酐,AR,99.5%),阿拉丁试剂有限公司;N,N-亚甲基双丙烯酰胺(BIS,≥98%),天津市化学试剂研究所,乙醇重结晶;聚乙二醇2000(PEG2000,CP),西陇化工有限公司;2-hydroxyethyl methacrylate(HEMA,97%),ACROS ORGANICS;脂肪酶、糖化酶,国药集团化学试剂有限公司。
JSM-6380LV型扫描电镜,日本 JEOL公司;Nicolet iS10型傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司。
1.2 水凝胶酶固定化载体的制备及表征
1.2.1 水凝胶及凝胶固定化载体的制备
(1)线型聚合物 PHEMA和PAEMA 的制备
PHEMA:将5 mg引发剂AIBN以及单体HEMA 0.9 g溶于4 mL DMSO中,通氮气,60 ℃反应10 h。PAEMA: PHEMA 加入适量乙二胺,117 ℃回流10 h,除去未反应的乙二胺,得到产物。反应式如式(1)。
(2)多孔半互穿水凝胶的制备
制孔剂PEG2000 100 mg、单体NIPAM 150 mg、交联剂Bis 4 mg、引发剂AIBN 3 mg以及PHEMA或PAEMA 75 mg于DMSO 0.6 mL中溶解,通氮气,60 ℃反应6 h,得到半互穿凝胶C或B,将凝胶于蒸馏水中浸泡14天(每天换水)。水凝胶C于乙二胺中117 ℃回流10 h,反应结束后沸水洗涤,得到水凝胶A。反应式如式(2)、式(3)。

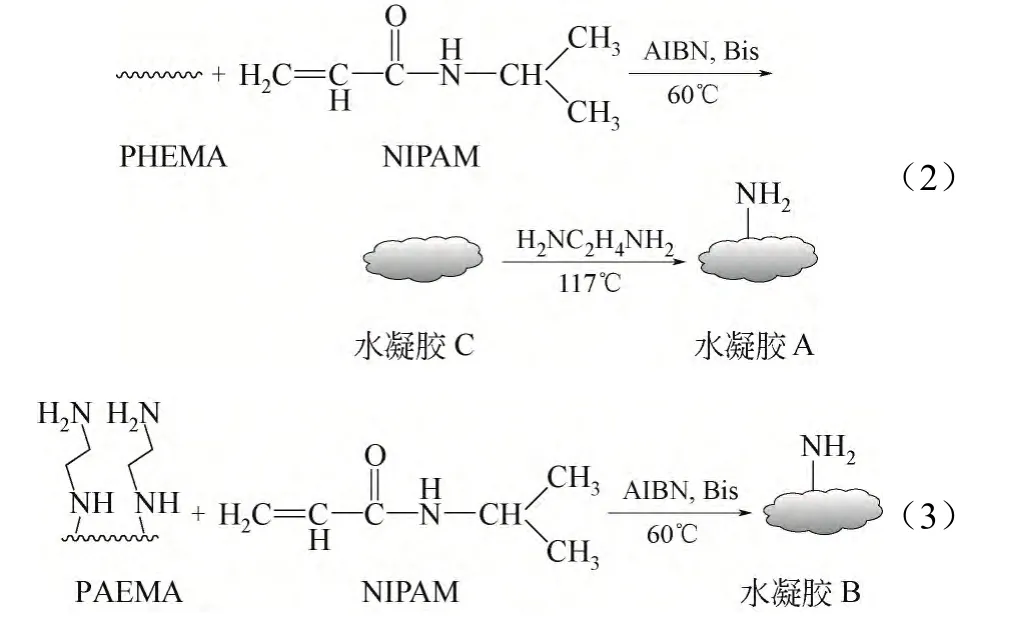
(3)水凝胶的马来酰亚胺修饰
10 mL N,N-二甲基甲酰胺(DMF)为溶剂,分别加入水凝胶 A、B,通氮气,边搅拌边滴加马来酸酐(0.5 g),滴加完毕后继续搅拌1 h。然后加入5 mL三乙胺,153 ℃回流4 h,反应结束后用水洗涤凝胶多次,分别得到水凝胶Ⅰ和Ⅱ。反应式如式(4)。

1.2.2 水凝胶Ⅰ和Ⅱ的表征及性能测试
真空干燥好的水凝胶A、B、C、Ⅰ、Ⅱ研成粉末,采用衰减全反射(ATR)法测定其红外光谱。
室温下达到溶胀平衡的水凝胶Ⅰ和Ⅱ切片,快速冷冻后冷冻干燥48 h做扫描电镜表征。多孔半互穿水凝胶具有多孔结构,采用冷冻干燥可以保持水凝胶的结构在干燥过程中不被破坏。
将水凝胶Ⅰ和Ⅱ在 20~50 ℃蒸馏水中浸泡,待其达到溶胀平衡,用润湿的滤纸拭干水凝胶表面的水分,称重。水凝胶的溶胀比 SR定义为:SR=(ms−md)/md。式中 ms为达到某一温度溶胀平衡状态时的水凝胶的质量;md为真空干燥至恒重时凝胶的质量。
将室温下达到溶胀平衡的水凝胶Ⅰ和Ⅱ快速转移至 50 ℃的蒸馏水中,每隔一定时间取出水凝胶称取水凝胶的质量mt,直至其质量不变为止。水凝胶保水率 WR 定义为:WR=(mt−md)/ mr×100% 。式中mr为室温下达到溶胀平衡时水凝胶中水的质量。作保水率与时间的关系曲线,即得水凝胶在 50 ℃的去溶胀动力学曲线。
将真空干燥至恒重的水凝胶Ⅰ和Ⅱ浸泡在室温下的蒸馏水中,每隔一定时间,取出水凝胶称重,直至其质量不变。凝胶吸水率 WU定义为:WU=(mt−md)/mr×100%。作吸水率与时间的关系曲线,即得水凝胶在室温下的再溶胀动力学曲线。
1.3 固定化酶的制备及性能测定
1.3.1 固定化酶的制备
根据Agnieszka等[9]提出的方法,利用多孔半互穿温敏水凝胶的温敏性能,高温时凝胶收缩,将其加入到酶溶液中,凝胶开始吸收酶溶液发生溶胀,酶分子在凝胶内部与凝胶发生交联反应,制得固定化酶。得到的固定化脂肪酶于0.1 mol/L的磷酸盐缓冲液(pH值 7.0)4 ℃保存,固定化糖化酶于0.1mol/L的乙酸盐缓冲液(pH值4.5)4 ℃保存,备用。反应式如式(5)。

在本实验中,将采用以水凝胶A和B为载体,2.5%戊二醛溶液为交联剂的固定化酶作为对比(本研究条件下,戊二醛浓度为2.5%时得到的固定化酶活性、稳定性等相对最佳)。
1.3.2 固定化酶性能测定
酶的固载量测定采用 BCA蛋白试剂盒法。固载量=(c初−c余)v/m干凝胶,式中,c初为固定化之前初始酶液的蛋白浓度,mg/mL;c余为固定化后酶余液的蛋白浓度,mg/mL;v为固定酶时所用酶溶液的体积,mL;m干凝胶为干燥的凝胶载体的质量,g。
在一定条件下,酶催化反应进行每分钟释放出1 μmol产物所需酶/固定化酶的量为一个活力单位(U):U=cv/tm。式中,U为酶活力,U/g或U/mL;c为产物的浓度,μmol/mL;v为产物溶液的体积,mL;t为反应时间,min;m为消耗的酶的质量,g;糖化酶为体积,mL。脂肪酶的活力测定采用对硝基苯酚棕榈酸酯(Pnpp)法;糖化酶的活力测定采用葡萄糖氧化酶法(GOD)法。
活力回收率=Us/U0×100%。其中,Us为固定化酶的活性,U/g或 U/mL;U0固定化之前游离酶的活性,U/g或U/mL。
连续进行 10次催化反应后固定化酶的活性与刚刚固定化之后酶的活性之比为固定化酶的操作稳定性,设刚固定化完后固定化酶的活力为 100%;65 ℃下保存16 h后固定化酶的活性与刚固定化完后酶活力比值即为固定化酶的热稳定性;4 ℃下保存 20天后固定化酶活力与刚固定后固定化酶的活力比值即为固定化酶的贮存稳定性。
2 结果与讨论
2.1 温敏型大孔半互穿水凝胶的表征与性能
2.1.1 红外光谱分析

图1 水凝胶红外光谱图
图1是水凝胶A、B和C的红外谱图。
图1中,3290~3430 cm−1为PNIPAM 中N—H以及PHEMA中O—H的伸缩振动吸收峰;3078 cm-1为N—H 面内弯曲振动倍频带; 2874 cm-1、2931 cm-1、2966 cm-1处由甲基亚甲基以及聚合物主链上的C—H伸缩振动产生;1650 cm-1由酰胺上羰基伸缩振动产生,即酰胺Ⅰ带,1538 cm-1由酰胺上N—H面内弯曲振动及C—N伸缩振动的组合吸收产生的,即酰胺Ⅱ带,在1385 cm−1、1365 cm−1处为异丙基上的双甲基由于对称变形振动耦合分裂成的双峰。不同的是:水凝胶C中,1725 cm−1处为PHEMA中酯的羰基伸缩振动吸收峰;1135 cm-1,1080 cm−1处为C—C,C—O单键伸缩振动吸收峰;1047 cm−1处是PHEMA中羟基的C—O伸缩振动吸收峰。水凝胶 A 中,1725 cm−1处的吸收峰减弱,1047cm−1处的吸收峰消失,这都说明了乙二胺与酯基发生反应,乙二胺修饰成功。而水凝胶B中,1725 cm-1处吸收峰相对于凝胶 A减弱的更多一些,1047cm-1处的吸收峰也消失,说明了该凝胶的制备成功,而且其α-NH2的含量比A凝胶多。

图2 多孔半互穿水凝胶载体红外光谱图
图2为马来酰亚胺化水凝胶的红外光谱图,理论上 1775 cm−1、1711 cm-1和 1143 cm-1为酰亚胺基团特征吸收峰,1604 cm-1为碳碳双键特征吸收峰[10]。但是本实验红外光谱图中未观察到明显的特征吸收峰,原因可能是水凝胶的酰胺基红外吸收峰较大,相对少量的马来酰亚胺基团特征峰被覆盖,以至于观察不到。
2.1.2 扫描电镜
将凝胶制备成多孔结构,有利于凝胶溶胀/退溶胀速率的增加,底物的进出和酶的固定化。本研究以PEG2000为致孔剂制备多孔水凝胶,马来酰亚胺基团修饰后水凝胶载体Ⅰ和Ⅱ的扫描电镜照片如图3所示。

图3 多孔半互穿水凝胶载体Ⅰ、Ⅱ扫描电镜图
从图3可以看出两种水凝胶载体均含有相互贯通的多孔结构,孔洞大小及分布比较均匀。水凝胶Ⅰ孔径较大,平均为30 μm左右;水凝胶Ⅱ的孔径平均为10 μm,与水凝胶Ⅱ孔径相比较小。大量的孔洞增加了水凝胶与外界的接触面积。
2.1.3 水凝胶的溶胀率
溶胀率(SR)是评价水凝胶性质的一个重要参数[11]。本工作研究了温度对溶胀率的影响。
由图4可知,20 ℃时水凝胶Ⅰ的SR可达到22,而水凝胶Ⅱ的SR仅为14。以交联剂用量来表征交联度[12],两种水凝胶 SR相对于其他文献较小的原因是本文所制备的两种水凝胶交联剂用量为2.6%,为了保证水凝胶有一定的强度所以交联度比较大,从而导致其溶胀比较小。水凝胶B的胺化程度高于A,从而导致Ⅱ的马来酰化程度也稍高于Ⅰ,而亲水性小于Ⅰ。随着温度升高, 两种水凝胶开始收缩脱水,SR越来越小。33 ℃以后,水凝胶Ⅰ的 SR下降的很快,37 ℃左右开始趋于平衡状态;水凝胶Ⅱ的SR下降的相对比较平稳,也是在37 ℃左右开始达到平衡状态。从图4中可以看出,两种水凝胶的 LCST均在33~36 ℃之间,与聚(N-异丙基丙烯酰胺)温敏凝胶的 LCST[13]相差不大,说明半互穿结构对水凝胶的温敏性没有产生影响。
2.1.4 水凝胶的去溶胀动力学

图4 水凝胶不同温度平衡时的溶胀比曲线
如图5所示,水凝胶Ⅰ在最初的10 min内快速失去网络结构中约90%的水分,保水率快速下降,约20 min后达到稳定状态,此时失去约 93%的水;而水凝胶Ⅱ失水更快一些,在 10 min 内失水约95%,约20 min开始趋于稳定状态。当水凝胶处在较高温度(LCST以上)时开始收缩,表面区域的相互作用首先被破坏,并迅速释放结合的水分子。可以看出两种水凝胶对温度响应均很敏感,在短时间内能够对外界温度的变化作出较快的响应,这有利于固定化酶催化反应的控制。可能是由于水凝胶Ⅱ含有的孔洞内径比Ⅰ小,孔洞的量比Ⅰ多,比表面积比较大,水分子能尽快的从凝胶网络中排出来,所以水凝胶Ⅱ的温度响应速率比Ⅰ要稍快一些。
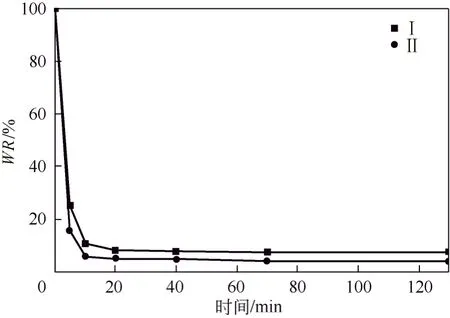
图5 2种水凝胶50 ℃的去溶胀动力学曲线
2.1.5 水凝胶的再溶胀动力学
水凝胶的再溶胀动力学曲线见图 6。与去溶胀相比,水凝胶的再溶胀速率要慢得多。这是由于水凝胶去溶胀时,处于溶胀状态,高分子链的自由度较大;而当干凝胶进行再溶胀时,高分子链间距离较小,疏水作用较强,水分子需要首先破坏这种疏水作用才能使凝胶吸水再溶胀,因而其再溶胀速率要慢得多[12]。水凝胶Ⅰ和Ⅱ在前50 min内吸水量基本呈线性上升,吸水率大致相当;从70 min开始,两种水凝胶吸水率有了变化,水凝胶Ⅰ的吸水率稍大于Ⅱ,并以这种趋势平缓增长,250 min时其吸水率达到92%,此后吸水率趋于稳定。水凝胶Ⅱ的再溶胀曲线走势与Ⅰ大致相同,在250 min时开始趋于稳定状态,但此时水凝胶Ⅱ的吸水率约为88%,稍小于水凝胶Ⅰ。
2.2 水凝胶载体巯基固定化酶性能

图6 水凝胶25 ℃的再溶胀动力学曲线
表2为固定化酶的固载量、活性、活力回收率、稳定性等性能参数。
由表2可知,凝胶Ⅱ固定化酶的固载量为25.50 mg/g,大于凝胶Ⅰ固定化酶的14.60 mg/g。分析可能原因是由于NIPAM/PAEMA水凝胶中α-NH2含量比较高,引入的马来酰亚胺基团也NIPAM/PHEMA凝胶要多,所以通过巯基与马来酰亚胺反应的酶的量也多,因此凝胶Ⅱ固定化酶的固载量相对来说比较大。凝胶Ⅱ固定化酶活力为0.82 U/g,活力回收率可达到 6.03%,比较可观,从稳定性来看,其操作稳定性可达到接近 90%,而热稳定性也可达到80%以上,储存稳定性达90%以上,回收重复利用的价值比较大;凝胶Ⅰ固定化酶的酶活力为0.59 U/g,活力回收率为4.32%,小于凝胶Ⅱ固定化酶,其操作稳定性和热稳定性也不及凝胶Ⅱ固定化酶,但储存稳定性相近。综合来看Ⅰ和Ⅱ固定化酶的活性以及各项稳定性均比相应的A和B要高,可能原因:戊二醛分子之间发生相互的交联反应,影响了固定化的效率;一个酶分子可能通过多点与戊二醛交联,使得酶分子被禁锢在中间,活性大大降低;戊二醛还可以与酶分子上的其他活性官能团发生反应,从而降低酶的活性或使酶失活[14-15]。而马来酰亚胺与巯基的点击反应选择性高,不会与其他活性基团发生反应,而且其反应条件比较温和,不会影响酶的活性,所以得到的固定化酶活性比较大。

表2 固定化酶性能
糖化酶的固载量小于脂肪酶,但由于其游离酶本身活性比较大(需要稀释一定倍数以便测定其活性),所以虽然糖化酶的固载量小,是其活性却较大。与固定化脂肪酶相似,凝胶Ⅱ固定糖化酶的固载量为0.82 mg/g,约是凝胶Ⅰ固定化酶的2倍,其酶活力最大可达12.04 U/mL,此时活力回收率为3.40%,其操作稳定性、热稳定性均在85%以上,具有很高的回收利用价值。凝胶Ⅰ固定化酶的酶活力为10.05 U/mL,活力回收率为2.84%,略小于凝胶Ⅱ固定化酶,但其操作稳定性与其相当,热稳定性也在70%以上,稳定性也比较好。与脂肪酶不同的是,戊二醛固定化糖化酶的固载量虽大,但是活性却不及固载量小的巯基固定化,可能是戊二醛在糖化酶的固定化中,多点固定占据了主要地位,所以虽然固载量大,但酶的活性却降低了。
与常用的戊二醛法固定化酶相比,通过载体中马来酰亚胺与巯基的点击化学反应进行酶的固定化,在相同实验条件下,固定化酶的活性、活力回收率均成倍提高,其中凝胶Ⅱ固定化脂肪酶的活力达0.82 U/mL,活力回收率达6.03%,均为戊二醛固定化酶的5倍左右,酶的稳定性也有较大提高。
3 结 论
制备了两种新型温敏半互穿水凝胶载体Ⅰ和Ⅱ,这两种水凝胶均含有相互贯穿的多孔结构,具有大的比表面积,对温度变化能快速响应,是一种比较理想的固定化酶的载体。利用载体上的马来酰亚胺基团与酶分子上巯基的点击反应进行酶的固定化,具有反应选择性高,反应条件温和,方法易于操作的优点,而戊二醛固定化会发生多点结合、分子内或分子间结合、与其他活性官能团结合等情况使得固定化酶的活性降低。点击反应得到的固定化酶活性最高可达6.03%,是戊二醛固定化酶的5倍,且其稳定性较好,具有很大的回收利用价值。
[1]Kutayama S,Hirokawa,Tanaka T. Reentrant phase transition in acrylamide-derivative copolymer gels[J]. Macromolecules,1984,17:2641-2643.
[2]陈强,朱琳,苏秀颖,等. 聚丙烯酰胺/甲基纤维素半互穿网络的制备及溶胀动力学研究[J]. 科技导报,2011,29(29):38-43.
[3]Shi J,Alves N M,Mano J F. Drug release of pH/temperatureresponsive calcium alginate/poly(N- isopropylacrylamide)semi-IPN beads[J]. Macromol. Biosci.,2006,6(5):358-363.
[4]Guo B L,Gao Q Y. Preparation and properties of a pH/temperatureresponsive carboxymethyl chitosan/poly(N-isopropylacrylamide)semi-IPN hydrogel for oral delivery of drugs[J]. Carbohydr. Res.,2007,3429(16):2416-2422.
[5]梁淑彩,王红,张治民,等. N-取代马来酰亚胺巯基荧光探针的研究进展[J]. 化学通报,2001,64(8):478-482.
[6]Fu Q,Cheng L L,Zhang Y,et al.Preparation and reversible photo-crosslinking/photo-cleavage behavior of 4-methylcoumarin functionalized hyperbranched polyester[J]. Polymer,2008,49:4981-4988.
[7]Berchtold K A,Nie J,Stanbury J W,et al.Reactivity of monovinyl(meth)acrylates containing cyclic carbonates[J]. Macromolecules,2008,41:9035-9043.
[8]Geng J,Mantovani G,Tao L,et al. Site-directed conjugation of“clicked” glycopolymers to form glycoprotein mimics:binding to mammalian lectin and induction of immunological function[J]. J. Am.Chem. Soc.,2007,129:15156-15163.
[9]Agnieszka H D,Jolanta Bryjak,Andrzej W T. Immobilization of glucoamylase and trypsin on crosslinked thermosensitive carriers[J].Enzyme and Microbial Technology ,2007,41:197-204.
[10]李纯清,黎华明,周向东,等. N-对羧基苯基马来酰亚胺的制备与表征[J]. 弹性体,2003,13(5):1-4.
[11]张建涛,黄世文,汪璐玲,等. 快速响应大孔聚(N-异丙基丙烯酰胺-co-丙烯酸)水凝胶的合成及表征[J]. 高等学校化学学报,2004,25(12):2370-2374.
[12]商菊清,黄可龙,刘素琴. 改性淀粉的交联度和红外光谱性质研究[J]. 浙江化工,2003,11(33):33-35.
[13]陈兆伟,陈明清,刘晓亚,等. 温敏性聚(N-异丙基丙烯酰胺)水凝胶的合成与表征[J]. 功能高分子学报,2004,17(1):46-50.
[14]李丽霞. 新型交联高分子载体材料的设计、制备及在催化反应中的应用[D]. 南京:南京理工大学,2013.
[15]李临生,张淑娟. 戊二醛与蛋白质反应的影响因素和反应机理[J].中国皮革,1997,26(12):8-12.
