非光气合成N-取代氨基甲酸酯的研究进展
2014-06-11尚建鹏李作鹏武美霞郭永
尚建鹏,李作鹏,武美霞,郭永
(山西大同大学应用化学研究所,山西 大同 037009)
氨基甲酸酯是一类重要的精细化学品,其结构通式如图1所示。

图1 氨基甲酸酯结构通式
图1中,R为烷基或芳基;R' 为H或烷基、环烷基、芳基等;R'' 为烷基或芳基;n≥2。因其结构中含有活泼的N—H键、羰基、酰基和酯基,该类化合物可用作有机合成中间体,可以与不饱和烃、醛酮、多元醇和芳环等官能团反应,生成各种用途的衍生物,如异氰酸酯、聚氨酯、碳酸二烷基酯、三聚氰胺衍生物以及各种杂环化合物;同时,该类化合物也可用作农药、医药以及合成树脂改性中间体,如抗菌药、抗癌药、杀虫剂、除草剂等。此外,在多肽和组合化学领域,氨基甲酸酯也是一种有效的胺基保护基团和官能团链接剂[1-4],因此,随着氨基甲酸酯应用领域的不断扩大,此类化合物的清洁高效合成得到了广泛的关注。
氨基甲酸酯传统的合成方法主要是以剧毒光气为原料,经醇解和胺解得到氨基甲酸酯[5]。近年来,随着社会的发展,各国对环境保护越来越重视,各国科研机构和化工企业都在积极研究,寻求新的合成方法,以逐渐取缔光气的使用。鉴于以上情况,为了满足氨基甲酸酯类化合物越来越多的需求,解决环境污染问题,采用非光气法生产氨基甲酸酯势在必行。本文就近年来各种非光气合成N-取代氨基甲酸酯的方法进行评述和总结,重点讨论以 CO、碳酸二甲酯(DMC)、CO2、氨基甲酸烷基酯等为羰基化试剂的各种路线,并对其优缺点进行系统评述。
1 CO为羰基化试剂
CO作为一种高效的非光气羰基化试剂,较早应用于N-取代氨基甲酸酯的合成。主要包括硝基类化合物的还原羰化和胺类化合物的氧化羰化。
1.1 硝基类化合物的还原羰化
硝基类化合物的还原羰化是以硝基类化合物和醇为起始原料,以CO为羰基化试剂,在催化剂作用下通过发生还原羰基化反应可有效地合成 N-取代氨基甲酸酯,见图 2。该方法避免了剧毒光气的使用,合成过程简单,副产的CO2对环境相对友好。
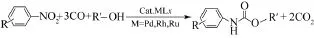
图2 硝基类化合物还原羰化合成N-取代氨基甲酸酯
但是该反应的催化体系以Pd、Pt、Ru、Rh、Ir等贵金属的配合物为主[6-10],活性组分价格昂贵且易流失,催化剂分离回收困难且重复使用性较差;CO的利用率仅为1/3,且存在CO毒性大、与副产的CO2分离困难等问题,这些都限制了其推广和工业化进程。
1.2 胺类化合物的氧化羰化
胺类化合物的氧化羰化法是以胺和醇为起始原料,以一氧化碳为羰基化试剂,在氧气存在下通过在催化剂作用下发生氧化羰化反应,得到N-取代氨基甲酸酯,见图 3。该方法同样避免了剧毒光气的使用,合成过程简单,副产物为无毒无害的水。

图3 胺类化合物氧化羰化合成N-取代氨基甲酸酯
但是该反应的催化体系以Pd、Au、Ru等贵金属的配合物为主[11-16],活性组分价格昂贵且易流失,催化剂分离回收困难且重复使用性较差;该反应需要在高温高压下进行,存在CO与氧气在高温高压下混合发生爆炸的危险,给安全生产带来了巨大的隐患。
2 碳酸二甲酯为羰基化试剂
碳酸二甲酯是近年来发展起来的一种绿色化学品,因其结构中含有羰基、甲基和甲氧基基团,可代替有毒的光气和硫酸二甲酯,实现清洁羰基化、甲基化和甲氧基化等反应过程。近年来,以碳酸二甲酯为羰基化试剂与胺反应合成 N-取代氨基甲酸酯的研究比较多,见图4。
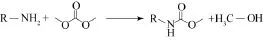
图4 碳酸二甲酯为羰源合成N-取代氨基甲酸酯
为加快反应速度,该反应常需要在催化剂的作用下进行,常用催化剂包括碱催化剂和Lewis酸催化剂等。Romano等[17]以碱金属(Li、Na、K)或碱土金属(Mg、Ca)的醇化物为碱性催化剂,催化碳酸二甲酯与胺反应合成N-取代氨基甲酸酯,胺的转化率最高可达87%。Bosetti等[18]进行了以碱式碳酸锌和碱式碳酸铜为催化剂催化合成苯胺基甲酸酯的研究,其苯胺的转化率为99%,苯氨基甲酸酯的收率为97.5%。Zhao等[19]利用碱催化剂催化苯胺与碳酸二甲酯反应生成苯胺基甲酸甲酯,然后通过甲醛偶联、热裂解得到4,4'-二苯胺基甲烷二异氰酸酯,这是国内以碳酸二甲酯为羰基化试剂非光气合成异氰酸酯的首次全过程合成报道。
Curini等[20]报道以Yb(OTf)3为催化剂时,苯胺基甲酸酯的收率可达 96%。Quaranta等[21]以Sc(OTf)3为催化剂,对脂肪族胺与碳酸二甲酯反应合成N-取代氨基甲酸酯进行了系统研究,其N-取代氨基甲酸酯的分离收率>80%,选择性>99%;原位红外表征发现,η1-O(C=O)配位到Sc(III)可以有效地活化碳酸二甲酯,这个过程不仅活化了羰基氧,同时也活化了烷氧基氧。Richard等[22]以 Ti、Zr、Zn等金属的有机酸或无机酸盐为催化剂时,甲苯二胺、4,4′-二苯基甲烷二胺等的转化率高于 98%,选择性高于90%。Pb(NO3)2也可以作为胺与碳酸二甲酯反应的有效催化剂,当以正己胺为原料时,正己胺基甲酸甲酯的收率接近100%[23]。Deleon等[24]以碳酸二甲酯为羰基化试剂,Bi(NO3)3为催化剂,在70 ℃反应得到 60%~70%的 1,6-己二胺基甲酸甲酯。以上结果表明Lewis酸型化合物也是这类反应的良好催化剂。
此外,酸功能化的离子液体也可作为催化剂应用于此类反应。其中以MIm(CH2)8SO3HTfO为催化剂对1,6-己二胺进行碳酸二甲酯羰化,1,6-己二胺的转化率达 100%,1,6-己二氨基甲酸甲酯的选择性达97%[25]。
以碳酸二甲酯为羰基化试剂,通过与胺反应合成N-取代氨基甲酸酯的路线,其条件温和、原料对环境相对友好,且副产的甲醇可以回收再用于合成碳酸二甲酯,是一种相对绿色的化工生产过程。但在反应过程中碳酸二甲酯用量较大,并且和甲醇容易形成共沸物、不易分离,而且就目前来说,碳酸二甲酯的价格还比较昂贵,也严重阻碍了其大规模工业化的推广和应用。
3 CO2为羰基化试剂
CO2是一类重要而廉价的碳氧资源,同时也是温室气体的主要成分。随着现代社会对石化资源的日益依赖,不断增加的CO2排放问题已经上升到了关乎人类生存与发展的高度。减少以CO2为主的温室气体的排放,已成为国际社会应对气候变化的热点话题。目前,主要的手段是CO2的减排和资源化利用。其中,以CO2作为羰基化试剂合成N-取代氨基甲酸酯是CO2资源化利用中的研究热点,得到广泛关注[26-27],见图5。
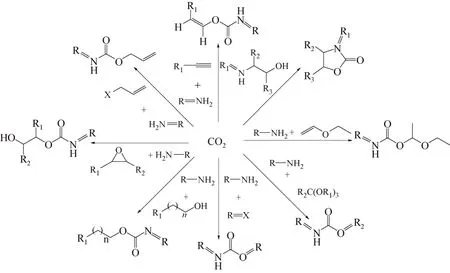
图5 二氧化碳为羰源合成N-取代氨基甲酸酯
以二氧化碳为羰基化试剂,胺类化合物与不饱和醚类化合物[28]、原酸酯[29]及对甲苯磺酸酯[30-31]反应可一步合成N-取代氨基甲酸酯。但是该类反应时间长、收率低,且只局限于脂肪胺。
利用胺、卤代烃和CO2可一步合成N-取代氨基甲酸酯。McGhee等[32]发现,大位阻有机碱的加入可有效地提高氨基甲酸酯的产率和选择性。Salvatore等[33]以 Cs2CO3/四丁基碘化铵为催化剂,CO2为羰基化试剂,n-BuBr为反应原料,成功实现了各类胺羰化合成 N-取代氨基甲酸酯的反应。其中,当以苯胺为反应物时,苯胺基甲酸丁酯的收率可以达到98%。但是该方法使用的催化剂不但结构和组成复杂,来源不便,而且大多价格昂贵;且在反应过程中需要大量的碱来中和反应过程中产生的酸性废物,增加了反应成本。
利用胺、醇和CO2可一步合成N-取代氨基甲酸酯,此反应的副产物只有水,环境相对友好。Sakakura等[34]报道了在锡基配合物催化剂作用下,在CO2压力为30 MPa,200 ℃,反应24 h,由叔丁胺与乙醇、CO2反应制备相应的N-取代氨基甲酸酯,胺的转化率为16%,N-取代氨基甲酸酯的选择性为89%。在同样反应条件下,加入2倍计量比的化学脱水剂缩酮,胺的转化率提高至 100%。Vos等[35]研究了在相对温和的条件下,碱性催化剂催化一系列线性和支链状脂肪族胺合成相应的 N-取代氨基甲酸酯。结果表明,在以 Cs2CO3为催化剂,辛胺、丙醇和CO2反应,在不加任何脱水剂的情况下,胺的转化率为51%,N-取代氨基甲酸酯的选择性为67%,副产物为相应的二辛脲。在进一步加入脱水剂和提高醇胺比的条件下,胺的转化率提高至82%,N-取代氨基甲酸酯选择性提高至84%。最近,Tomishige等[36]研究了在没有任何脱水剂的条件下,在多相催化剂 CeO2的作用下,甲醇、苄胺和 CO2一锅法高效合成了苄胺基甲酸甲酯,苄胺的转化率达到99%,苄胺基甲酸甲酯的收率达到92%;催化剂经600 ℃焙烧3 h后可重复使用,活性几乎没有下降。
利用CO2、胺类化合物与环氧化合物反应可一步合成含羟基官能团的N-取代氨基甲酸酯[37-38],通过调节胺与环氧化合物的结构可合成各种含羟基官能团的N-取代氨基甲酸酯,但是此类反应的选择性较差,环氧化合物很容易被胺开环,生成N-烷基化产物。
在膦配位的钯催化剂作用下,通过向由CO2与胺生成的氨基甲酸铵离子体系中添加烯丙基氯,可生成不同氧取代的N-取代氨基甲酸酯[39]。
利用CO2、胺与炔烃在钌催化剂的作用下,可有效地合成O-烯基取代的N-取代氨基甲酸酯[40-41]。
利用CO2与氨基醇在二丁基氧化锡、磷试剂等催化剂作用下,可有效地合成环状氨基甲酸酯[42]。
上述反应中均涉及氨基甲酸铵离子物种,它是由2 mol胺和1 mol CO2反应制得的,通过向该反应体系中添加不同种类的碱性物种,可增加氨基甲酸铵离子物种的亲和性,从而增加N-取代氨基甲酸酯的收率。如向该体系中添加强质子接受体DBU、冠醚、碱性树脂以及碱金属碳酸盐等,可有效地提高N-取代氨基甲酸酯收率[43-46]。
Inesi等[47]发展了一种新颖的、环境友好的合成N-取代氨基甲酸酯的方法,在CO2饱和的室温离子液体中采用选择性阴极还原法活化CO2与胺、碘乙烷反应合成N-取代氨基甲酸酯。在温和条件下,CO2压力为一个大气压,反应温度 55 ℃,N-取代氨基甲酸酯的收率可达到87%。该过程避免了任何挥发性有毒溶剂的使用,也无需任何支持电极,便于反应的放大。但是此路线副产计量比的卤化氢,后续处理过程复杂。
Kayaki等[48]报道利用超临界 CO2可使该反应容易进行,相应的 N-取代氨基甲酸酯收率大幅提升,但是超临界条件较为苛刻。
最近,Shang等[49]报道了脂肪族二胺与CO2在无催化剂作用下首先合成了一系列聚脲衍生物,然后与碳酸二烷基酯偶合反应高效地制备了一系列脂肪族N-取代二氨基甲酸酯,见图6。
该过程中的聚脲和碳酸二烷基酯都可由CO2合成,因此该过程可间接实现CO2、脂肪族二胺与醇一步合成N-取代二氨基甲酸酯;其副产物只有水,环境相对友好;原子基团的利用率高,符合绿色化学的要求。
总之,利用 CO2为羰基化试剂可实现多种 N-取代氨基甲酸酯的合成,避免使用有毒的光气及CO等,符合当前绿色化学的主题,也为CO2的资源化利用提供了一种有效的途径。但是,鉴于CO2的化学惰性,该方法目标产物的收率较低,因此开发高效的、易回收的催化剂是今后研究的重点。

图6 聚脲与碳酸二烷基酯经岐化反应合成N-取代氨基甲酸酯
4 氨基甲酸烷基酯为羰基化试剂
氨基甲酸烷基酯如氨基甲酸甲酯、氨基甲酸乙酯和氨基甲酸丁酯,可以通过尿素与小分子醇(甲醇、乙醇和丁醇)醇解合成,相比碳酸二甲酯制备过程简单,价格相对较低,不存在与甲醇形成共沸物的问题,从而造成分离困难;比CO毒性小,使用相对安全;比CO2反应活性高,是近年来发展起来的一类高效的羰基化试剂,广泛应用于N-取代氨基甲酸酯的合成。反应过程副产的氨气可以循环用于合成原料尿素,进而合成氨基甲酸烷基酯,可间接实现CO2的优化利用,见图7。因此,探索和研究以氨基甲酸烷基酯为羰基化试剂合成 N-取代氨基甲酸酯的合成工艺及高效催化剂的开发具有非常重要的意义。
利用氨基甲酸烷基酯类化合物为羰基化试剂,通过与胺的反应合成 N-取代氨基甲酸酯类化合物已有报道。其催化体系主要集中在金属氯化物、金属含氧酸盐以及金属氧化物[50-54]。Li等[55]报道了以氨基甲酸甲酯为羰基化试剂合成苯胺基甲酸酯的研究,详细考察了各种金属盐的催化性能,结果发现, ZnCl2具有较好的催化活性。在优化的反应条件下,苯胺的转化率为90.1 %,苯胺基甲酸酯的选择性为99.7 %。同时初步探讨了反应机理,认为第一步是锌正离子对氨基甲酸烷基酯的亲电进攻,然后是有机胺对氨基甲酸烷基酯羰基碳的亲核进攻,也就是发生了苯胺对氨基甲酸烷基酯的直接加成取代反应。

图7 氨基甲酸烷基酯为羰源合成N-取代氨基甲酸酯
Guo等[56]报道了以氨基甲酸烷基酯为羰基化试剂合成 1,6-己二胺基甲酸酯的研究,结果表明在FeCl3的催化作用下,1,6-己二胺转化率为 100%,1,6-己二胺基甲酸酯的收率为 93%,催化剂 FeCl3可循环使用 4次且保持较好的催化活性。利用FT-IR、XRD和XPS对使用前后的催化剂进行研究发现,催化剂在使用后其组成发生一些变化[包括Fe2O3、Fe3O4和Fe(OH)3],但基本不影响其活性,说明这些铁的含氧化合物均对该反应具有较好的催化活性。Zhang等[57]以氨基甲酸丁酯为羰基化试剂,利用Y(NO3)3·6H2O为催化剂,催化合成1,6-己二胺基甲酸丁酯。在180 ℃下反应6 h, 1,6-己二胺的转化率为100%,1,6-己二氨基甲酸丁酯的分离收率为85%。
Han等[58]以 PbO2为催化剂催化氨基甲酸甲酯与 1,6-己二胺合成 1,6-己二胺氨基甲酸甲酯,在优化反应条件下,1,6-己二胺的转化率为 100%,1,6-己二胺氨基甲酸甲酯的收率为93%。但是该催化剂重复使用一次后,1,6-己二胺基甲酸甲酯的收率降低到72%。利用XRD和FT-IR对使用前后的催化剂进行表征,发现催化剂在使用后转变成PbCO3,作者认为这是催化剂重复使用活性降低的原因。
虽然这些催化剂的活性较高,但是这类催化剂易失活、流失严重、重复使用性差,鉴于此亟需发展一种高效的固体催化剂以满足工业生产的需求。
Shang等[59]通过共沉淀法制备了一系列磁性Fe3O4担载Ni的催化剂,结果发现5.1%(质量分数)Ni/Fe3O4催化剂对胺与氨基甲酸烷基酯反应合成相应的N-取代氨基甲酸酯具有很好的催化活性。在优化条件下,成功合成了几种不同的N-取代氨基甲酸酯,其分离收率>90%,催化剂表征结果显示催化活性来源于铁镍物种之间的协同作用产生的特定碱性位。经准原位红外与同位素示踪实验发现,N-取代氨基甲酸酯合成过程经历一个脲衍生物中间体。另外,催化剂可通过外加磁场有效地分离回收,重复使用多次活性没有下降,有望满足工业生产的需要。
5 总结与展望
随着 N-取代氨基甲酸酯类化合物应用领域的不断扩大以及环保意识的不断增强,开发环境友好的、高效的非光气清洁合成N-取代氨基甲酸酯的合成路线成为该领域的研究热点。其中,氨基甲酸烷基酯以其毒性低、活性高、制备简单等优点使其成为合成 N-取代氨基甲酸酯最具工业化应用前景的羰基化试剂;而以CO2为羰基化试剂合成N-取代氨基甲酸酯的路线符合当前绿色化学的主题,为CO2的资源化利用提供了新途径,是今后的研究热点。随着研究工作的不断深入,今后非光气合成N-取代氨基甲酸酯的研究主要集中在:①开发价廉易得、高活性、高选择性、易回收的多相催化体系;②开发相应的反应工艺流程,为日后进行工业化开发奠定坚实基础。
[1]Ray S,Chaturvedi D. Application of organic carbamates in drug design,Part 1:Anticancer agents-recent reports[J]. Drugs Future,2004,29:343-357.
[2]Takaoka K,Tatsu Y,Yumoto N,et al. Synthesis of carbamate type caged derivatives of a novel glutamate transporter blocker[J].Bioorganic and Medicinal Chemistry,2004,12:3687-3694.
[3]Palomo C,Aizpurua J M,Ganboa I,et al. Asymmetric synthesis of γ-lactams through the staudinger reaction and their use as building blocks of natural and nonnatural products[J]. Current Medicinal Chemistry,2004,11:1837-1872.
[4]Greene T W,Wuts P G M. Protective Group in Organic Synthesis[M].4th ed. New York:John Wiley & Sons,2007.
[5]Chaturvedi D,Mishra N,Mishra V. Various approaches for the synthesis of organic carbamates[J]. Current Organic Synthesis,2007,4:308-320.
[6]Gasperini M,Ragaini F,Cenini S,et al. Carbonylation of nitrobenzene to N-methylphenylcarbamate catalyzed by palladiumphenanthroline complexes:Bifunctional activation by anthranilic acid[J]. Journal of Molecular Catalysis A:Chemical,2003,205:107-114.
[7]张俊,夏春谷. 硝基苯还原羰化反应制备氨基甲酸酯选择性的研究[J]. 化学学报,2003,21(3):427-429.
[8]Cenini S,Crotti C,Pizzoti M,et al. Ruthenium carbonyl catalyzed reductive carbonylation of aromatic nitro compounds:A selective route to carbamates[J]. Journal of Organic Chemistry,1988,53:1243-1250.
[9]Skoog S J,Campbell J P,Gladfelter W L. Homogeneous catalytic carbonylation of nitroaromatics:Kinetics and mechanism of the first N—O bond cleavage and structure of the 2-ArNO intermediate[J].Organometallics,1994,13:4137-4139.
[10]Gargulak J D,Gladfelter W L. Homogeneous catalytic carbonylation of nitroaromatics:Kinetic and mechanistic studies of the carbon-nitrogen bond and product forming steps from Ru(Ph2PCH2CH2PPh2)(CO)2[C(O)OCH3]2:The turnover limiting reactions in the catalytic cycle[J]. Journal of the American Chemical Society,1994,116:3792-3800.
[11]Chen B,Chuang S S C. CuCl2and PdCl2catalysts for oxidative carbonylation of aniline with methanol[J]. Journal of Molecular Catalysis A:Chemical,2003,195(1-2):37-45.
[12]Wan B,Liao S,Yu D. Polymer supported palladium-manganese bimetallic catalyst for the oxidative carbonylation of amines to carbamate esters[J]. Applied Catalysis A:General,1999,183(1):81-84.
[13]Shi F,Deng Y. First gold(Ⅰ)complex catalyzed oxidative carbonylation of amines for the syntheses of carbamates[J]. Chemical Communication,2001(5):443-444.
[14]Shi F,Deng Y. Polymer-immobilized gold catalysts for the efficient and clean syntheses of carbamates and symmetric ureas by oxidative carbonylation of aniline and its derivatives[J]. Journal of Catalysis,2002,211:548-551.
[15]Shi F,Zhang Q,Ma Y,et al. From CO oxidation to CO2activation:An unexpected catalytic activity of polymer-supported nanogold[J].Journal of the American Chemical Society,2005,127:4182-4183.
[16]Kim H S,Kim Y J,Lee H,et al. Ionic liquid containing selenium species:Application for the oxidative carbonylation of aniline[J].Angewandte Chemie International Edition,2002,22(41):4300-4303.
[17]Romano U,Fornasari G,Sandro G D. Preparing aromatic urethans:US,4395565[P]. 1983-07-26.
[18]Bosetti A,Cesti P,Cauchi E,et al. Process for the procuction of aromatic urethanes:US,5688988[P]. 1997-11-18.
[19]Zhao X,Wang Y,Wang S,et al. Synthesis of MDI from dimethyl carbonate over solid catalysts[J]. Industrial and Engineering Chemistry Research,2002,41:5139-5142.
[20]Curini M,Epifano F,Maltese F. Carbamate synthesis from amines and dimethyl carbonate under ytterbium triflate catalysis[J].Tetrahedron Letter,2002,43:4895-4897.
[21]Distaso M,Quaranta E. Sc(OTf)3catalyzed carbomethoxylation of aliphatic amines with dimethyl carbonate (DMC):DMC activation by η1—O(C=O)coordination to Sc(Ⅲ)and its relevance to catalysis[J].Journal of Catalysis,2008,253:278-288.
[22]Nicholas D P,Paul N C,Richard S K,et al. Improvements in or relating to friedel-crafts reactions:WO,9919288[P]. 1999-04-22.
[23]Baba T,Fujiwara M,Oosaku A,et al. Catalytic synthesis of N-alkyl carbamates by methoxycarbonylation of alkylamines with dimethyl carbonate using Pb(NO3)2[J]. Applied Catalysis A:General,2002,227:1-6.
[24]Deleon R,Kobayashi A,Yamauchi T,et al. Catalytic methoxycarbonylation of 1,6-hexanediamine with dimethyl carbonate to dimethylhexane-1,6-dicarbamate using Bi(NO3)3[J]. Applied Catalysis A:General,2002,225:43-49.
[25]Zhou H,Shi F,Tian X,et al. Synthesis of carbamates from aliphatic amines and dimethyl carbonate catalyzed by acid functional ionic liquids[J]. Journal of Molecular Catalysis A:Chemical,2007,271:89-92.
[26]Chaturvedi D,Ray S. Versatile use of carbon dioxide in the synthesis of organic carbamates[J]. Current Organic Chemistry,2007,11:987-998.
[27]王晓刚,李立清,唐琳,等. CO2取代光气合成氨基甲酸酯研究进展[J]. 化工进展,2006,25(6):613-618.
[28]Yoshida Y,Inoue S. A direct synthesis of carbamic ester from carbon dioxide,vinyl ether and amine[J]. Chemistry Letters,1977,6:1375-1376.
[29]Ishii S,Nakayama H,Yoshida Y,et al. Novel synthesis of carbamic ester from carbon dioxide,amine,and ortho ester[J]. Bulletin of the Chemical Society of Japan,1989,62:455-458.
[30]Chaturvedi D,Ray S. Triton-B catalyzed,efficient,one-pot,synthesis of carbamate esters from alcoholic tosylates[J]. Monatshefte Fur Chemie,2006,137:459-463.
[31]Chaturvedi D,Ray S. An efficient,one-pot,basic resin catalyzed,novel synthesis of carbamate esters through alcoholic tosylates[J].Organic Chemistry,2005,2:742-744.
[32]McGhee W,Riley D,Christ K,et al. Carbon dioxide as a phosgene replacement:Synthesis and mechanistic studies of urethanes from amines,CO2,and alkyl chlorides[J]. Journal of Organic Chemistry,1995,60(9):2820-2830.
[33]Salvatore R N,Ledger J A,Jung K W. An efficient one-pot synthesis of N-alkyl carbamates from primary amines using Cs2CO3[J].Tetrahedron Letter,2001,42(35):6023-6025.
[34]Abla M,Choi J C,Sakakura T. Halogen-free process for the conversion of carbon dioxide to urethanes by homogeneous catalysis[J]. Chemical Communication,2001(21):2238-2239.
[35]Ion A,Doorslaer C V,Parvulescu V,et al. Green synthesis of carbamates from CO2,amines and alcohols[J]. Green Chemistry,2008,10:111-116.
[36]Honda M,Sonehara S,Yasuda H,et al. Heterogeneous CeO2catalyst for the one-pot synthesis of organic carbamates from amines,CO2and alcohols[J]. Green Chemistry,2011,13:3406-3413.
[37]Yoshida Y,Inoue S. A direct synthesis of monocarbamic ester of 1,2-diol from carbon dioxide,epoxide and amine[J]. Chemistry Letter,1978,7:139-140.
[38]Yoshida Y,Inoue S. Synthesis of carbamic ester by a reaction of carbon dioxide,tetrakis (dimethylamido)titanium(Ⅳ)and epoxide[J].Bulletin of the Chemical Society of Japan,1978,51:559-560.
[39]McGhee W D,Riley D P,Christ M K M. Palladium catalyzed generation of O-allylic urethanes and carbonates from amines/alcohols,carbon dioxide,and allylic chlorides[J].Organometallics,1993,12:1429-1433.
[40]Sasaki Y,Dixneuf P H. A novel catalytic synthesis of vinyl carbamates from carbon dioxide,diethylamine,and alkynes in the presence of Ru3(CO)12[J]. Chemical Communication,1986(10):790-791.
[41]Mahe R,Sasaki Y,Bruneau C,et al. Catalytic synthesis of vinyl carbamates from carbon dioxide and alkynes with ruthenium complexes[J]. Journal of Organic Chemistry,1989,54:1518-1523.
[42]Tominaga K I,Sasaki Y. Synthesis of 2-oxazolidinones from CO2and 1,2-amino alcohols catalyzed by n-Bu2SnO[J]. Synlett,2002(2):307-309.
[43]Hori Y,Nagano Y,Nakao J,et al. Novel organic synthesis using DBU[1,8-diazabicyclo[5.4.0]undec-7-ene](7):Facile synthesis of dialkylcarbonates and carbamates using carbon dioxide[J]. Chemistry Express,1986,1:224-227.
[44]Chaturvedi D,Mishra N,Mishra V. An efficient and novel synthesis of carbamate esters from the coupling of amines,halides,carbon dioxide in the presence of basic resin[J]. Chinese Chemical Letters,2006,17:1309-1312.
[45]Srivastava R,Manju M D,Srinivas D,et al. Phosgene free synthesis of carbamates over zeolite based catalysts[J]. Catalysis Letter,2004,97:41-47.
[46]Salvatore R N,Flander V L,Ha D,et al. Cs2CO3promoted efficient carbonate and carbamate synthesis on solid phase[J]. Organic Letter,2000,2:2797-2800.
[47]Feroci M,Gennaro A,Inesi A,et al. Synthesis of chiral oxazolidin-2-ones by 1,2-amino alcohols,carbon dioxide and electrogenerated acetonitrile anion[J]. Tetrahedron Letter,2002,43:5863-5865.
[48]Kayaki Y,Suzuki T,Ikariya T. Utilization of N,N-dialkyl carbamic acid derived from secondary amines and supercritical carbon dioxide:Stereoselective synthesis of Z alkenyl carbamates with a CO2soluble ruthenium-P(OC2H5)3catalyst[J]. Chemistry:An Asian Journal,2008,3:1865-1870.
[49]Shang J,Liu S,Ma X,et al. A new route of CO2catalytic activation:Syntheses of n-substituted carbamates from dialkyl carbonates and polyureas[J]. Green Chemistry,2012,14:2899-2906.
[50]韩冰,胡庭维,覃显业,等. 1,6-己二氨基甲酸酯合成的研究进展[J]. 化工进展,2013,32(5):1081-1085.
[51]Merger F,Towae F,Harder W. Process for the preparation of an aryl mono-,di-,and/or polyurethane:US,4375000[P]. 1983-02-22.
[52]Merger F,Towae F. Process for the preparation of an aliphatic,cycloaliphatic, and/or aliphatic-cycloaliphatic di-and/or polyurethane:US,4497963[P]. 1985-02-05.
[53]Peter H,Klaus K,Rudolf F,et al. Process for the preparation of N,O-disubstituted urethanes suitable as a starting material for the preparation of isocyanates:US,4388238[P]. 1983-06-14.
[54]Laqua G,Schoner U,Otterbach A,et al. Method of producing organic diurethanes and/or polyurethanes and their use in the production of diand/or polyisocyanates:US,6410778[P]. 2002-06-25.
[55]Li Q,Wang J,Dong W,et al. A phosgene-free process for the synthesis of methyl N-phenyl carbamate by the reaction of aniline with methyl carbamate[J]. Journal of Molecular Catalysis A:Chemical,2004,212:99-105.
[56]Guo X,Shang J,Ma X,et al. Synthesis of dialkyl hexamethylene-1,6-dicarbamate from 1,6-hexamethylenediamine and alkyl carbamate over FeCl3as catalyst[J]. Catalysis Communication,2009,10:1248-1251.
[57]Zhang H,Guo X,Zhang Q,et al. Synthesis of dialkyl hexamethylenedicarbamate from 1,6-hexamethylenediamine and alkyl carbamate over Y(NO3)3·6H2O catalyst[J]. Journal of Molecular Catalysis A:Chemical,2008,396:36-41.
[58]Han B,Zhao W,Qin X,et al. Synthesis of dimethyl hexane-1,6-diyldicarbamate from 1,6-hexamethylenediamine and methyl carbamate using lead dioxide as catalyst[J]. Catalysis Communications,2013,33:38-41.
[59]Shang J,Guo X,Deng Y,et al. N-substituted carbamates syntheses with alkyl carbamates as carbonyl source over Ni-promoted Fe3O4catalyst[J]. Journal of Catalysis,2011,279:328-336.
