木质纤维素糖平台基质组成结构的分析表征技术研究进展
2014-06-11孙付保王亮谭玲曹钰刘健权张震宇
孙付保,王亮,2,谭玲,2,曹钰,刘健权,张震宇
(1江南大学生物工程学院,工业生物技术教育部重点实验室和糖化学与生物技术教育部重点实验室,江苏无锡 214122;2华南理工大学制浆造纸工程国家重点实验室,广东 广州 510640)
在当今社会,以可再生生物质资源作为原料,利用生物炼制技术大规模生产生物能源和生物基产品(生物燃料、生物基化学品和生物基材料)已成为国际上的研究热点,以生物质资源为基本原料的生物炼制已渐渐凸显其优势,一个全球性的产业革命正在朝着以碳水化合物为基础的经济时代发展[1-2]。然而,真正的生物质经济时代尚未到来,由于木质纤维素复杂的理化组成和多级结构的致密不均一性,致使当前在推进纤维质生物炼制工业化过程中仍面临一系列问题[3-4],如Wyman等在分析生物炼制纤维素乙醇时认为,纤维素乙醇的过程成本占到总成本的67%,其中原料预处理的成本最高,其次是酶生产和酶水解过程[5-7]。因此,探索简单经济、安全高效和环境友好的木质纤维素新型预处理过程仍然是当前和今后一段时期值得关注的重点研究方向[8-10]。
在生物质原料方面,适合于生物炼制的原料来源不是单一的,它涉及许多纤维质废弃物,这些不同种属的原料不仅在纤维素、半纤维素和木质素三大组成含量不同,而且在每种组分内部及组分之间连接结合结构上也有很大的差异。在生物质预处理方面,目前已经涌现了很多技术[11-15],这些预处理技术从不同方面破坏木质纤维素的致密结构。而不同种属生物质原料经不同方法预处理后的差异性就更大。因而,有必要采用现代分析手段从组织细胞、微观和纳米分子等水平上,多尺度全方位地对木质纤维素原料在预处理前、预处理后、酶解前和酶解后等各个阶段进行深入系统的分析表征,不仅有助于了解不同来源(种属和预处理)纤维基质的差异性,而且有益于理解预处理机制和优化预处理工艺,同时对后续纤维素酶选择、酶解工艺优化和酶解机理都有指导意义。
在木质纤维素基质分析表征方面,目前针对木质纤维素组成结构进行分析表征的方法很多,如:纤维素表面质地结构的光学显微镜、电子显微镜(扫描和透射)和原子力显微镜观察,化学结构里关键性化学键和官能团的(近)红外光谱法和拉曼光谱分析,晶体特征的X射线衍射(XRD)和核磁共振(NMR)检测等。这些分析表征方法不同程度地探究了纤维素的微观纳米结构、功能性化学基团和结晶结构,因此分别从某个方面表征了木质纤维素基质复杂的组成和多级不均一结构特点,反映了种属和预处理后导致的纤维质差异,这对了解预处理机制和纤维质酶解机制以及优化生物质相关的预处理/酶解工艺都具有一定的指导意义。
基于此,本文着眼于目前现代仪器分析技术,尤其电子扫描显微镜(scanning electron microscope,SEM)、红外光谱(infrared spectroscopy,IR)、X-射线衍射(X-ray diffraction,XRD)和核磁共振(nuclear magnetic resonance,NMR)应用于木质纤维素原料组成结构分析表征方面的研究进展,分析讨论了这些方法在研究木质纤维素多糖组成结构方面的共性特征,并对个别技术应用过程中存在问题和不足进行了分析,最后总结出这些大型仪器分析方法应用于木质纤维素组成结构研究获得的一些结论,并在此基础上对未来木质纤维素基质的分析表征方法进行了展望。
1 木质纤维素基质的SEM观察
目前,扫描电子显微镜已成为木质纤维素基质表面结构特征显微观察的重要技术手段。本文作者[16]用常压甘油自催化预处理法处理小麦秸秆时利用 SEM 观察发现,经甘油处理后,原麦草整的齐致密结构撕裂成单个或者体积较小的纤维束,纤维束松散细小,表面变得粗糙,呈现一系列不规则的微孔洞或裂痕(如图 1)。这些结构变化增加了纤维比表面积,增加了纤维素与酶的接触面积,增加了酶的接触位点及酶载荷量,从而有助于提高酶解效率。
同时,SEM方法还可用于木质纤维素原料不同预处理效果的比较。本文作者[17]也利用 SEM 比较了麦草的常压甘油自催化预处理和汽爆预处理方法,发现:常压甘油和汽爆两种自催化预处理方法均打破了木质纤维类生物质复杂致密的理化结构,在减小纤维的平均尺寸和增加纤维表面积的同时,也提高了纤维的粗糙度;与汽爆相比,常压甘油水溶液预处理导致纤维束更松散,更细小,有着更多的粗糙度和比表面积(如图2所示)。这些SEM观察表明,各种预处理方法均影响了木质纤维素基质的表面结构,但同一种预处理方法不但在不同预处理条件下对同一种木质纤维素的预处理效果不同,同一种预处理方法在相同预处理条件下对不同种属纤维质原料预处理效果也不同,而且不同预处理方法即使在相同预处理条件下对同一种原料的处理效果不一样,不同预处理方法在不同条件下处理不同基质效果差异就更大。因此,不同种属木质纤维素原料、不同预处理方法和不同预处理条件下获得纤维基质的组成结构差异很大。

图1 常压甘油水溶液预处理麦草纤维表面的超微结构观察[16]

图2 汽爆和常压甘油自催化预处理麦草表面结构的观察[17]
另外,通过扫描电子显微镜还观察到木质素粒子再缩合或木质素-碳水化合物复合体(Lignincarbohydrate complex,LCC)沉积在纤维表面的现象(图3、图4)。作者早期研究[18]中对常压甘油自催化预处理麦草纤维表面的微观观察发现,纤维基质表面存在着一些细小斑点[图 3(a)],通过进一步放大倍数[图 3(b)、(c)]发现这些小斑点通常是由一些大小直径约为0.1~0.2 μm的颗粒和/或一个长约0.2~0.4 μm的长条结块构成。因此,具有超微分子结构的木质素缩合物和/或LCC可能由球形颗粒和/或块状物两部分构成:球形颗粒为预处理过程中产生的木质素碎片通过再缩合而形成的木质素粒子,块状物质是包括半纤维素和纤维素及其降解物在内的碳水化合物。
总之,利用 SEM 只是对木质纤维素基质表面结构分析,获得的信息和结果仍旧有限,仍需要借助其他理化分析手段才能进一步获得准确信息。
2 木质纤维素基质的IR技术

图3 甘油预处理麦草纤维表面的木质素-碳水化合物复合体(LCC)结构[11]

图4 汽爆玉米芯酶解前和酶解后被纯化的木质素-多糖复合体结构[18]

表1 木质纤维素基质中关键性化学键或基团特征对应的红外光谱波数
红外光谱已成为分析木质纤维素组成结构和化学变化的常用方法,表1总结出木质纤维素基质中关键性化学键和官能团对应的波谱。通过对各种木质纤维素预处理前后的化学基团分析表征,定性确定木质纤维素原料在预处理过程中的组成结构变化情况,以期更好地了解预处理方法对原料的作用机制和后续酶解的影响。Kim等[19]用FT-IR分析了氨水预处理玉米秸秆组成结构的化学变化,发现玉米秸秆含有愈创木基和紫丁香基两种类型木质素,特征吸收峰分别在1218 cm−1、1268 cm−1(愈创木环C—O)、1315 cm−1(紫丁香环 C—O)和 1502~1600 cm−1(芳香骨架振动);氨循环渗漏(ammonia recycle percolation,ARP)处理后玉米秸秆样品所有木质素吸收峰(1502~1600 cm−1)强度均比处理前明显减弱,显示了ARP预处理的木质素脱除效果。这方面研究表明,IR技术可用初步判断预处理对木质纤维素基质化学组成的影响,如半纤维素和木质素脱除、纤维素/半纤维素分子内和分子间氢键结合、纤维素结晶度和非结晶度比例等。
同时,IR方法还可用于不同方法预处理纤维基质特征的比较。本文作者[17]先前对汽爆和常压甘油自催化预处理麦草前后红外分析表明(图5),预处理前后基质在1049 cm−1处由于多聚糖(纤维素和半纤维素)中C—O—C伸展引起一个强烈的窄峰;1425 cm−1是由 C—H和 O—H弯曲造成的,1382 cm−1来源于CH2和OH弯曲,在异头区(950~700 cm−1)的899 cm−1处小尖峰代表着多聚糖中β-葡聚糖苷键;与原麦草纤维相比,两种预处理麦草纤维中在1159 cm−1和1107 cm−1处分别来源于C—O反对称桥伸展和 C—OH骨架振动的特征峰都明显增加,原麦草纤维在1735 cm−1处的酯键(C=O)峰经汽爆预处理后明显减弱,经常压甘油水溶液自催化预处理后几乎消失了;这些信息表明,在汽爆和常压甘油自催化预处理麦草的纤维中,连接多糖和木质素之间的阿魏酸、对羟基苯甲酸和对羟基肉桂酸等关键性酯键都被打断,而且常压甘油自催化预处理技术比汽爆技术更有效,能断裂更多木质素和多糖之间的关键性酯键。另一方面,在 1510 cm−1和1457 cm−1处的吸收波谱,分别代表着木质素组分和芳香环的伸展,原麦草经温和汽爆处理在此处的吸收加强而经常压甘油水溶液自催化预处理吸收峰弱化成峰肩;这表明,汽爆自催化预处理后的麦草中仍然存有着残渣木质素,而且木质素含量在汽爆麦草的相对含量高于在原麦草中的含量;而常压甘油水溶液自催化预处理麦草纤维中的残渣木质素含量已很少,相对含量比汽爆麦草中的残渣木质素含量要低得多;IR分析表明,常压甘油水溶液自催化预处理策略在脱出木质素方面比汽爆预处理更有效。
以上研究结果表明:①FT-IR方法用于分析表征木质纤维素基质组成结构的化学变化时,尽管有种属和预处理方法不同,但通常有相对固定的谱带归属(如表1所示);②FT-IR能定性显示出各种方法预处理后木质纤维素组成结构变化信息,如乙酰基脱除、半纤维素/木质素链接酯键/醚键断裂、纤维素分子内/间氢键断裂等,能初步判断半纤维素和木质素脱除状况;③粗略提供纤维素分子结晶度与非结晶度比例关系,以及晶型比例等信息;④提供木质纤维素中残存木质素类型的信息。这些信息为评价各种预处理方法对不同种属木质素预处理效果提供了有益帮助,也为初步判断木质纤维素后续酶解可消化性提供了帮助。然而,既然木质纤维素可消化性与许多因素有关,因此仍需要其他分析手段继续加深对木质纤维素基质特征进行分析。
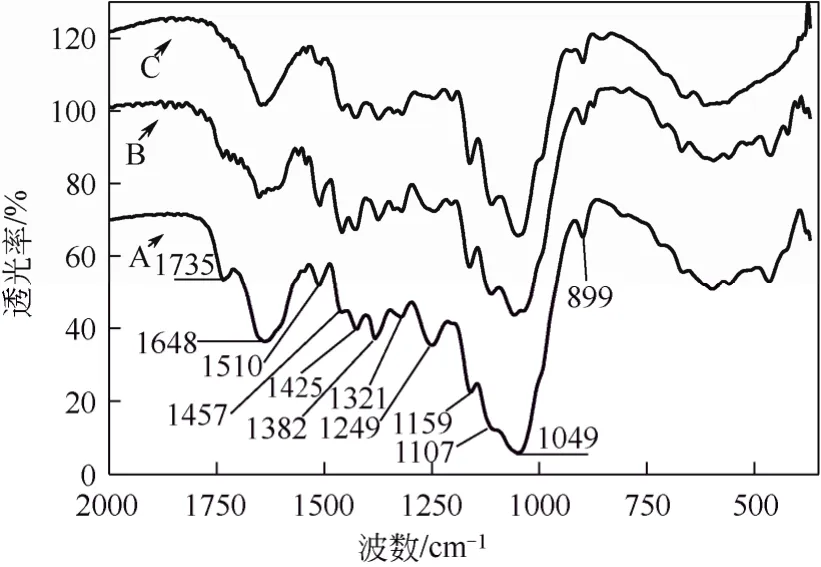
图5 常压甘油和汽爆自催化预处理前后麦草纤维的红外光谱分析[17]
3 木质纤维素基质结晶结构的 XRD分析
X射线衍射(XRD)已经广泛用于分析表征不同方法预处理的各种木质纤维素结晶度和晶体结构的变化情况。Kim等[20]利用XRD分析了石灰水预处理玉米秸的结构特征,发现石灰水处理后秸秆纤维结晶度提高可能是由于木质素/半纤维素等非结晶组分脱除而导致的。同样,Kim 等[19]通过 XRD对ARP预处理玉米秸进行了分析,预处理后纤维结晶度指数明显增加,认为但该预处理并未打破纤维素分子内/间氢键,而是由于脱除其中木质素和半纤维素等非结晶成分而纤维素相对增加所导致的。总之,研究表明,目前大多数预处理,如稀酸、稀/弱碱(石灰水、ARP)和微波等并不能作用于木质纤维素的纤维素结晶区,而是通过作用于木质纤维素非结晶区,通过脱除木质素或/和半纤维素等导致木质纤维素结晶度相对增加。
然而,Wang等[21]利用XRD对离子液AmimCl从松木溶解提取纤维素进行了分析发现,处理前松木纤维素为天然的Ⅰ型(在2θ的15°和22°出各有一个显著峰),经离子液溶解再生出的纤维素只在2θ的25°附近有个稍宽衍射峰,表明溶解再生产品为纤维素Ⅱ型;而且发现该离子液预处理破坏了基质中纤维素的分子间/内氢键,使纤维结晶度明显降低。Uju等[22]最近用XRD详细分析了两种离子液([Bmpy][Cl]/[Emim][OAc])预处理木质纤维素原料(甘蔗渣和桉树)结晶度特征,发现以下几点。①预处理甘蔗渣和桉树纤维素都具有高结晶度,属于纤维素Ⅰ型(天然纤维素),但桉树纤维中含有比甘蔗渣更多的晶体结构。②离子液[Emim][OAc]处理后2种基质中代表纤维素结晶度的峰消失或减弱,[Bmpy][Cl]处理后除结晶纤维素原峰消失或减弱外,在12°出现一个纤维素Ⅱ型特征的弱峰,这些衍射方式表明经过2种离子液预处理后基质纤维素转化为无定形和纤维素Ⅱ型,其中[Bmpy][Cl]处理后基质纤维素主要以纤维素Ⅱ型状态存在。③进一步计算结晶度指数显示,[Emim][OAc]预处理使桉树纤维素结晶度指数从45%减少至21%,使甘蔗渣从42%降至30%,[Bmpy][Cl]预处理使基质纤维素结晶度指数减少不明显,分别使桉树和甘蔗渣纤维素结晶度指数降低至39%和37%,可能是由于该预处理方法主要使晶体纤维素从Ⅰ型转化为Ⅱ型,而不是无定形状态。④即使[Bmpy][Cl]预处理基质具有高的纤维素结晶度指数,后续酶解发现这些基质比[Emim][OAc]预处理基质更衣水解产糖,初步分析可能是该预处理降低了纤维素聚合度,而纤维素分子短链在纤维素再生过程中转化为符合热动力学的纤维素Ⅱ型。⑤结合酶解糖化,[Bmpy][Cl]预处理更适合用于提高木质纤维素可酶解性。
尽管纯纤维素结晶度和可消化性密切相关,但对于木质纤维素却很难测其真实的纤维素结晶度,所以常用 XRD测定包括无定形纤维素、半纤维素和木质素等非结晶物质在内整个基质的结晶度。因此,木质纤维素预处理后结晶度大小和可消化性并没有直接对应关系,利用 XRD分析木质纤维素基质结晶度(结晶度指数)变化不能反映基质的可酶解性,对后续酶水解无明显指导意义,但它测得纤维素Ⅱ型的晶体尺寸指标可能对评估木质纤维素可酶解性具有参考价值[12,16]。
4 木质纤维素的13C NMR结构解析
除XRD外,NMR是研究木质纤维素基质里纤维素晶体结构特征最合适的分析手段之一。由于13C NMR对于纤维素分子内部排列更灵敏,所以它测出的结晶度指数与 XRD会有所不同,它测得的结晶度指数能更准确地反映纤维素晶体实际排列[23]。纤维素NMR光谱中最有意义区域是一个分布于80~92的C4信号簇,其中有序86~92区域属于晶体Ⅰ型(α,β)纤维素和次晶纤维素;无序80~86区域较宽,属于无定形纤维素、纤维束表面的结晶纤维素和/或半纤维素。Wang等[21]利用13C NMR分析研究了离子液体处理前后松树纤维质结构变化,发现原松树包括所有纤维素和木质素的特征吸收峰,但离子液体预处理后结晶纤维素在C4(89)和C6(62)的特征吸收峰消失,仅剩下无定形纤维素在C4(84)和C6(62)的特征吸收峰,证明原松树复杂致密的结晶结构完全转变为无定形结构;再生纤维素光谱仅剩下纤维素和半纤维素吸收峰,没有木质素吸收峰;松树残渣的光谱具有更高分辨率和木质素特征吸收峰(133、125和113),3个木质素吸收峰重叠在一起并且形成了更广阔的吸收峰。该分析证明了离子液体预处理不仅能破坏木质纤维素中结晶纤维素的结合氢键,并且还作用于木质素芳香环并使其溶解。Zhang等[23]利用13C NMR研究了不同预处理前后甜高粱晶体结构变化,结合水解结果,他们发现离子液和石灰水处理使基质纤维素结晶度减小,而稀酸和汽爆处理会使结晶度增加;离子液预处理会导致纤维素发生转型,基质纤维素结晶度从天然Ⅰ型(α,β)转变为其他类型可能是导致水解增加的重要因素;尽管结晶度指数降低和水解率提高有些关系,但结晶度指数的下降程度和纤维素水解产糖增加没有必然联系,结晶度指数并不是影响酶水解的主要因素;汽爆预处理由于使基质中无定形纤维素和易水解的细微表面纤维素增加,使酶解同时发生在纤维素结晶区和非结晶区,从而增加了基质的可消化性。即使对纯纤维素来说,仅仅结晶度指标也不能用来评估其可水解性。此外,与原纤维素相比,再生纤维素光谱没有出现新信号,显示离子液处理过程中没有发生化学反应,这和FT-IR分析结果也是一致的。最近Husson等[24]在研究中发现,离子液体处理α纤维素后使纤维素结晶度指数从 25%下降到不到 5%,但预处理前后水解葡萄糖产量并没有明显变化;离子液[Emim]+[CH3COO]−预处理使较长纤维素结晶度指数无明显变化,[Emim]+[MeO(H)PO2]−预处理使结晶度指数稍有下降(73%→58%),但后者却使纤维素水解产糖量提高近3倍。该结果再次证明,酶水解效率和结晶度指数没有必然的相关性,其他因素如纤维素晶型、结晶度和表面结构(比表面积和粗糙度等)应该对酶解也有较大影响。
比较XRD和NMR对木质纤维素基质组成结构分析结果,发现这两种方法都是基于整个基质进行的纤维素结晶度、结构和晶体尺寸分析,因而在C4区域会发生半纤维素和纤维素吸收峰相重叠从而影响结晶结构测定的现象。因此,若基质中半纤维素含量较高,就会使NMR分析的结晶度指数偏高而与实际不符,这就需要其他分析方法作为补充。
5 纤维基质分析表征的新型技术
除上文所述常见的SEM表面观察、FT-IR化学结构分析、XRD晶体结构分析和化学结构13C-NMR解析外,新近也出现一些新型分析表征方法,如高速原子力显微镜(atomic force microscopy,AFM)、原位原子显微镜(in-situ AFM)、多尺度显谱(multi-scale visualization)和实时相关成像(correlative imagining in real time)技术等。
Igarashi等[25]利用高速AFM实时观察单个纤维素酶组分(CBHⅠ,CBH Ⅱ)降解结晶纤维素的过程。实验发现以下几点。①CBH Ⅰ(TrCel7A)分子在结晶纤维素表面单向滑行,在某一时刻会类似于交通堵塞一样集体停下来,停留片刻后又继续前进,至于什么原因导致他们会中断停下来,初步推断可能是由于结晶纤维素表面的粗糙不光滑导致纤维素酶蛋白分子交通阻塞。②采用超临界氨法处理结晶纤维素,发现结晶纤维素由晶型 Ⅰ 转变成ⅢI,该处理能明显增加结晶纤维素表面的可用滑道数以及滑动纤维素酶数目,这是因为结晶纤维素ⅢI表面有更多纤维素酶蛋白分子相作用的结合位点。③CBH Ⅱ(TrCel6A)单独提前处理或与 CBH Ⅰ(TrCel7A)同时水解结晶纤维素ⅢI都会导致纤维素表面滑动酶分子数的显著增加。因此,通过理化预处理或其他酶协同作用改进结晶纤维素表面结构状态,如修平表面、脱除障碍物、增加滑道数和进出口数等,将有助于改进酶蛋白分子的滑动状态,避免阻塞中断,最终实现基质高效降解。可见,好的预处理技术应该将会增加结晶纤维素表面的纤维素酶分子结合位点,增加纤维素酶分子可用滑道数,最终有助于晶体纤维素高效水解。
Ganner等[26]利用in-situ AFM生动呈现了纤维素酶内切β-葡聚糖苷酶(EG)和外切β-葡聚糖苷酶(CBH Ⅰ和Ⅱ)单独/协同水解纤维素基质的结构动态变化过程。通过观察发现,纤维素由无定形区和结晶区组成,其中结晶区还可分为细小的纳米结晶纤维(宽度≤15 nm,长度100~300 nm)和大的微晶(100~10 μm),纳米结晶纤维因末端纤维素酶结合位点相对容易暴露出来而更容易水解,甚至比无定形区域降解还快;纤维素内/外切酶在协同水解时分工非常明确,EG和CBH Ⅱ通过脱除基质中无序的无定形区域,从而使镶嵌于纤维素中有序的纳米晶体纤维暴露出来,然后这些纳米纤维被CBHⅠ有效降解而形成为新的无定形区域;分析认为纤维素酶协同作用是基质形态依赖型的,该协同作用是由分别降解无定形区和结晶区的酶之间相协作来实现的,晶体尺寸和形状是决定晶体纤维素可水解性和水解效率的重要因素。
Chundawat等[27]利用多尺度显谱(multi-scale visualization),包括激光扫描共聚焦显微镜(laser scanning confocal fluorescence microscopy,LSCM)、拉曼光谱、AFM、SEM、TEM、NMR和化学分析电子光谱学(electron spectroscopy for chemical analysis,ESCA)等,通过成像表征氨爆预处理(AFEX)前后玉米秸细胞壁细微的形态和理化性质变化,以期阐明该预处理方法在不从基质上脱除木质素和半纤维素情况下促进基质水解的机制。研究发现:AFEX首先从细胞壁部分溶解提取一部分分解产物(如氨基化合物、阿拉伯糖基寡木聚糖和木质基酚类化合物),但随着氨气蒸发遗失,这些物质又重新沉淀在外部细胞壁表面,导致细胞壁内部形成了像隧道一样的纳米多孔网络;这些纳米多孔的形状、尺寸(10~1000 nm)和空间分布决定于内在的细胞壁部位和外在的预处理条件,氨爆玉米秸单位体积上孔径表面积范围在 0.005~0.05 nm2/nm3;氨爆预处理主要是通过断裂木质素-碳水化合物酯键、部分溶解和移位细胞壁提取物到细胞壁表面,而作用于细胞壁胞间层和外部次级细胞壁部位,使细胞壁形成相互贯通如隧道状的多孔网络结构,这大大增加了基质的纤维素酶可及性。该研究显示,为了促进木质纤维素基质高效水解产糖,细胞壁充分分解并不是评价和选择预处理必须的标准。
Ding等[28]利用新型的实时相关成像技术,包括:亮视野光学显微镜、共焦激光扫描显微镜、双色受激拉曼散射显微镜和原子力显微镜,察看了从毫米到纳米级玉米秸秆细胞壁结构及其被纤维素酶水解的变化过程,评估了化学预处理后细胞壁结构在纳米水平的变化及其对后续微生物酶降解的影响,得到以下结论。①真菌纤维素酶(cellulose)是相对较小的多酶混合物(mixture),细菌纤维素酶(cellulosome)是个体较大的多酶复合体(multi-enzyme complex)。②两种纤维素酶消化植物细胞壁机制明显不同,细菌纤维素酶主要作用于细胞壁表面,从细胞壁表面逐步剥离下单个微纤维束,而真菌纤维素酶除作用于表面外,还能穿过细胞壁表面孔洞或裂缝进入细胞壁内部的微纤维束网络,水解周边成空洞或凹陷深坑,所以真菌纤维素酶水解效率比细菌纤维素酶要高(约5倍)。③纤维素分子疏水面是微生物酶易于结合的关键区域,在初级细胞壁中疏水面是外露的,但在次级细胞壁中是被木质素屏蔽的(薄壁细胞中部分屏蔽,厚壁纤维细胞中全部屏蔽),所以强化纤维素酶与纤维素疏水表面区域的接触将是实现木质纤维素高效降解的有效方式。④通过温和预处理脱除木质素发现,实验中几乎不存在木质素的无效吸附现象,木质素含量与细胞壁的纤维素酶接触结合具有很好的负相关性,这说明木质素的物理障碍是阻碍木质纤维素水解的关键。⑤理想的预处理方法应该是温和的,只是从细胞壁中脱除木质素;在尽量脱除木质素同时,不使纤维素和半纤维素损失,也不使它们的天然质地构造发生变化,尽可能保持天然纤维相对松散、多孔原生状的质地结构。可见,深入理解植物细胞壁化学或酶溶解机制,对于纤维素类生物质高效转化为生物燃料是非常关键的。
6 问题与展望
针对当前仪器设备应用于木质纤维素基质组成结构分析表征领域的研究进展以及存在的问题,对新型分析表征技术在木质纤维素预处理和酶水解阶段的运用提出了如下展望。
由于适合生物炼制的原料的多样性以及目前预处理方法的多样性,导致了分析检测问题的复杂性。单一的分析表征技术不能满足检测的需求。同种生物质原料经过不同的预处理方法处理后,当前的分析技术可能检测出不同甚至相反的结果;同样,针对不同的生物质原料,单一的分析检测技术可以得出不同的检测结果。基于此,针对当前分析表征技术存在的问题,作者认为研究者应结合多种分析表征技术判定预处理以及酶解效果。此外,可以采用新型分析表征技术动态观察预处理以及酶解阶段基质的动态变化情况,更容易理解预处理及酶解机制。
[1]余强,庄新姝,袁振宏,等. 木质纤维素类生物质制取燃料及化学品的研究进展[J]. 化工进展,2012,31(4):784-791.
[2]许庆利,蓝平,隋淼,等. 木质纤维素水解制取燃料乙醇研究进展[J]. 化工进展,2009,28(11):1906-1912.
[3]李江,谢天文,刘晓风. 木质纤维素生产燃料乙醇的糖化发酵工艺研究进展[J]. 化工进展,2011,30(2):284-291.
[4]Himmel M E,Ding S-Y,Johnson D K,et al. Biomass recalcitrance:Engineering plants and enzymes for biofuels production[J]. Science,2007,315(5813):804-807.
[5]Wyman C E. What is(and is not)vital to advancing cellulosic ethanol[J]. TRENDS in Biotechnology,2007,25(4):153-157.
[6]余强,庄新姝,袁振宏,等. 木质纤维素类生物质高温液态水预处理技术[J]. 化工进展,2010,29(11):2177-2182.
[7]Wyman C E,Dale B E,Elander R T,et al. Coordinated development of leading biomass pretreatment technologies[J].Bioresour. Technol.,2005,96(18):1959-1966.
[8]李志强,江泽慧,费本华. 竹材制取生物乙醇原料预处理技术研究进展[J]. 化工进展,2012,31(3):533-540.
[9]Cao W-X,Sun C,Liu R-H,et al. Comparison of the effects of five pretreatment methods on enhancing the enzymatic digestibility and ethanol production from sweet sorghum bagasse[J]. Bioresour.Technol.,2012,111:215-221.
[10]Galbe M,Zacchi G. Pretreatment:The key to efficient utilization of lignocellulosic materials[J]. SciVerse Science Direct,2012,46:70-78.
[11]Cantu L P,Schreiber A. Comparison of pretreatment methods for rye straw in the second generation biorefinery:Effect on cellulose,hemicellulose and lignin recovery[J]. Bioresour. Technol.,2013,142:428-435.
[12]Yang M,Kuittinen S,Zhang J-H,et al. Effect of dilute acid pretreatment on the conversion of barley straw with grains to fermentable sugars[J]. Bioresour. Technol.,2013,146:444-450.
[13]Jung Y-H,Kim I J,Kim H K,et al. Dilute acid pretreatment of lignocellulose for whole slurry ethanol Fermentation[J]. Bioresour.Technol.,2013,132:109-114.
[14]Gao J,Chen L,Yuan H,et al. Ionic liquid pretreatment to enhance the anaerobic digestion of lignocellulosic biomass[J]. Bioresour.Technol.,2013,150:352-358.
[15]Qiu Z-H,Aita G M. Pretreatment of energy cane bagasse with recycled ionic liquid for enzymatic hydrolysis[J]. Bioresour.Technol.,2013,129:532-537.
[16]Sun F-B,Chen H-Z. Enhanced enzymatic hydrolysis of wheat straw by aqueous glycerol pretreatment[J]. Bioresour. Technol.,2008,99(14):6156-6161.
[17]Sun F-B,Chen H-Z. Comparison of atmospheric aqueous glycerol and steam explosion pretreatments of wheat straw for enhanced enzymatic hydrolysis[J]. Journal of Chemical Technology and Biotechnology,2008,83(5):707-714.
[18]Sun F-B,Chen H-Z. Organosolv pretreatment by crude glycerol from oleochemicals industry for enzymatic hydrolysis of wheat straw[J]. Bioresour. Technol.,2008,99(13):5474-5479.
[19]Kim T H,Kim J S,Sunwoo C,et al. Pretreatment of corn stover by aqueous ammonia[J]. Bioresour. Technol.,2003,90(1):39-47.
[20]Kim S,Holtzapple M T. Lime pretreatment and enzymatic hydrolysis of corn stover[J]. Bioresour. Technol.,2005,96(18):1994-2006.
[21]Wang X-J,Li H-Q,Cao Y,et al. Cellulose extraction from wood chip in an ionic liquid 1-allyl-3-methylimidazolium chloride(AmimCl)[J]. Bioresour. Technol.,2011,102(17):7959-7965.
[22]Uju,Shoda Y,Nakamoto A,et al. Short time ionic liquids pretreatment on lignocellulosic biomass to enhance enzymatic saccharification[J]. Bioresour. Technol.,2012,103(1):446-452.
[23]Zhang J-Z,Ma X-X,Yu J-L,et al. The effects of four different pretreatments on enzymatic hydrolysis of sweet sorghum bagasse[J].Bioresour. Technol.,2011,102(6):4585-4589.
[24]Husson E,Buchoux S,Avondo C,et al. Enzymatic hydrolysis of ionic liquid-pretreated celluloses:Contribution of CP-MAS 13C NMR and SEM[J]. Bioresour. Technol.,2011,102(15):7335-7342.
[25]Igarashi K,Uchihashi T,Koivula A,et al. Traffic jams reduce hydrolytic efficiency of cellulase on cellulose surface[J]. Science,2011,333(6047):1279-1282.
[26]Ganner T,Bubner P,Eibinger M,et al. Dissecting and reconstructing synergism:In situ visualization of cooperativity among cellulases[J]. Journal of Biological Chemistry,2012,287(52):43215-43222.
[27]Chundawat S P,Donohoe B S,da Costa Sousa L,et al.Multi-scale visualization and characterization of lignocellulosic plant cell wall deconstruction during thermochemical pretreatment[J].Energy & Environmental Science,2011,4(3):973-984.
[28]Ding S-Y,Liu Y-S,Zeng Y,et al. How does plant cell wall nanoscale architecture correlate with enzymatic digestibility[J].Science,2012,338(6110):1055-1060.
