基于QPCR快速检测米饭中产呕吐毒素蜡样芽孢杆菌的研究
2014-06-11张志鸿王力均刘成伟许恒毅
张志鸿 王力均 甘 蓓 刘成伟 许恒毅 魏 华,
(南昌大学食品科学与技术国家重点实验室1,南昌 330047)(南昌大学中德联合研究院2,南昌 330047)(江西省产品质量监督检测院3,南昌 330029)(江西省疾病预防控制中心4,南昌 330000)
魏华,男,1966年出生,研究员,食品生物技术
蜡样芽孢杆菌(Bacilluscereus)是一种兼性需氧的革兰氏阳性菌,产芽孢,广泛分布于土壤、水、空气以及动物肠道中,有些菌株能引起食源性疾病,主要污染米饭、面条、糕点、牛奶和肉类等食品[1-3]。这类菌株因能分泌呕吐毒素(cereulide)和肠毒素(enterotoxin)而引起食物中毒,其中呕吐毒素主要能引起呕吐症状,而肠毒素则会导致腹泻。蜡样芽孢杆菌引起食物中毒通常是因其耐热的芽孢在加工热处理后部分残留,而经过再次加热条件的诱导可促使残留的芽孢萌发并大量繁殖。据报道,食用该类蜡样芽孢杆菌数量超过105CFU/g可能导致食物中毒甚至死亡[4-5]。国外蜡样芽孢杆菌引起的食物中毒事件频发,2006年德国17个儿童(3~5岁)因误食被蜡样芽孢杆菌污染的米饭,引起呕吐和腹泻[6-7];2008年日本一个1岁的幼儿因食用反复加热的蜡样芽孢杆菌污染炒米饭中毒死亡[8]。蜡样芽孢杆菌已被挪威和荷兰认定为食品中最容易检出的病源微生物[9]。目前我国尚未对由蜡样芽孢杆菌引起的中毒事件进行系统的调查、分析和统计,然而我国该菌中毒事件亦较为严重。2010年6月大连某中学29名学生在食用某营养套餐公司配送的午餐后出现腹痛、腹泻症状;2011年江苏某镇12个人在进食流动摊位的凉皮后出现呕吐、腹泻症状;2012年9月河南济源市某高中的24名学生在食用了餐厅的炒米饭后有8人出现头痛、呕吐腹泻症状。后经实验室检测,上述症状均为蜡样芽孢杆菌引起的食物中毒[10-12]。周帼萍等[3]认为随着我国快餐、学生套餐等行业的快速发展,很容易引起大规模蜡样芽孢杆菌中毒事件的爆发。因此,随着我国对食品质量安全要求的提高,建立一种快速、灵敏的方法检测食品中蜡样芽孢杆菌至关重要。
目前细菌的传统检测方法主要是分离培养和血清学分析,包括增菌、选择性培养、生化分析以及毒理学实验等,整个过程复杂繁琐,且特异性弱、灵敏度差。QPCR技术是20世纪90年代发展起来的一种准确、快速的核酸定量分析技术[13],因其具有特异性强、灵敏度高、重复性好和能定量检测等优点而被迅速应用到食源致病菌的快速检测。Kim等[14]利用QPCR技术检测了水果汁中单核增生李斯特菌的污染,Wang等[15]采用EMA结合QPCR检测了牛肉中的大肠杆菌O157:H7。本研究针对编码蜡样芽孢杆菌呕吐毒素合成酶的基因cesB设计特异性引物[16],利用QPCR快速准确的优点,建立了一种SYBR Green I染料嵌合的QPCR方法,用于米饭中产呕吐毒素蜡样芽孢杆菌的快速检测。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
产呕吐毒素蜡样芽孢杆菌(JDZ102Y)和不产呕吐毒素蜡样芽孢杆菌(DA0018L、DA0019L、NC0076L、NC0078L、JA0060、JA0093、FX0088Y、PX0026L1、JX0119LY、SRX001、JDZ0043Y、JDZ0041Y、YS0024L)由江西省疾病预防控制中心提供;金黄色葡萄球菌(CMCC26001)、黏质沙雷氏菌(CMCC41002)、普通变形杆菌(CMCC49101)、大肠杆菌O157: H7(NCTC12900)和阪崎肠杆菌(CMCC45401)由中国药品生物制品检定所医学菌种保藏中心提供;志贺氏菌(ATCC29903)由国家标准菌库提供;藤黄微球菌(CMCC28001)、铜绿假单胞杆菌(CMCC10104)和肠炎沙门氏菌(ATCC13076)由美国典型培养物保藏中心提供。
1.1.2 试剂和仪器
LB培养基、PBS(0.01 mol/L):实验室配制;Taq DNA聚合酶、SYBR PrimerExTaq:日本TaKaRa公司;PCR引物由英潍捷基(上海)贸易有限公司合成,其他试剂为国产分析纯。
ABI 7900HT实时荧光定量PCR仪:美国应用生物系统公司;GelDoc XR凝胶成像系统:美国伯乐;TC-96 PCR扩增仪:杭州博日科技有限公司;TG16-W离心机:湖南湘仪实验室仪器开发有限公司。
1.2 试验方法
1.2.1 细菌的培养
挑取产呕吐毒素蜡样芽孢杆菌单菌落接种到5 mL LB液体培养基,37 ℃、180 r/min培养12 h。取1 mL菌液于1.5 mL无菌离心管中,12 000 r/min离心3 min,弃上清,PBS洗涤2次后,用等体积PBS重悬得到浓度大约为108CFU/mL的菌悬液。利用此菌悬液测定QPCR的标准曲线。
1.2.2 基因组DNA提取
取1 mL上述菌悬液以12 000 r/min离心5 min,PBS洗涤1次后,用等体积的PBS重悬菌体。沸水中煮沸10 min,使DNA从细菌中释放出来,迅速冷却至室温,以12 000 r/min离心5 min,上清液转移至无菌离心管,-20 ℃保存备用。
1.2.3 引物特异性的验证
按照1.2.1方法培养供试菌株,按照1.2.2方法提取基因组DNA。根据编码蜡样芽孢杆菌的特异性基因cesB合成上下游引物:上游5'-ACCCATCTTGCGTCATT-3′,下游5′-CAGCCAAGTGAAGAATACC-3',扩增片段长度为154 bp。PCR体系为10 μL:2×Taq Mix 5 μL,上、下游引物各0.2 μL,模板2 μL,补加去离子水至10 μL。PCR反应条件为:95 ℃预变性10 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,扩增30个循环,最后72℃延伸10 min。PCR产物用1.5%的琼脂糖凝胶进行电泳,GoldView核酸染色。用GelDoc XR凝胶成像系统成像。
1.2.4 QPCR反应条件
引物见1.2.3中cesB的上下游引物。QPCR的体系为20 μL:2×SYBR PrimerExTaq 10 μL,上、下游引物各0.8 μL,ROX Reference Dye 0.4 μL,模板2 μL,补加去离子水至20 μL。扩增反应条件:首先95 ℃,30 s;然后95 ℃,5 s、58 ℃,1 min,进行40个循环。
1.2.5 人工污染食品的检测
从当地超市购买新鲜米饭,采用传统平板计数的方法检测米饭无蜡样芽孢杆菌污染。称取25 g米饭样品于225 mL LB培养基中,接种已知浓度的产呕吐毒素的蜡样芽孢杆菌,使得米饭培养基混合液样品中菌的最终浓度分别为100、101、102和103CFU/g,37 ℃静置培养以达到增菌目的,在0、2、4、6 h分别从增菌培养基中取1 mL上清液于无菌离心管中,12 000 r/min离心3 min,弃上清,PBS洗涤2次,等体积无菌水重悬,按照1.2.2方法提取基因组DNA。
1.2.6 杂菌干扰试验
按照1.2.5污染米饭样品的方法,实验组接种不同浓度的产呕吐毒素的蜡样芽孢杆菌,同时接种106CFU/g的金黄色葡萄球菌和106CFU/g的肠炎沙门氏菌。对照组直接接种不同浓度的产呕吐毒素的蜡样芽孢杆菌。
2 结果与分析
2.1 cesB引物的特异性分析
PCR检测结果显示,编号为JDZ102Y的产呕吐毒素蜡样芽孢杆菌模板能扩出154 bp的特异性条带,不产呕吐毒素蜡样芽孢杆菌、非蜡样芽孢杆菌以及用双蒸水作为PCR模板的阴性对照均不能扩出条带(图1),表明该方法对产呕吐毒素的蜡样芽孢杆菌检测具有很好的特异性,与其他非产呕吐毒素蜡样芽孢杆菌以及非蜡样芽孢杆菌无交叉。

图1 引物特异性验证
2.2 产呕吐毒素蜡样芽孢杆菌标准曲线的建立
将浓度约为108CFU/mL产呕吐毒素蜡样芽孢杆菌进行连续10倍梯度稀释,取浓度依次为6.8×108、6.8×107、6.8×106、6.8×105、6.8×104CFU/mL的菌液提取DNA,分别以此为模板进行QPCR检测。建立扩增标准曲线,横坐标为PCR体系中菌液模板浓度的对数,纵坐标为荧光信号达到阈值时的循环次数,如图2所示。其中标准曲线的回归方程为y=-3.156 2x+36.414,相关系数为0.996 6,表示在稀释的范围内有很好的线性关系。扩增效率为107.4%,计算公式为E=10-1/slope-1[7]。

图2 产呕吐毒素蜡样芽孢杆菌的扩增标准曲线
2.3 QPCR重复性试验
分别选取5个不同浓度的菌液重复检测3次,通过QPCR仪自动获取的Ct值比较其差异来验证方法的稳定性,结果如表1所示。由表1中可以看出,试验偏差比较小,表明该方法具有很好的稳定性,从而证实标准曲线的可靠性,也为后续对模拟污染米饭中蜡样芽孢杆菌的检测准确性提供保证。
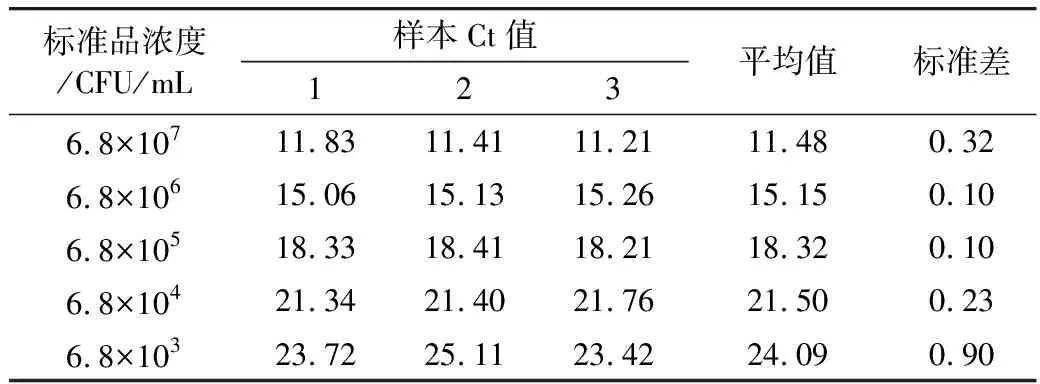
表1 QPCR检测产呕吐毒素蜡样芽孢杆菌的重复性
2.4产呕吐毒素蜡样芽孢杆菌模拟污染米饭的检测
为了模拟实际污染样本,接种低浓度的产呕吐毒素蜡样芽孢杆菌菌液于米饭中,定时取1 mL上清液,提取基因组DNA,进行QPCR检测。根据Ct值和图2的产呕吐毒素蜡样芽孢杆菌的扩增标准曲线计算菌液的浓度。每个处理设置3个重复,结果如表2所示:接种浓度为100CFU/g菌液0 h时,QPCR检测不出产呕吐毒素蜡样芽孢杆菌;分别增菌2、4、6 h后,QPCR检测到产呕吐毒素蜡样芽孢杆菌浓度分别为2.2×102、1.8×103、3.6×106CFU/g。当接种浓度超过101CFU/g时,QPCR未经过增菌培养检测到9.8×101CFU/g的产呕吐毒素蜡样芽孢杆菌。表明该方法不经过增菌在实际样本最低可检测到9.8×101CFU/g产呕吐毒素蜡样芽孢杆菌;经过前增菌,该方法在模拟的污染样本中可以检测到浓度为100CFU/g的产呕吐毒素蜡样芽孢杆菌。

表2 人工污染米饭中的产呕吐毒素蜡样芽孢杆菌的检测
注:a-表示未检测到。
2.5食品中杂菌对产呕吐毒素蜡样芽孢杆菌检测的影响
为验证米饭中常见杂菌是否影响该方法的检测结果,接种浓度分别为1.7×102、1.7×103、1.7×104、1.7×105和1.7×106CFU/g的产呕吐毒素蜡样芽孢杆菌于米饭中,同时分别向米饭中接种金黄色葡萄球菌和肠炎沙门氏菌,提取基因组DNA并进行荧光定量PCR。每个处理设置3个重复,作Ct值与产呕吐毒素蜡样芽孢杆菌浓度的线性图,如图3。模板中含有杂菌的标准曲线的回归方程为y=-3.171x+42.022,相关系数为0.992 2,扩增效率为100.7%;对照组的标准曲线的回归方程为y=-3.187x+41.785,相关系数为0.998 8,扩增效率为100.6%;试验组和对照组标准曲线回归方程的相关系数均大于0.99,扩增效率也都接近100%,表明该方法的设置组都实现了较为理想的扩增,且杂菌的存在不影响蜡样芽孢杆菌的扩增。
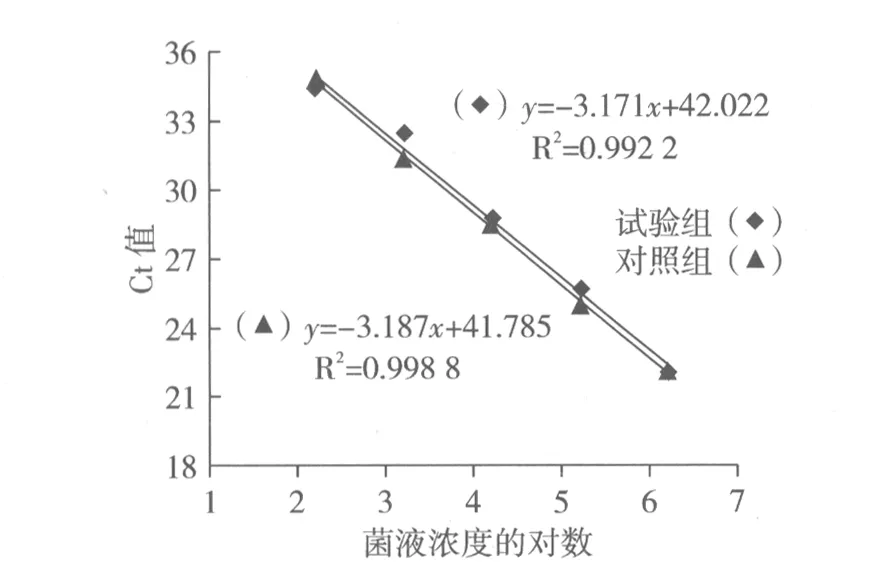
图3 不同条件下产呕吐毒素蜡样芽孢杆菌的扩增标准曲线
3 讨论
3.1 引物的特异性
本研究以产呕吐毒素蜡样芽孢杆菌能编码呕吐毒素合成酶结构基因的特异性序列设计引物,并对引物的特异性进行了验证,结果显示只有产呕吐毒素的蜡样芽孢杆菌作模板才能扩出目的条带。说明cesB引物构建的PCR体系,不仅能从杂菌中区分产呕吐毒素蜡样芽孢杆菌,而且能从所测试蜡样芽孢杆菌中区别出产呕吐毒素菌。因此,所设计合成的cesB引物具有较强特异性,可用于构建QPCR方法,并对产呕吐毒素蜡样芽孢杆菌进行检测。
3.2 产呕吐毒素蜡样芽孢杆菌的检测限
采用本研究构建的QPCR反应体系分别对纯培养和实际样品中的产呕吐毒素蜡样芽孢杆菌进行检测,结果表明该反应体系能检测出污染食品中经过短暂时间增菌培养(2~4 h)的100CFU/g的产呕吐毒素蜡样芽孢杆菌,能直接定量检测出污染食品中浓度超过101CFU/g的产呕吐毒素蜡样芽孢杆菌,且不需要增菌培养过程,从而缩短了检测周期。Dzieciol等[17]建立了基于gyrB的QPCR体系,对蜡样芽孢杆菌污染的牛奶进行检测,检测限为1.91×103CFU/mL;Yabutani等[18]建立的基于crs的QPCR体系,对产毒蜡样芽孢杆菌污染的米饭进行检测,检测限是104CFU/g。本研究建立QPCR体系的灵敏度高于上述研究。
3.3食品中杂菌对产呕吐毒素蜡样芽孢杆菌检测的影响
本研究建立的QPCR体系在检测产呕吐毒素蜡样芽孢杆菌污染的米饭时,添加杂菌浓度达到106CFU/g所获得标准曲线的相关系数与扩增效率和不添加杂菌的结果没有明显差异,说明米饭中蜡样芽孢杆菌的检测不受杂菌影响,Dzieciol等[17]也报道在牛奶中添加单核增生李斯特菌对蜡样芽孢杆菌的检测不造成影响。试验组和对照组标准曲线回归方程的相关系数都大于0.99,说明利用该标准曲线可以对样品进行准确分析;扩增效率均在90%~110%的合理范围内,扩增接近理想扩增。
4 结论
研究结果表明,以cesB作为靶基因设计的引物特异性强,建立的QPCR方法检测食品中产呕吐毒素蜡样芽孢杆菌具有快速、特异性强、灵敏度高以及稳定性好的优点。建立的方法在污染的米饭中检测限能达到101CFU/g,且杂菌对蜡样芽孢杆菌的检测没有影响。本研究构建的基于QPCR快速检测米饭样品中产呕吐毒素蜡样芽孢杆菌的方法为相关食品中致病菌污染监管、食物中毒诊断和食源致病菌所致疫病的爆发提供了可借鉴的技术手段。
[1]Bottone E J.Bacilluscereus,a volatile human pathogen[J]. Clinical Microbiology Reviews,2010,23(2):382-398
[2]Ehling-Schulz M,Fricker M,Scherer S.Bacillus cereus,the causative agent of an emetic type of food-borne illness[J]. Molecular Nutrition & Food Research,2004,48(7):479-487
[3]周帼萍,袁志明.蜡状芽孢杆菌(Bacilluscereus)污染及其对食品安全的影响[J]. 食品科学,2007,28(03):357-360
[4]Lim J S,Kim M R,Kim W,et al.Detection and differentiation of non-emetic and emeticBacilluscereusstrains in food by real-time PCR[J]. Journal of the Korean Society for Applied Biological Chemistry,2011,54(1):105-111
[5]Dierick K,Van Coillie E,Swiecicka I,et al.Fatal family outbreak of Bacillus cereus-associated food poisoning[J]. Journal of Clinical Microbiology,2005,43(8):4277-4279
[6]Granum P E,Lund T.Bacilluscereusand its food poisoning toxins[J]. FEMS Microbiology Letters,2006,157(2):223-228
[7]Fricker M,Messelhäußer U,Busch U,et al.Diagnostic real-time PCR assays for the detection of emeticBacilluscereusstrains in foods and recent food-borne outbreaks[J]. Applied and Environmental Microbiology,2007,73(6):1892-1898
[8]Shiota M,Saitou K,Mizumoto H,et al.Rapid detoxification of cereulide in Bacillus cereus food poisoning[J]. Pediatrics,2010,125(4):951-955
[9]Beattie S H,Williams A G.Detection of toxins[M]. Encyclopedia of Food Microbiology,2000,141-149
[10]程冲,田锦平,王庆奎,等.一起由蜡样芽孢杆菌引起的食物中毒的病原学检测[J]. 中国卫生检验杂志,2012,22(12):2901-2902
[11]卢艳玲,任艳平,陈晨,等.一起蜡样芽孢杆菌引起的食物中毒的分析[J]. 防保康复,2013,15(07):356-356
[12]刘成风,胡佳,丁燕,等.一起蜡样芽孢杆菌引起的食物中毒调查分析[J]. 疾病预防控制通报,2013,28(1):82-83
[13]唐培安,王进军,宋伟.嗜虫书虱β-actin基因克隆及定量PCR方法的建立[J]. 中国粮油学报,2011,26(11):71-75
[14]Kim H J,Cho J C.Simple and rapid detection ofListeriamonocytogenesin fruit juice by real-time PCR without enrichment culture[J]. Food Control,2010,21(10):1419-1423
[15]Wang L,Li Y,Mustapha A.Detection of viableEscherichiacoliO157: H7 by ethidium monoazide real-time PCR[J]. Journal of Applied Microbiology,2008,107(5):1719-1728
[16]Zhang Z,Wang L,Xu H,et al.Detection of non-emetic and emeticBacilluscereusby propidium monoazide multiplex PCR (PMA-mPCR) with internal amplification control[J]. Food Control,2013,35(2014):401-406
[17]Dzieciol M,Fricker M,Wagner M,et al.A novel diagnostic real-time PCR assay for quantification and differentiation of emetic and non-emeticBacilluscereus[J]. Food Control,2013,32(1):176-185
[18]Yabutani M,Agata N,Ohta M.A new rapid and sensitive detection method for cereulide-producingBacilluscereususing a cycleave real-time PCR[J]. Letters in Applied Microbiology,2009,48(6):698-704.
