1株代尔夫特菌的分离鉴定及其对水稻丁草胺药害的修复效果
2014-06-08程小梅彭亚军周小毛罗坤柏连阳
程小梅,彭亚军,周小毛,罗坤,柏连阳
(1.湖南省农业科学院 a.园艺研究所;b.植物保护研究所,湖南 长沙 410125;2.湖南农业大学农药研究所,湖南 长沙 410128)
丁草胺(美国孟山都公司产品)选择性强、杀草活性高,近年来一直是中国水稻田使用面积广、施用量大的酰胺类除草剂[1]。尽管丁草胺属于非长残效除草剂,但在土壤中的残留期有1个月以上,在植株、土壤以及水体中的大量沉积,使得丁草胺药害问题频频发生[2]。解除丁草胺在土壤中的残留和污染研究成为热点[3]。土壤中的除草剂残留主要通过物理、化学及生物学降解完成。生物修复是利用微生物的广泛代谢途径对污染物进行处理,微生物降解农药,既高效安全,又运行成本低,高效降解菌的筛选尤为关键[4–5]。笔者通过富集培养技术,从农药厂排污口、废液池等长期受丁草胺污染的土壤中,分离得到1株以丁草胺为唯一碳源生长的细菌C–5,研究了其在不同条件下的生长和降解特性,及其对室内盆栽水稻药害的修复效果,以期为丁草胺药害的生物修复提供依据。
1 材料与方法
1.1 材 料
选用江苏常隆化工有限公司农药厂长期排放丁草胺的排污口、废液池土壤作为富集培养的土壤来源。
无机盐培养基:FeSO4·7H2O,0.02 g;CaSO4,0.08 g;MgSO4·7H2O,0.4 g;K2HPO4,0.2 g;(NH4)2SO4,0.2 g,1 000 mL 去离子水,pH7.0,121℃高压蒸汽灭菌30 min。
LB培养基:牛肉膏10 g,蛋白胨5 g,氯化钠10 g(固体培养基加琼脂15 g),1 000 mL去离子水,pH7.0,121 ℃高压蒸汽灭菌30 min。
1.2 方 法
1.2.1 降解菌的筛选
取5 g土样,加入含50 mg/L的丁草胺无机盐培养液中,于 30 ℃恒温摇床黑暗振荡培养(150 r/min),每隔7 d接种体积分数5%的菌液至同样的新鲜培养基中,并且使丁草胺的质量浓度以 50 mg/L的梯度递增,至培养基中的丁草胺质量浓度达到200 mg/L,驯化约2个月。于LB培养基上划线分离,挑取生长较好的菌落分离纯化3次,得到单一的菌株,保存于LB固体斜面培养基上,30 ℃培养过夜后放置于4 ℃冰箱保存备用。
1.2.2 降解菌的鉴定
1) 降解菌的形态和生理生化特性鉴定。根据《常见细菌系统鉴定手册》[6]进行。
2) 降解菌的16S rDNA序列测定。提取细菌总DNA[7],采用细菌的16S rDNA通用引物[8],引物F:5′–AGAGTTTGATCCTGGCTCAG–3′,引物 R:5′–GGTTACCTTCT TACGACTT–3′。以提取的总DNA为模板,对筛选菌株的16S rDNA 进行PCR扩增,反应体系为:10×EX–Taq Buffer 2.5 μL,dNTP mix(25 mmol/L)2 μL,16S rDNA 引物(10 mmol/L)各0.4 μL,EX–Taq酶0.2 μL,基因组DNA模板1 μL,补水到总体积25 μL。PCR反应条件为:94 ℃预变性 6 min,94 ℃变性 1 min,55 ℃退火 1 min,72 ℃延伸3 min,35个循环,72 ℃延伸10 min。PCR扩增产物应用胶回收试剂盒纯化回收(GENEray),回收片段连接到pEASY T5,热激30 s转化到Top10感受态细胞,在含有50 μg/mL的LB固体培养基上37 ℃过夜培养,挑取阳性克隆斑于含有氨苄青霉素的液体LB培养基中培养12 h,应用M13F/R进行菌液 PCR验证后测序,测序结果在 NCBI上进行BLAST分析同源性,并采用MEGA5.05构建系统发育图谱。
1.2.3 降解菌的降解条件优化
1) 丁草胺的提取及色谱条件。将20 mL接种了菌体的无机盐培养基转入125 mL分液漏斗中,分别用20、20、10 mL乙酸乙酯振荡提取3次,有机相经无水硫酸钠(350 ℃烘干4 h)过滤至浓缩瓶,在旋转蒸发仪浓缩至近干,冷却后加丙酮振荡淋洗定容至10 mL,摇匀待测。
丁草胺的气相色谱条件:气相色谱仪为岛津2010,色谱柱为 RTX–5(30 m×0.25 mm×0.25 μm)[9]。2)考查环境pH和接种量对菌株生长及对丁草胺降解效果的影响。分别以接种量1%、5%、10%、15%、20%作为菌悬液添加量;分别以pH5.0、6.0、7.0、8.0、9.0的0.1 mol/L配制的无机盐培养基培养,150 r/min摇床30 ℃培养7 d,测定细菌的OD600值和对丁草胺的降解率[10]。
1.2.4 降解菌修复丁草胺对水稻幼苗药害的盆栽试验
pH7.0缓冲液配制的半固体无机盐培养基灭菌后,分别添加丁草胺至质量浓度为5、10、20 mg/L,接种量5%、10%(OD600=1.34),组合处理。菌液于室温下12 000 r/min离心8 min,用无菌水洗脱菌体沉淀后加入培养基中。将培养基放置于培养箱中过夜后,将萌发一致的水稻种子移栽至盆中,每盆10粒,每个处理设3个生物学重复。于培养箱中16 h光照、8 h黑暗、30 ℃培养,5 d后观察记录出苗数、株高、根长、鲜重。
2 结果与分析
2.1 降解菌的筛选及鉴定结果
通过富集培养和对降解单菌株的分离和纯化,筛选出能以丁草胺为唯一碳源的单一菌株,将分离得到的单一菌株重新转接到含有丁草胺20 mg/L的无机盐培养基中,摇床培养验证其降解丁草胺的特性。通过测定各单一菌株的降解率,C–5菌株的降解率最高。
C–5菌株在LB平板上放置于培养箱30 ℃培养24 h后,菌落乳白色,呈隆起、圆形、不透明状。菌体形态经扫描电镜(SEM)观察,大多以短链状存在,只有少数以单个存在,如图1所示。
C–5菌株淀粉水解反应呈阴性、接触酶反应呈阳性、脲酶反应呈阳性、V–P反应阳性、甲基红反应阳性、氧化酶反应阳性、明胶液化反应阳性。
降解菌株C–5序列已在GenBank中注册,登录号为KC702840。将C–5菌株的16S rDNA序列与GenBank中的同源性较高的4个细菌模式株进行比较,菌株 C–5的 16S rDNA 序列与代尔夫特菌属(Delftia sp.)的4个种都有较高的序列同源性,构建其系统发育树,如图2。C–5菌株的16S rDNA与Delftia tsuruhatensis (GenBank登录号为GQ140326),Delftia acidovorans (GenBank登录号为GU459215),Delftia lacustris(GenBank登录号为JN644603)及Delftia sp.(GenBank登录号为FJ688376)的相似性均为99%,且与Delftia sp.的几个种共同组成1个分支。
根据系统发育树的结果,结合生理生化特征,将C–5菌株鉴定为代尔夫特菌属(Delftia sp.)。

图1 菌株C–5在扫描电镜下的菌体形态Fig.1 Cell morphology of strain C–5 under scanning electron microscope

图2 C–5菌株的系统发育树Fig.2 The phylogenetic tree for strain C–5
2.2 C–5菌株的降解特性
2.2.1 pH对 C–5菌株生长和对丁草胺降解效果的影响
当 pH=7时,C–5菌株的生长状态最好,在强酸或者强碱状态下都不利于细菌生长(图3)。当pH=7时,C–5菌株对丁草胺的降解率最高,偏酸或偏碱都影响细菌对丁草胺的降解能力。

图3 C–5菌株在不同pH的生长量及对丁草胺的降解率Fig.3 Influence of strain C–5 on growth and butachlor degradation under different pH
2.2.2 接菌量对 C–5菌株生长和对丁草胺降解效果的影响
由图4可看出,随着接菌量的增加,细菌的生长量也随之增加。在接菌量为5%时,细菌对农药的降解率最高。随着接菌量的增大,降解率增幅不大,当接菌量达到20%时,降解率反而会下降,这可能是由于细菌量过大而产生了某些有害中间代谢产物,抑制了有效降解菌的生长的缘故。

图4 C–5菌株在不同接种量的生长量及对丁草胺的降解率Fig.4 Influence of strain C–5 on growth and butachlor degradation with different inoculation size
2.3 C–5菌株在最佳培养条件下的生长量和对丁草胺的降解能力
由图5可知,C–5菌株的生长量在第7天时达到最大值,其生长趋势趋于平缓,对丁草胺的降解在第7天也达到最大。说明随着C–5对培养基的适应和生长,对丁草胺的降解能力也愈来愈强,并同时在第7天达到最大。在培养的第1天降解率虽然不高,但是丁草胺的浓度也下降了。同时该菌株生长比较快,在第1天就能生长良好,说明笔者对无机盐培养基的优化比较成功。
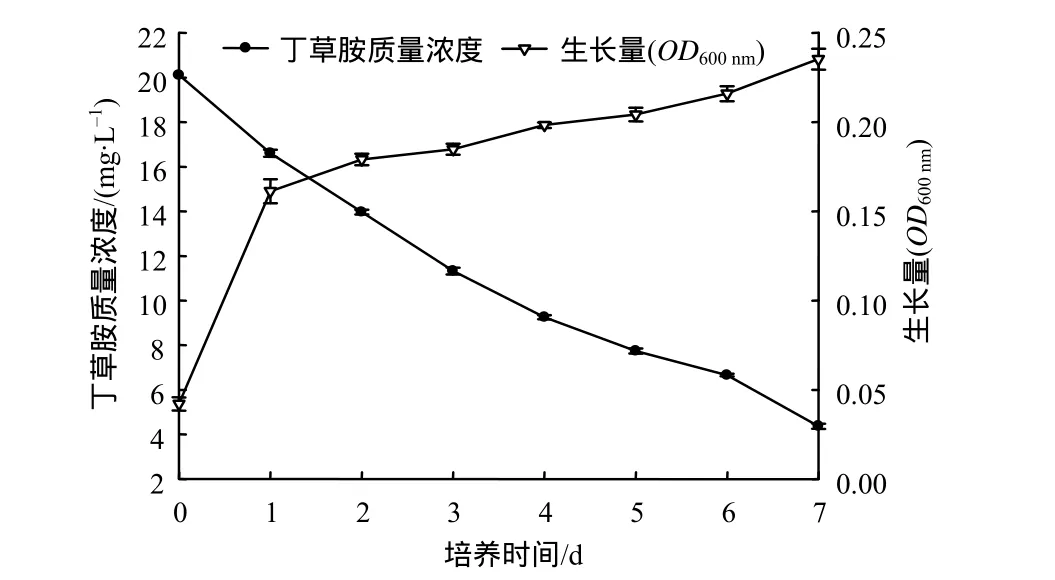
图5 C–5菌株的生长及其对丁草胺的降解效果Fig.5 Growth curve of strain C–5 and degradation curve of butachlor with strain C–5
2.4 C–5菌株对水稻丁草胺药害的修复效果
由表1可知,添加C–5菌株后对产生丁草胺药害水稻的出苗率、株高、根长、株鲜重均有比较明显的修复效果。在丁草胺质量浓度为 5 mg/L、接菌量为10%(OD600nm=1.34)时,出苗率达到87%,仅比空白低 10%,比未加菌组高 50%。株高比空白低 44%,比未加菌高 93%,对药害的修复效果最好。此外在丁草胺质量浓度10、20 mg/L下的修复效果虽然都不理想,但在10%接菌量下仍有一定的修复效果。

表1 C–5菌株不同接种量下的水稻药害植株性状Table 1 Character of butachlor injured rice inoculated with different amount of strain C–5
3 讨 论
从长期受丁草胺污染的农药厂排污地筛选到的代尔夫特菌属的细菌 C–5,对丁草胺具有较好的降解能力,且能以丁草胺为唯一C源。通过富集驯化、生理生化特征和菌株形态相似性比较及 16S rDNA序列同源性分析,将菌株C–5鉴定为代尔夫特菌属(Delftia sp.)。目前有学者在(2,4–D)[13]、苯胺[14]等中筛选出该菌属。国内外报道的对丁草胺其降解作用的微生物主要有钩杆菌属[15]、不动杆菌属[16]、施氏假单孢菌[17]、副球菌属(Paracoccus sp.)[18]、红球菌属(Rhodococcus sp.)[19]等,本研究筛选出的代尔夫特菌属的细菌,丰富了丁草胺降解菌株的多样性,为受丁草胺污染的土壤的生物修复提供了菌株资源。
盆栽试验表明,通过接种降解菌,能明显减轻丁草胺对水稻植株的药害。在丁草胺质量浓度为5 mg/L,接菌量为10%的条件下,对丁草胺的药害修复效果最好,修复后出苗率达 87%,总体修复效果达 50%以上。在验证了室内盆栽药害修复效果后,还将进一步探索该菌株的最适发酵条件,配制高效发酵液投入大田,在自然环境下验证药害修复效果。
[1]Yu Y L,Chen Y X,Luo Y M,et al.Rapid degradation of butachlor in wheat rhizosphere soil[J].Chemosphere,2003,50(6):771–774.
[2]程湘虹,沈朵朵.丁草胺引起药害的原因和对策[J].中国植保导刊,2005,25(6):40.
[3]Zheng Jingwei,Li Rong,Zhu Jianchun.Degradation of the chloroacetamide herbicide butachlor by Catellibacterium caeni sp.nov DCA–1T[J].International Biodeterioration & Biodegradation,2012,73:16–22.
[4]滕春红,苏少泉.除草剂在土壤中的微生物降解及污染土壤的生物修复[J].农药,2006,45(8):6–8.
[5]汪佳秀,张祥辉,穆文辉,等.降解菌2N3对被氯嘧磺隆污染土壤的生物修复[J].农药学学报,2010,12(1):49–53.
[6]东秀珠,蔡妙英.常见细菌系统鉴定手册[K].北京:科学出版社,2001:160-240.
[7]Cheng H R,Jiang N.Extremely rapid extraction of DNA from bacteria and yeasts[J].Biotechnology Letters,2006,28:55-59.
[8]Karen M K,Sherry L H,Douglas C N.Novel,attached,sulfur-oxidizing bacteria at shallow hydrothermal ventspossess vacuoles not involved in respiratory nitrate accumulation[J].Applied and Environmental Microbiology,2004,70:7487-7496.
[9]楚小强,庞国辉,方华,等.丁草胺降解菌的分离鉴定及降解特性的研究[J].农业环境科学学报,2009,28 (1):145-150.
[10]Xu Jun,Qiu Xinghui,Dai Jiayin.Isolation and characterization of a Pseudomonas oleovorans degrading the chloroacetamide herbicide acetochlor[J].Biodegradation,2006,17:219–225.
[11]岳永德.农药残留分析[M].北京:中国农业出版社,2004.
[12]González A J,Gallego A,Gemini V L.Degradation and detoxification of the herbicide 2,4–dichlorophenoxyacetic acid(2,4–D)by an indigenous Delftia sp.strain in batch and continuous systems[J].International Biodeterioration & Biodegradation,2012,66:8–13.
[13]Xiao Chengbin,Ning Jun,Yan Hai.Biodegradation of
aniline by a newly isolated Delftia sp.XYJ6[J].Chinese Journal of Chemical Engineering,2009,17(3):500–505.
[14]李艳春,熊明华,肖晶,等.一株丁草胺降解菌的分离鉴定及其降解特性的研究[J].微生物学通报,2009,36(8):1178–1182.
[15]李春艳,李艳春,成小松,等.一株丁草胺降解菌的分离鉴定及培养条件优化[J].环境科学学报,2010,30(2):347–353.
[16]Zhang J,Zheng Jin-wei,Liang B.Biodegradation of chloroacetamide herbicides by Paracoccus sp.FLY–8 in Vitro[J].Agric Food Chem,2011,59(9):4614–4621.
[17]Li Chao,Zhang Ji,Wu Zhi–Guo.Biodegradation of Buprofezin by Rhodococcus sp.strain YL–1Isolated from rice field soil[J].Agric Food Chem,2012,60:2531-2537.
