激素和硝酸银对芥菜型油菜下胚轴再生植株的影响
2014-06-08袁玉辉刘显军杨柳陆赢官春云刘忠松
袁玉辉,刘显军,杨柳,陆赢,官春云,刘忠松
(湖南农业大学油料作物研究所,湖南 长沙410128)
农杆菌介导的遗传转化具有简单、快速、高效的特点,且整合的外源基因多为单拷贝,转化获得的单拷贝植株遗传稳定性好,多符合孟德尔遗传定律[1],能直接为遗传育种提供新种质,在植物遗传转化中被广泛应用。油菜遗传转化多采用农杆菌介导法,适宜的外植体包括下胚轴、子叶柄、茎段、小孢子等[2–5]。油菜子叶柄和下胚轴外植体具有取材简便、易于再生、生长快速等优点[6],因此子叶柄和下胚轴是油菜遗传转化的首选外植体。目前,已建立了甘蓝型油菜的相对稳定的遗传转化体系[6–7],但还没有建立起相对稳定且高效的芥菜型油菜的遗传转化体系,原因有玻璃化现象严重和转化阳性率低等[8–12]问题。本研究拟优化影响芥菜型油菜遗传转化效率的因素,包括愈伤诱导、芽分化及生根培养3个阶段的激素和硝酸银配比,以建立芥菜型油菜高效遗传转化体系,为芥菜型油菜转基因研究提供参考数据。
1 材料和方法
1.1 菌株与质粒
根癌农杆菌菌株GV3101,含有标记基因NPTII和报告基因GUS的双元载体pBI121质粒由湖南农业大学作物基因工程实验室保存。根癌农杆菌在含有50 mg/L利福平(Rif)和50 mg/L卡那霉素(Kan)的YEP固体培养基上划线培养。培养温度为28 ℃。挑取单菌落接种于50 mL YEP液体培养基(50 mg/L Rif, 50 mg/L Kan)中,于28 ℃、200 r/min的摇床上振荡过夜培养(16~24 h),当菌液OD600nm值约为0.6时,4 ℃、4 000 r/min离心8 min,收集菌体,加入等量的MS培养液重悬菌体,调整OD600nm至0.3~0.6,并添加100 µmol/L 乙酰丁香酮(AS)用于浸染。
1.2 外植体的获取
外植体供体材料为芥菜型油菜(Brassica juncea L.Czern and Coss)品种‘四川黄籽’,来源于刘忠松课题组培育的高代自交系[13]。选取饱满种子,无菌条件下用75%乙醇浸泡30 s 后,用0.1%氯化汞浸泡12 min灭菌,用无菌水冲洗3次后接种于发芽培养基(表1)中培养。(22±2)℃暗培养4 d,再光照培养2 d,用解剖刀切下完整的下胚轴(5~10 mm)作为外植体。
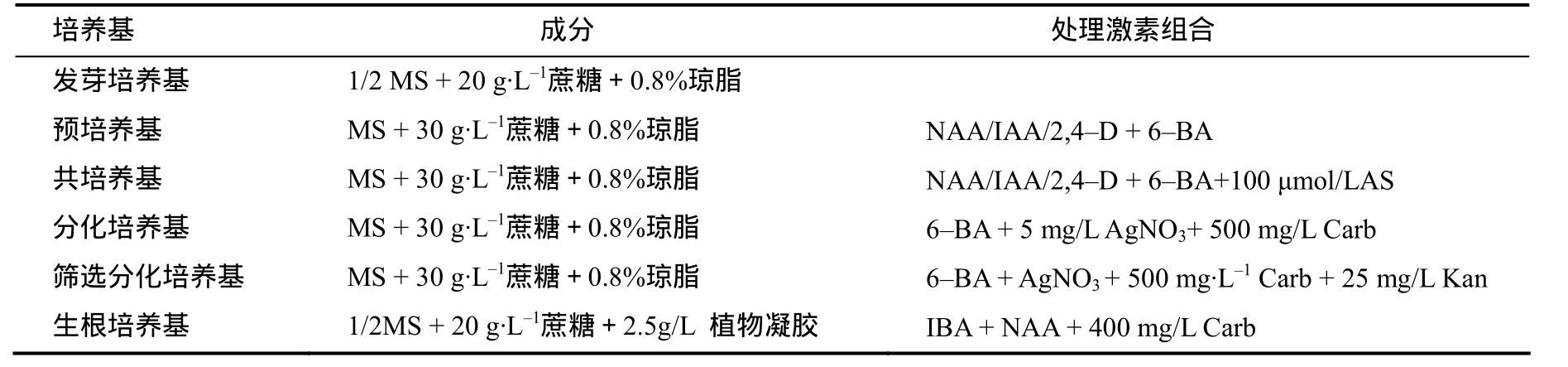
表1 芥菜型油菜下胚轴诱导再生各阶段的培养基组成Table 1 Component of medium used in each stage for inducing the regeneration of hypocotyls of Brassica juncea
1.3 外植体预培养条件的优化
将下胚轴接种于含有不同浓度生长素(NAA、IAA、2,4–D)和细胞分裂素(6–BA)组(表2)的预培养基(表1)中预培养3 d,然后转移到与预培养基含相同激素组合的共培养基(添加100 µmol/L AS)上暗培养2 d,再转入含有3 mg/L 6–BA + 5 mg/L AgNO3的分化培养基中培养,15 d后统计出愈率,20 d后统计芽再生率。预培养,共培养及分化培养均设3个重复。每个重复含 20个下胚轴,结果取平均值。出愈率=带绿色愈伤的外植体数/外植体数×100%,芽再生率=再生不定芽的外植体数/外植体数×100%。选取芽再生率最高的预培养基配方诱导愈伤组织用于下一步试验。所有的外植体均保持在(22±2)℃下生长、光周期为16 h/8 h(光/暗),光强为2 000 lx(冷白日光灯管)。
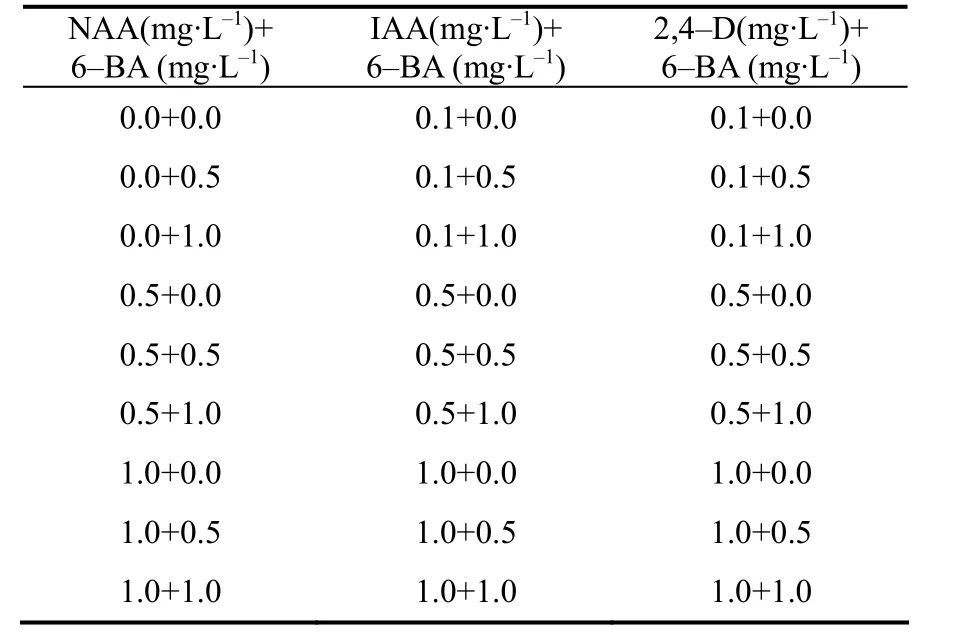
表2 芥菜型油菜下胚轴预培养基中处理激素组合Table 2 The hormone combination in the pre–culture medium for Brassica juncea hypocotyls
1.4 浸染与共培养
将预培养的下胚轴用农杆菌菌液振荡浸泡5 min,再接种到共培养基中避光共培养2 d。培养基见表1,培养条件同上所述。
1.5 脱菌与分化培养
将经过共培养的下胚轴用无菌水清洗3次,用含500 mg/L羧卞青霉素(Carb)的MS培养液100 r/min振荡洗涤30 min,转入含有不同浓度配比的6–BA +AgNO3的分化培养基中培养。为探讨6–BA浓度对芽再生和AgNO3浓度对下胚轴芽再生的影响,将脱菌后的下胚轴分别接种到含有2.0、2.5、3.0、3.5、4.0、4.5、5.0 mg/L 6–BA分化培养基(含500 mg/LCarb)中培养,从中选择芽再生率最高的含6–BA的分化培养基,在此培养基中添加3、4、5、6、7 mg/L AgNO3,用于下胚轴的下一步培养。
1.6 生根培养
当分化芽长约2 cm时,切下转移到生根培养基中诱导生根。为研究激素配比对生根的影响,使用含以下7种激素组合的生根培养基:①1/2 MS;②1/2 MS +1.5 mg/L IBA;③1/2 MS +2.0 mg/L IBA;④1/2 MS +2.5 mg/L IBA;⑤1/2 MS +2.5mg/L IBA+0.05 mg/L NAA;⑥1/2 MS +2.5 mg/L IBA+0.10 mg/L NAA;⑦1/2 MS +2.5mg/L IBA+0.1 5mg/L NAA。光周期为12 h/12 h(光/暗)。培养18 d后统计生根率并观察根的形态,每次处理5个再生芽,设3个重复,结果取平均值。生根率=生根的芽数/总芽数×100%。
1.7 PCR检测
待根生长20 d左右,炼苗5 d,再将试管苗移栽到蛭石里,待根舒展固定后连同蛭石一起移栽到钵土里。再生苗长到五叶期后,用CTAB法提取单株DNA进行PCR电泳检测。用pBI121表达载体的选择标记基因NPTII特异引物(NPTⅡF:5′–CGGCTATG ACTGGGCACAACAGACAAT–3′;NPTⅡR:5′–AG CGGCGATACCGTAAAGCACGAGGAA–3′)进行扩增,预计PCR扩增产物长度为686 bp。10 μL的PCR扩增体系含有1 μL10×Buffer,正反向引物各1 μL(3.29 mmol/L),0.2 μL dNTP(10 mmol/L),0.2 μL Taq酶(5 U/µL),2 μL模板(50 ng/μL)。PCR扩增程序为94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72℃延伸30 s,36个循环,72 ℃延伸10 min。
1.8 GUS染色检测
将浸染后脱分化培养10 d的下胚轴、抗性芽和PCR检测阳性植株的幼嫩叶片浸泡在GUS染色液中,37 ℃温育过夜,再转入70%乙醇溶液中脱色,直到阴性材料呈白色,在体视显微镜下观察,拍照。
2 结果与分析
2.1 预培养基中激素配比对愈伤诱导的影响
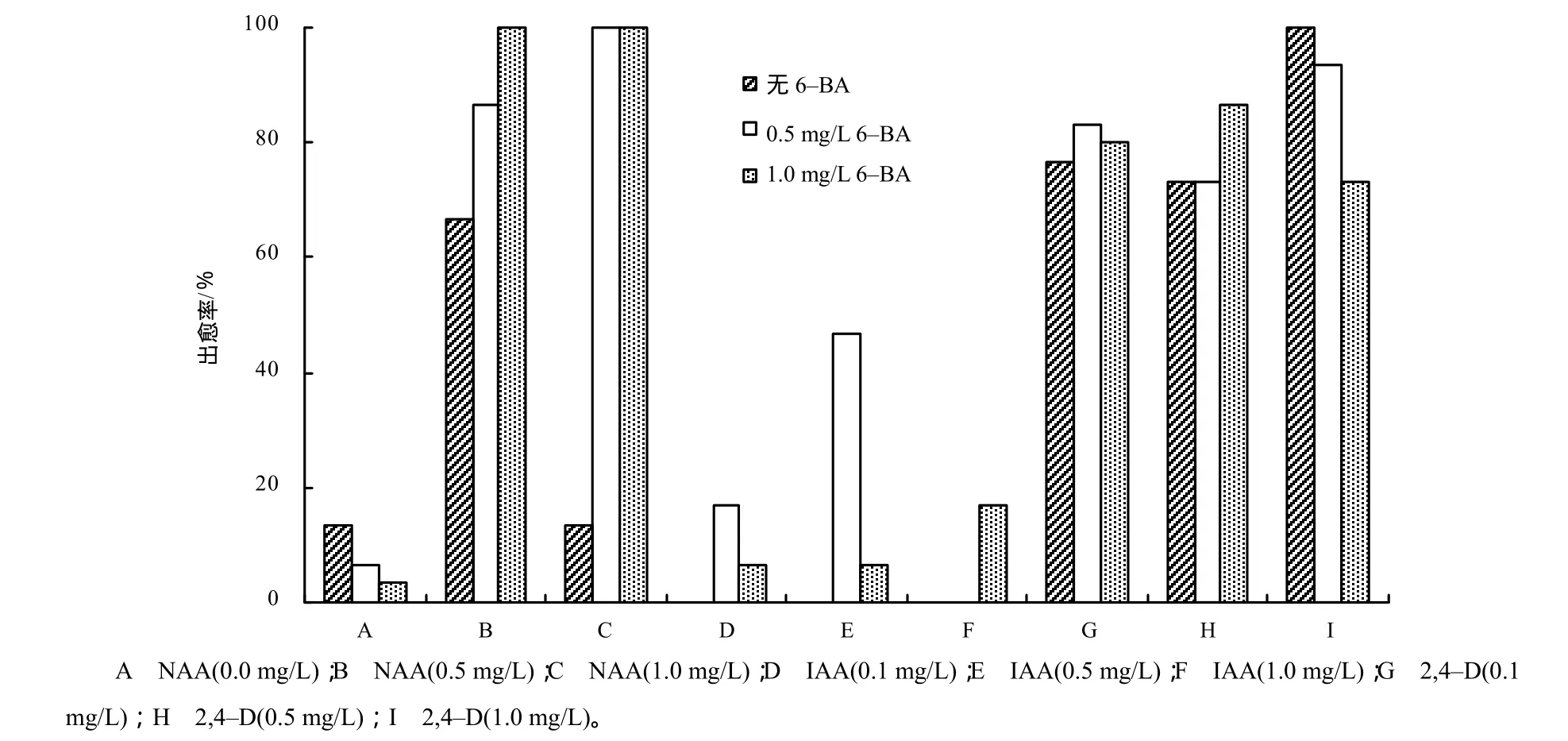
图1 预培养基中不同激素配比对芥菜型油菜下胚轴愈伤诱导的影响Fig.1 Effects of different hormone combinations in pre–culture medium on callus induction for hypocotyls of Brassica juncea
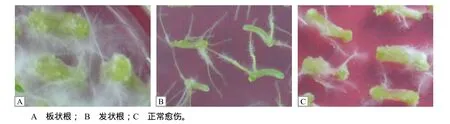
图2 预培养基中芥菜型油菜下胚轴愈伤组织的形态Fig.2 The morphology of callus on pre–culture medium induced from hypocotyls of Brassica juncea
当不添加任何生长素时,诱导产生的愈伤组织很小,且出愈率仅为6.67%~13.33%(图1)。当添加0.5或1.0 mg/L NAA时出愈率达到66.67%~100%(图1),但有大量白色根毛生成,呈板状根(图2),愈伤疏松膨大,抑制了芽的形成。添加0.5和1.0 mg/L 6–BA能促进下胚轴的生长及愈伤生成(图2)。当用IAA处理时,单独使用IAA导致大量发状根的生成(图2),且出愈率为0。如果添加6–BA,仅0.5 mg/L IAA+0.5 mg/L 6–BA组合有46.67%外植体生成愈伤,且伴随有板状根;其余的激素组合愈伤率仅为6.67%~13.33%,且愈伤很小,不转绿。2,4–D的诱导愈伤的效果优于NAA和IAA,添加2,4–D后出愈率达到 73.33%~100%,且愈伤多呈黄绿色,疏密程度适中,易分化成芽,当2,4–D的质量浓度为1.0 mg/L时,愈伤再生率达到 100%(图 1)。6–BA的添加导致根毛的增多,而出愈率反而减少(图1),因此,预培养基中添加1.0 mg/L的2,4–D适合下胚轴分化形成愈伤组织。
2.2 分化培养基中激素配比对芽再生的影响
下胚轴转移到分化培养基中1周后切口处开始膨大并转绿,愈伤组织继续生长,在第12天左右长出不定芽。当分化培养基中6–BA质量浓度低于3 mg/L时,随着6–BA浓度的升高芽再生率和芽丛数都增加(表3);当6–BA质量浓度为3 mg/L 时,芽再生率最高,达20%,平均芽丛数为1.72个(芽丛形态见图3);但随着6–BA质量浓度的进一步升高,芽再生率反而降低,而6–BA质量浓度为2.5、3.0、4.0 mg/L时芽丛数的差异没有统计学意义。综合分析认为,分化培养基中最适宜芥菜型油菜‘四川黄籽’下胚轴芽分化的6–BA质量浓度为3 mg/L。
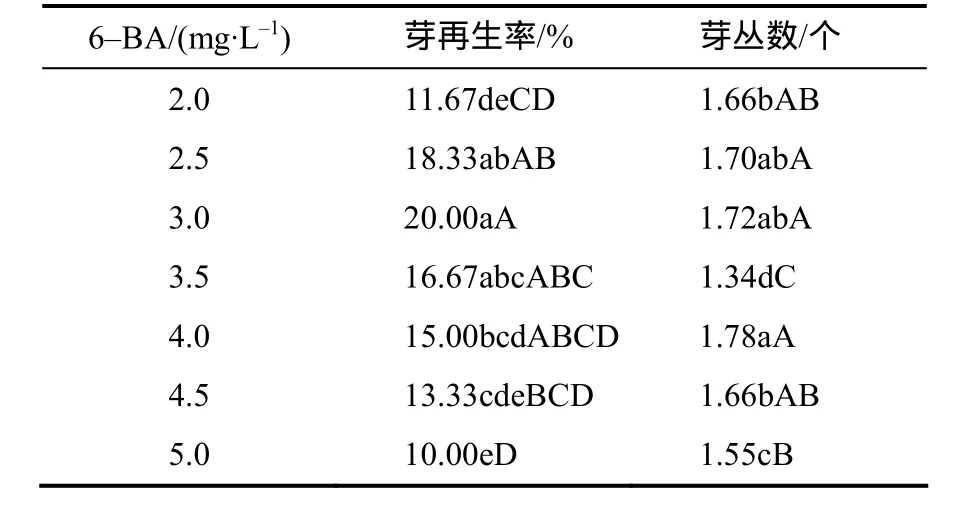
表3 芥菜型油菜下胚轴愈伤组织在含不同浓度6–BA的分化培养基中芽的再生率及芽丛数Table 3 The shoot regeneration rate in differentiation medium with different concentration of 6–BA from hypocotyls of Brassica juncea

图3 芥菜型油菜下胚轴再生芽的芽丛形态Fig.3 The bud morphology of shoot regenerated from hypocotyls of Brassica juncea
2.3 AgNO3浓度对芽再生的影响
由表4可知,在含有3 mg/L 6–BA的分化培养基中添加AgNO3能提高芽再生率。当AgNO3质量浓度为5 mg/L 时,芽再生率达28.33%,比没有添加AgNO3时提高了41.65%,并与其他浓度的处理差异有统计学意义。芽丛数则在AgNO3质量浓度为3 mg/L时差异显著,达到最大值(2.28个),其余组合芽丛数约为1.70个。综合比较,分化培养基中适宜的6–BA和AgNO3的组合为3 mg/L 6–BA+5 mg/L AgNO3。在此组合下,有25%以上的愈伤能分化成芽,且有1~2个健壮芽,而不添加AgNO3的组合诱导不出健壮芽。
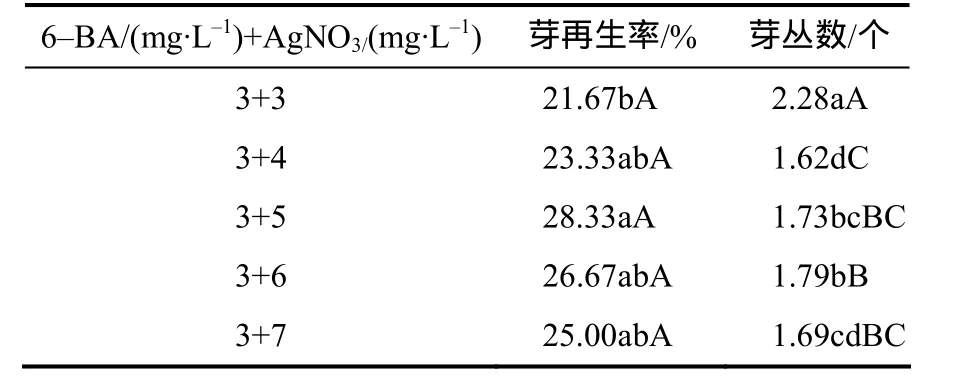
表4 芥菜型油菜下胚轴在含不同浓度AgNO3的分化培养基中芽的再生率及芽丛数Table 4 The shoot regeneration rate on differentiation medium of different concentration AgNO3 from hypocotyls of Brassica juncea
2.4 生根培养基中激素配比对根再生的影响
不定芽转移到不含任何激素的生根培养基中培养15 d后能生根,生根率为20%,主根为6条左右;而在含1.5和2.0 mg/L IBA的培养基中,不定芽培养12、13 d便开始生根,但主根少、不粗壮;在含2.5 mg/L IBA的培养基中,不定芽培养12 d开始生根,生根率达到100%,且根多、粗壮。添加不同浓度NAA的含有2.5 mg/L IBA的培养基中的主根比不加NAA的培养基中的根粗壮,且当 NAA质量浓度为0.05 mg/L时,生根所需时间缩短至11 d,且生根率为100%。芥菜型油菜再生芽在不同激素配比生根培养基中培养18 d后根的形态见图4,添加2.5 mg/L IBA和0.05 mg/L NAA的生根培养基诱导生根的效果较好。

图4 芥菜型油菜再生芽在不同生根培养基中培养18 d后根的形态Fig.4 The root morphology of regenerated shoot of Brassica juncea after 18 days of cultivation in different rooting medium
2.5 再生苗检测
特异性PCR检测结果(图5)表明,21株卡那霉素抗性苗中有5株呈阳性,阳性率为23.80%。GUS染色结果表明,大部分的愈伤、抗性芽及5株PCR检测呈阳性的再生苗叶片GUS染色都呈阳性(图6),说明这5株再生苗为转基因阳性植株。
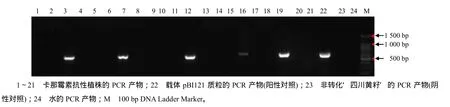
图5 T0代芥菜型油菜四川黄籽转基因苗中NPTII基因的PCR电泳检测Fig.5 Detection of NPTII gene in T0 generation transgenic Sichuan yellow seed Brassica juncea by PCR
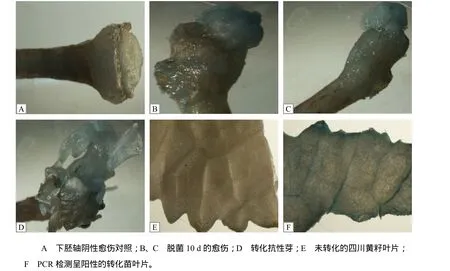
图6 GUS检测结果Fig.6 Results for GUS staining
3 结论与讨论
农杆菌介导转化效率受多重因素的影响,如植物基因型、外植体类型、浸染浓度与时间、激素的配比等[14]。本研究探讨了芥菜型油菜‘四川黄籽’下胚轴遗传转化体系中激素和硝酸银配比对愈伤诱导、芽再生和生根的影响。结果表明,在基本培养基上添加1 mg/L 2,4–D进行预培养、添加3 mg/L 6–BA和5 mg/L AgNO3进行分化培养、添加2.5 mg/L 6–BA和0.05 mg/L NAA进行生根培养的效果较好。
芥菜型油菜‘四川黄籽’下胚轴预培养基中添加1 mg/L 2,4–D效果较好,这与Ali等[15]研究结果不同。他们认为甘蓝型油菜下胚轴在含0.5 mg/L 2,4–D+0.5 mg/L 6–BA的培养基中出愈率可达95%~96%。在分化培养基中添加AgNO3能促进芽分化。本研究结果是当分化培养基中含有3 mg/L 6–BA+5~6 mg/L AgNO3最适宜芥菜型油菜芽再生,而Zhang等[9]的研究表明含3 mg/L 6–BA+2 mg/L NAA的MS培养基培养芥菜型油菜芽再生率最高,而5 mg/L 6–BA+5 mg/L AgNO3最适合甘蓝型油菜芽分化[16],说明较低浓度的6–BA更有利于芥菜型油菜芽再生。Mehra等[10]和Deepak等[11]在诱导芥菜型油菜芽分化时,AgNO3的使用浓度为20 µmol/L,而Barfield等[8]使用质量浓度为3.3 mg/L,这可能与品种不同有关。Sharma等[17]认为在添加0.2 mg/L IAA的培养基中,芥菜型油菜Pusajaikisan芽分化较好;Kong[18]、Kamal[19]等认为甘蓝型油菜诱导芽分化时培养基中添加少量的NAA效果更好。但本研究结果表明,培养基中一旦添加NAA或IAA就会导致大量根毛的生成,抑制了芽的再生,其原因还有待进一步探究。前人一般用含2.0 mg/L IBA的培养基诱导芥菜型油菜生根[10–11],本研究结果表明,芥菜型油菜在含2.5 mg/L IBA+0.05 mg/L NAA的生根培养基中再生芽100%生根,而甘蓝型油菜在含0.5 mg/L IBA的培养基培养一周后再生芽100%生根[3],甚至在不含任何激素的1/2 MS培养基中培养12 d后也可100%生根[14],说明再生芽诱导生根对培养基的要求可能存在基因型、外植体苗龄的影响。
[1]陈英,黄敏仁,王明.植物遗传转化新技术和新方法[J].中国生物工程杂志,2005,25(9):94–98.
[2]Mukhopadhyay A,N Arumugam,P Nandakumar,et al.Agrobacterium-mediated genetic transformation of oilseed Brassica campestris:Transformation frequency is strongly influenced by the mode of shoot regeneration.Plant cell reports,1992,11(10):506–513.
[3]Cardoza V,Stewart C N.Increased Agrobacteriummediated transformation and rooting efficiencies in canola (Brassica napus L.)from hypocotyl segment explants [J].Plant Cell Rep,2003,21(6):599–604.
[4]Wang Y,K Sonntag,E Rudloff,et al.,Production of fertile transgenic Brassica napus by Agrobacteriummediated transformation of protoplasts.Plant Breeding,2005,124(1):1–4.
[5]Swanson E and L Erickson,Haploid transformation in Brassica napus using an octopine-producing strain of Agrobacterium tumefaciens.Theoretical and Applied Genetics,1989,78(6):831–835.
[6]Khan M R,Rashid H,Ansar M,et al.High frequency shoot regeneration and Agrobacterium-mediated DNA transfer in Canola (Brassica napus)[J].Plant Cell Tissue Organ Cult,2003,75(3):223–231.
[7]Akasaka–Kennedy Y,Yoshida H,Takahata Y.Efficient plant regeneration from leaves of rapeseed (Brassica napus L.):The influence of AgNO3and genotype[J].Plant Cell Rep,2005,24(11):649–654.
[8]Barfield D G,Pua E C.Gene transfer in plants of Brassica juncea using Agrobacterium tumefaciensmediated transformation[J].Plant Cell Rep,1991,10(6/7):308–314.
[9]Zhang Y X,Xu J,Han L,et al.Efficient shoot regeneration and Agrobacterium-mediated transformation of Brassica juncea[J].Plant Mol Biol Rep,2006,24(2):255.
[10]Mehra S,Pareek A,Bandyopadhyay P,et al. Development of transgenics in Indian oilseed mustard (Brassica juncea)resistant to herbicide phosphinothricin [J].Curr Sci,2000,78(11):1358–1364.
[11]Deepak P,Akshay K P,Yaspal S S,et al.Variation amongst Brassica juncea cultivars for regeneration from hypocotyl explants and optimization of conditions for Agrobacterium-mediated genetic transformation[J].Plant Cell Rep,1993,12(7/8):462–467.
[12]曹必好,雷建军,宋洪元,等.芥菜农杆菌高效遗传转化体系初步建立[J].华南农业大学学报,2003,24(4):48–51.
[13]刘显军,袁谋志,官春云,等.芥菜型油菜黄籽性状的遗传,基因定位和起源探讨[J].作物学报,2009,35(5):839-847.
[14]Tsukazaki H,Kuginuki Y,Aida R,et al. Agrobacteriummediated transformation of a doubled haploid line of cabbage[J].Plant Cell Rep,2002,21(3):257–262.
[15]Ali H,Ali Z,Ali H,et al.In vitro regeneration of Brassica napus L. cultivars (Star,Cyclone and Westar)from hypocotyls and cotyledonary leaves [J].Pak J Bot,2007,39(4):1251–1256.
[16]Maheshwari P,Selvaraj G,Kovalchuk I.Optimization of Brassica napus (Canola)explant regeneration for genetic transformation[J].New Biotechnol,2011,29(1):144–155.
[17]Sharma M,Sahni R,Kansal R,et al.Transformation of oilseed mustard Brassica juncea(L.)Czern & Coss cv.Pusajaikisan with snowdrop lectin gene[J].Ind J Biotech,2004,3(1):97–102.
[18]Kong F M,Li J,Tan X L,et al.A new time–saving transformation system for Brassica napus[J].Afr J Biotechnol,2009,8(11):2497–2502.
[19]Kamal G B,Illich K G,Asadollah A.Effects of genotype,explants type and nutrient medium components on canola(Brassica napus L.)shoot in vitro organogenesis[J].Afr J Biotechnol,2007,6(7):861–867.
