胶体金免疫层析法快速测定动物源食品中的呋喃唑酮代谢物残留
2014-06-07潘嘉慧沈国权赵亮亮朱海云
潘嘉慧 田 峻 沈国权 赵亮亮 朱海云
(佛山市质量计量监督检测中心,广东佛山 528225)
胶体金免疫层析法快速测定动物源食品中的呋喃唑酮代谢物残留
潘嘉慧 田 峻 沈国权 赵亮亮 朱海云
(佛山市质量计量监督检测中心,广东佛山 528225)
本研究从优化呋喃唑酮代谢物免疫抗原、包被抗原的结构及优化偶联技术角度出发,提高呋喃唑酮抗体的特异性、亲和力,并通过优化样品前处理步骤,最终得到呋喃唑酮代谢物胶体金免疫层析试纸条的检测低限为1.0 µg/kg,特异性好,稳定性高。
呋喃唑酮代谢物;抗原;免疫胶体金;快速检测
呋喃唑酮是硝基呋喃类广谱抗生素中最具代表性的一种,价格便宜,疗效确切,在畜禽及水产养殖上应用非常广泛[1]。呋喃唑酮在生物体内代谢速率很快,代谢化合物3-氨基-2-恶唑烷酮(AOZ)可在体内残留达数周之久,甚至进入食物链中,在自然环境中长期残留。研究表明呋喃唑酮及其代谢物AOZ具有相当大的毒性和副作用,因而引起了人们的高度重视[2],导致各国禁止此类药物在治疗和饲料中使用。欧盟、美国、中国等国家均将呋喃唑酮列为禁用药。尽管我国政府和相关组织对该类药物的残留给予了高度重视,但其在动物源性食品中的残留仍时有发生。
目前对呋喃唑酮代谢物的国家标准检测方法有色谱分析法[3]、免疫检测法(酶联免疫分析方法[4])。色谱分析法(高效液相色谱法、液相色谱-质谱联用法)样品前处理复杂,费用高;免疫分析法具有快速、灵敏度高、高通量的特点。其中免疫分析方法有酶联免疫法、胶体金免疫层析技术等。酶联免疫分析法操作相对繁琐,对操作人员的专业知识要求较高,相比之下,胶体金免疫层析技术基于肉眼水平的检测,不需任何仪器设备和试剂,比酶联免疫法省略了加显色剂和终止液的步骤,更简化的操作,体积小,易携带,几分钟就可用肉眼观察到颜色鲜明的实验结果,并可保存实验结果,容易在基层单位普及应用。
现有免疫检测方法均需要将样品用对硝基苯甲醛[3]、对羧基苯甲醛[4]衍生化,在AOZ检测的灵敏度和特异性还是存在缺陷,因而,有必要在现有技术上,从优化免疫抗原、包被抗原的结构及偶联技术角度出发,提高抗体的特异性、亲和力,从而增加AOZ免疫胶体金快速检测的灵敏度和特异性。
1 试验部分
1.1 材料与试剂
AOZ、氯金酸、柠檬酸三钠、6-氧代己酸、甲基磺酸、二甲基甲酰胺(Nimethylformamide,DMF)、3-磷酰化二苯酯苯并[D]噁唑-2-酮[2(3H)- Benzoxazolone,3-(diphenoxyphosphinyl)-(9CI),DPBO]、苯并噻唑硫酮(Benzothiazolethione,BTT):国药集团化学试剂有限公司;牛血清白蛋白(Bovine serum albumin,BSA)、卵清白蛋白(Ovalbumin,OVA):美国Sigma公司;羊抗鼠IgG、硝酸纤维素膜(NC膜)和金标垫,样品垫,PVC底板,吸水纸:上海杰一生物技术有限公司。
1.2 仪器与设备
Avanti 高速冷冻离心机:美国Beckman公司;UV-2700紫外-可见分光光度计:日本岛津公司;Ultra Genetic超纯水系统:英国ELGA公司;JY-EQ08划膜喷金一体机:上海杰一生物有限公司。
1.3 试验方法
1.3.1 缩醛法合成AOZ半抗原
将200ml乙醇加入到500ml的圆底烧瓶中,依次加入AOZ(图1中结构式a,10.2g,0.1mol)和6-氧代己酸(15.6g,0.12mol),加热回流3h。停止加热,自然冷却反应液至室温,静置过夜。抽滤,滤饼用乙醇洗涤(20.0ml×3),50℃干燥5h后得到20.4g含有羧基的呋喃唑酮衍生物。制备的AOZ半抗原(图1中结构式b)
1.3.2 活泼硫酯法合成AOZ免疫抗原和包被抗原
取呋喃唑酮半抗原(图1中结构式b,0.214g,1.0mmol)溶于30ml DMF中,冷却至0~4℃,搅拌下加入DPBO(0.351g,1.0mmol)和BTT(0.167g,1.0mmol),保温反应过夜。加入100ml 10%碳酸氢钠溶液和100ml水,继续搅拌1h,抽滤,滤饼用水洗涤(50mL×2)后用20ml DMF溶解为A液。称取2.0g BSA溶于200ml的浓度为1.0mol/L的PBS(pH=8)中,加入5ml DMF,在0~5℃下搅拌溶解为B液,将上述A液缓慢滴加到B液中,保温反应8h,离心取上清液,4℃下用生理盐水恒温透析3d,每天更换3次透析液,冷冻干燥后得到呋喃唑酮免疫原(图1中结构式c)。
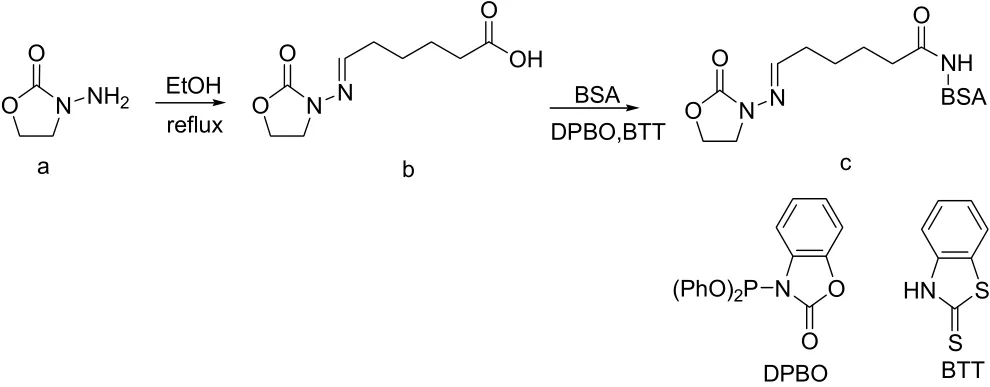
图1 AOZ免疫抗原/包被抗原的合成路线图
1.3.3 呋喃唑酮代谢物单克隆抗体的制备
用AOZ免疫抗原多次免疫BALB/C小鼠,取免疫小鼠脾细胞与骨髓瘤细胞(SP2/0)在体外融合形成杂交瘤细胞,经选择性培养基筛选,得到阳性杂交瘤细胞株。将其注入小鼠腹腔获取腹水,或利用体外细胞培养收集培养上清液等方式,制备AOZ单克隆抗体。用硫酸铵沉淀法纯化该抗体,并与等体积甘油混合,低温保存。
1.3.4 羊抗鼠IgG的制备
以上述步骤1.3.3制备的鼠源抗体为免疫原,对无病原体羊进行免疫,得到羊抗鼠IgG。
1.3.5 胶体金的制备
采用柠檬酸三钠还原法制备胶体金:于100ml超纯水中加入1ml 1%的柠檬酸三钠,煮沸后迅速加入1ml 1%氯金酸溶液,待溶液颜色变为澄清酒红色时,继续加热10min,冷却至室温后,4℃保存备用。
1.3.6 胶体金标记呋喃唑酮代谢物单克隆抗体的制备
量取胶体金溶液10ml,将其pH值调整到7.8,搅拌并加入AOZ单克隆抗体0.8mg进行标记,持续搅拌30min后,加入20%的BSA终止反应,10000 rpm离心30min,取沉淀用金标缓冲液溶解至1ml备用。
1.3.7 胶体金免疫层析试纸条的制备和组装
使用划膜喷金一体机将制备好的金标抗体均匀喷涂到金标垫上,喷金参数4μl/cm,37℃真空干燥8h备用。将适当浓度的包被抗原(AOZ-OVA偶联物)包被到NC膜的检测线(T线)位置,羊抗鼠IgG包被到质控线(C线)位置,包膜参数1.0μL/cm,晾干备用。将干燥好的样品垫,金标垫,NC膜,吸水纸,按顺序粘贴到PVC底板上,切割成条,组装成卡,分装到铝箔袋,袋内装入干燥剂,密封保存。
1.3.8 样品前处理、检测及判读
(1)样品前处理
①鸡肉、猪肉、虾肉、鱼肉组织:取2g待测样品,用均质器充分均质后,置于50ml离心管中。加入4ml去离子水,0.5ml 1mol/ L盐酸溶液,200μL 0.01mol/L对羟基苯甲醛或邻氨基苯甲醛,涡旋震荡3min,在60℃中放置2h或超声1h。取出冷却至室温,依次加入5ml 0.1mol/L 磷酸氢二钾溶液,0.4ml 1mol/L氢氧化钠溶液,5ml乙酸乙酯,涡旋振荡1min,4000r/min 离心10min,将上层乙酸乙酯层提取液取至另一洁净容器中,水相再用5ml乙酸乙酯重复萃取两次,合并乙酸乙酯层,于60℃下氮气吹干,加入1ml 正己烷涡旋震荡1min,再加入1ml 0.2 mol/L 磷酸盐缓冲液,涡旋震荡1 min,5000r/min离心10min,吸取下层水相溶液用于分析,或继续使用C18固相萃取柱净化。
②牛奶:取5ml待测样品于50ml 离心管中。加入250μl 0.5 mol/L亚硝基铁氰化钾(K2Fe(CN)5·NO3·H2O)水溶液,250μl 1 mol/L 硫酸锌(ZnSO4·7H2O)水溶液,涡旋震荡1min,4℃下4000 r/min离心10min,取上清液,以下步骤同上。
③蜂蜜:取2g 待测样品于50ml 离心管中,以下步骤同上。(2)样品检测
撕开铝箔包装,取出检测卡。取滴两滴检体(约75μL)于加样孔中,等待检体吸附移动至测试区中,等待5min后即可判读结果。
(3)结果判读
①阴性结果:T线比C线深或一样深,表示检品AOZ浓度低于1.0 μg/kg。
②阳性结果:T线比C线淡或几乎看不见,表示检品AOZ浓度高于或等于1.0 μg/kg(包括看不到T线)。
③无效结果:如果测试结果未出现任何色带或是C线未出现,此时表示此试剂已失效、过期或操作不当,需另做一次测试。
2 结果与讨论
2.1 AOZ半抗原、免疫原/包被原的制备
AOZ的分子较小,不具有免疫原性,需要与载体蛋白偶联后方能具有免疫原性;然而AOZ是一个化学结构上没有羧基和氨基的半抗原,它本身无法与蛋白偶联,而往往需要合成其他衍生物作为半抗原,然后与载体蛋白偶联才能成为全抗原。
本研究特别从半抗原、免疫原/包被原的结构出发,采用全新的连接臂,优化偶联技术和合成路线,同时保证检测特异性和灵敏度。本研究中的AOZ半抗原保留了AOZ的抗体识别部位:对硝基苯基部分,从远离特征结构、免疫原性最弱的羟基端引入间隔臂,提高了半抗原的免疫原性,同时保留AOZ的骨架结构,提高特异性,确保半抗原不受蛋白的屏蔽作用;引入的间隔臂具有一定的长度和适当的极性,将载体蛋白对小分子的电子排布和空间结构的影响降到最低;合成的半抗原有利于提高半抗原与载体蛋白的偶联比,并且能更好地暴露半抗原的抗原决定簇。在免疫分析中,通过对半抗原连接位点,连接臂长度,结构等进行合理选择与搭配,可以有效地利用可预测的交叉反应,达到同时检测某一族化合物的目的,并且可以抑制不可预测的交叉反应,提高检测的特异性[5]。
2.2 胶体金纳米颗粒质量评价
胶体金纳米颗粒的粒径大小与胶体金探针稳定性密切相关。将制备好的胶体金溶液经紫外-可见光分光光度计在400~700nm波长处扫描,测定吸收图谱,结果显示,胶体金溶液在525nm出现最大吸收峰,OD525nm=1.82,颗粒大小约为30nm,符合胶体金免疫层析法中胶体金颗粒大小的要求。
2.3 抗原包被浓度的优化
以AOZ标准溶液0.5μg/L进行检测,优化调整抗原的包被浓度。分别选择包被浓度为0.70,0.75,0.80,0.85mg/mL进行测试选择。取75μL AOZ标准溶液于样品孔中,溶液沿吸水纸方向移动。首先与金标垫上的金标抗体结合,并一同继续向吸水纸方向移动,到达T线区域。在T线处,溶液中的AOZ与包被抗原竞争金标抗体,溶液中的AOZ浓度一定,则包被抗原浓度越大,能够与包被抗原相结合的金标抗体的量越多,胶体金的颜色(红色)越深。随着包被浓度的增大,T线颜色越深,到0.80mg/mL达到最佳浓度,浓度再增加时颜色基本不变,因此确定最佳膜包被浓度为0.8mg/ml。
2.4 胶体金免疫层析试纸条检测AOZ的检出限
配制浓度为0.5,0.8,1.0μg/L AOZ标准溶液。取75μL标准溶液于样品垫中,层析结束后观察结果。结果表明,随着AOZ的浓度升高,在C线区胶体金颜色强度相对增大,在T线区胶体金颜色则逐渐变浅,在0.8μg /L时T线颜色明显变浅,在1.0μg/L时T线颜色完全消失。则将T线颜色基本完全消失所对应的浓度定义1.0μg/L为胶体金免疫层析法的检出限,与国家标准方法中使用色谱检测的测定低限相当[3-4],但相比之下胶体金检测试纸条的价格等优势不言而喻,且满足欧盟2003/181/EC法令规定限量的检测要求:呋喃唑酮代谢物AOZ在猪肉和水产品中的最大允许限量(MPRL)为1.0μg /kg。
2.5 胶体金免疫层析试纸条检测AOZ的特异性
抗体的特异性是衡量抗体质量的重要指标。选取了3种AOZ结构相似物(呋喃妥因、呋喃它酮、呋喃西林代谢物)进行特异性试验,添加浓度均为10μg/L,T线显色明显,即均为阴性,而AOZ阳性对照试液只有C线显色,T线不显色,显示为强阳性,表明本试验研制的AOZ胶体金试纸条特异性表现良好,与测试的3种类似物均没有交叉反应现象。
近年来胶体金免疫层析技术广泛应用于食品安全快速诊断领域。本研究通过优化偶联技术路线,以达到结构优化,提高抗体质量,从而进一步增加AOZ免疫胶体金快速检测的灵敏度和特异性的免疫抗原和包被抗原。本实验成功研制出AOZ快速检测试纸条,灵敏度高、特异性强、稳定性好,除了样本预处理外的测试时间仅需五分钟,与ELISA方法相比,快速、简便、成本低,可操作性强,为广大的动物源性食品加工企业、检测部分现场监测等提供了一种有效、便利的方法,值得推广。
[1] 陈杖榴.兽医药理学[M].北京:中国农业出版社,2010.
[2] Kelly B D,Heneghan M A,Connolly C E,et al. Nitrofurantoininduced hepatoxicity mediated by CD8+T cells[J]. American Journal of Gastroenterology,1998,93(5):819-821.
[3] Chappey ON,Sandouk P,Scherrmann J G. Monochonal antibodies in hapten immunoassays. Pharmaceutical Research,1992,9(11):1375-1379.
