多个地区不同来源山夫登堡沙门菌分子分型研究
2014-06-07易胜杰许学斌李浩梁蓓蓓杨超杰王建邱少富宋宏彬
易胜杰,许学斌,李浩,梁蓓蓓,杨超杰,王建,邱少富,宋宏彬
多个地区不同来源山夫登堡沙门菌分子分型研究
易胜杰,许学斌,李浩,梁蓓蓓,杨超杰,王建,邱少富,宋宏彬
目的研究不同地区、不同来源山夫登堡沙门菌之间的传播关系,并分析其耐药情况。方法对分离的70株山夫登堡沙门菌采用K-B纸片扩散法分析其耐药性,并通过脉冲场凝胶电泳(Pulsed Field Gel Electrophoresis,PFGE)分子分型技术进行山夫登堡沙门菌的聚类分析。结果70株山夫登堡沙门菌对于大多数抗生素耐药性较低,但是对于磺胺异噁唑,耐药和中介耐药的菌株达到了60%以上。同时还出现了3株对头孢噻呋耐药的菌株。PFGE结果分析显示70株山夫登堡沙门菌可分为42个不同的PFGE带型。北京市、上海市、南京市的部分菌株,有人、食品和环境3种不同来源,表现出完全相同的PFGE带型,亲缘关系十分密切。结论山夫登堡沙门菌具有遗传多态性,可能在环境、食品和人之间相互传播,应该加强监测,防止其进一步扩散。
山夫登堡沙门氏菌;耐药性;脉冲场凝胶电泳;分子分型
沙门菌是世界上食源性腹泻最常见的病原菌之一。每年全球因沙门菌感染引起的肠胃炎有9380万,且8000多万是由于食源性感染引起,因此而死亡的人高达15万[1]。在发达国家,包括欧洲和美国,沙门菌在食源性细菌感染中一直是引起疾病最多的细菌之一[2-3]。而在我国,每年仅因食源性非伤寒沙门菌感染人数就达到903.5万[4]。山夫登堡沙门菌作为一种较为常见的沙门菌血清型,在国内外都出现过人和动物感染病例以及污染食物和环境的报道[5-9]。我们通过对全国沙门菌的监测,在2005—2011年从多个地区分离到了不同来源的70株山夫登堡沙门菌。为了探究这些沙门菌变异变迁的关系,以及它们在人、食物、环境之间相互传播的特点,我们运用脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)进行分型研究,并分析其耐药情况。
1 对象与方法
1.1 菌株来源基于军队传染病病原监测平台,从各军区疾病预防控制中心及其哨点医院收集腹泻临床标本,分离获得部分菌株。其他菌株来自上海市疾病预防控制中心对上海地区沙门菌的监测。
1.2 主要试剂与仪器主要为营养琼脂、亚硒酸盐胱氨酸增菌液(selenite cystine broth,SC)、沙门-志贺(Salmonella Shigella,SS)琼脂。药物敏感纸片和MH琼脂购自英国Oxoid公司和北京路桥公司,其他为Api 20E生化板条(法国生物梅里埃)、沙门血清型诊断血清(日本生研)、20 mg/ml蛋白酶K(德国默克Merck)、限制性内切酶XbaI(日本TaKaRa)和PFGE琼脂糖SeaKem Gold Agarose(美国Rock-land)、脉冲场电泳仪CHEFMapper PFGE system及其配套设备(美国Bio-Rad)、Bio-rad Quantity One凝胶成像系统(美国Bio-Rad)、台式高速离心机(德国Eppendorf)、浊度仪(意大利Bio-Merieux)和Bio-Numerics 6.01分析软件(比利时Applied-Maths)。
1.3 细菌分离鉴定及药物敏感试验样品先由SC和SS琼脂等选择培养基进行初筛,然后通过生化板条和血清进行最终确认。按WHO推荐的改良K-B法进行操作,并按照美国临床实验室标准化委员会制定的药物敏感试验抑菌环标准进行判读[10],选用14种抗生素包括四环素、氯霉素、环丙沙星、氧氟沙星、磺胺异噁唑、磺胺甲噁唑甲氧苄啶、甲氧苄氨嘧啶、奈啶酸、氨苄西林、阿莫西林克拉维酸钾、头孢噻呋、头孢吡肟、头孢噻肟、头孢噻甲羧肟。大肠埃希菌ATCC 25922作为质控菌。
1.4 PFGE实验和分析PFGE实验步骤严格按标准操作流程[11]。①胶块制备:用棉签刮取琼脂平板上适量的新鲜菌落于细胞悬浊液,用浊度仪测菌液浊度至4.2。取该菌液400μl到1.5ml离心管,37℃孵育5min,加入20mg/m l的蛋白酶K 20μl及54℃预热的含1%十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)的低熔点琼脂糖SeaKem Gold Agarose 400μl,加入模块,室温下凝固。将胶块置于蛋白酶K的细胞裂解液混合液,54℃水浴摇床中振荡孵育2 h以上。然后用预热的纯水洗2次,TE缓冲液洗4次。②胶块内DNA酶切:从胶块中切下2mm样品,浸入200μl XbaI酶切体系中,37℃水浴作用3 h以上。③加样及电泳:电泳条件为电压6 V/cm,脉冲参数2.16~63.80 s,电泳温度14℃,电泳时间20 h。使用沙门菌H9812作为对照。④电泳图像获取:用溴化乙锭溶液染色30min后,纯水脱色4 h以上,在凝胶成像系统中获取电泳图像。
1.5 统计学处理PFGE结果采用BioNumerics分析软件中非加权组平均法进行聚类分析,条带位置差异容许度选择1.0%,优化值选择0.5%,使用Band based/Dice方法计算不同菌株电泳条带的相似性系数。
2 结果
2.1 菌株分布70株山夫登堡沙门菌中,61株(87.1%)来自于上海市、6株(8.6%)南京市、3株(4.3%)北京市。其中54株(77.1%)分离于人粪便样本,10株(14.3%)分离于各种食品,另外6株(8.6%)分离于环境水。菌株时间分布为2005—2011年,见图1。2005年最少(2株),2008年最多(18株),其他年份分布较为平均。
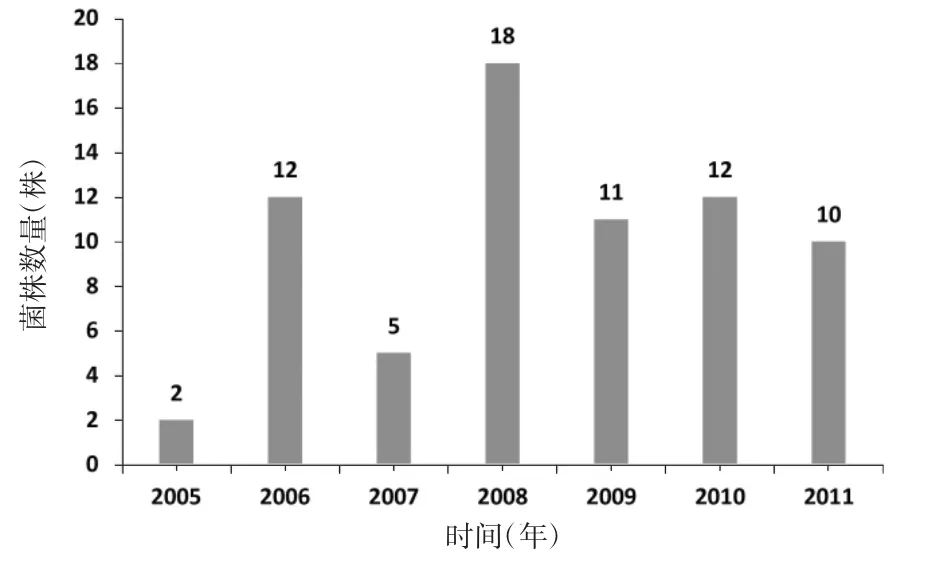
图1 70株山夫登堡沙门菌时间分布Figure 1 Temporal distribution of 70 Salmonella enterica serotype Senftenberg isolates
2.2 药物敏感性(药敏)结果分析70株山夫登堡沙门菌的药敏结果见表1。药敏结果显示,70株山夫登堡沙门菌对不同抗生素的耐药性表现出显著的差异,菌株对于大多数抗生素的耐药率和中介耐药率都低于10%,但是对于磺胺异噁唑,耐药和中介耐药的菌株达到了60%以上。70株山夫登堡沙门菌对头孢类和喹诺酮类药物敏感性较高,但是也出现了3株对头孢噻呋耐药的菌株。
2.3 PFGE结果分析通过BioNumerics软件分析可将70株山夫登堡沙门菌分为42个不同的PFGE带型(图2)。按照90%的相似度,这些PFGE带型可以分为9个大小不一的聚类群,聚类A是最大的1个聚类群,包括19株山夫登堡沙门菌,其中1株分离于北京市,6株属于南京市,其余都属于上海市。值得注意的是,有2株菌分别分离自水源和食品,它们与8株人源山夫登堡沙门菌具有完全一致的PFGE带型。聚类B中包括15株菌,其中4株从食品中分离而来。其他的聚类群包含的菌株数都较少,另外2株来自北京市的菌株形成了1个聚类,而2株2008年的上海市食源菌株与其他菌株的带型差异较大。
3 讨论
沙门菌在自然界中分布广泛,可在人、动物、食品和环境中相互传播,是引起食物中毒和感染性腹泻最常见的致病菌之一[12]。山夫登堡沙门菌也可通过污染环境、食品等感染人和动物[5-8],给公共卫生安全带来潜在威胁。而探究不同地区不同来源山夫登堡沙门菌间的亲缘进化关系,对于非伤寒沙门菌的全面的监测和防控十分重要。目前,PFGE技术已被成功地用于山夫登堡沙门菌的分子分型与亲缘关系研究,并取得了较好的效果[6,13-14]。

表1 70株山夫登堡沙门菌药敏实验结果Table1 Antim icrobial susceptibility results of 70 Salmonella enterica serotype Senftenberg isolates

图2 山夫登堡沙门菌脉冲场凝胶电泳聚类分析Figure 2 Cluster analysis of Salmonella enterica serotype Senftenberg by PFGE
本研究利用PFGE技术对我实验室分离保存的70株山夫登堡沙门菌进行了分子分型,以探究不同地区不同来源山夫登堡沙门菌的变异变迁与传播关系。PFGE结果显示,70株山夫登堡沙门菌具有遗传多态性,共分成了42个不同的PFGE带型,表现出了较高的分辨率。按照90%的相似度,它们可以分为9个大小不一的聚类群,其中聚类A和聚类B分别包含19株和15株菌株,明显多于其他聚类,是2种较为优势的PFGE带型。
聚类A的菌株分离于北京市、上海市、南京市3个地区,PFGE带型相似度在90%以上。根据1995年Tenover等[15]提出的菌株同源性判别标准,当有1~3条带的差别时,菌株为同一克隆,在流行病学上认为它们密切相关,菌株间存在非常近的亲缘关系。这表明聚类A可能是跨区域流行的1个山夫登堡沙门菌亚群。菌株的分离时间跨越了2006—2011中的5个年份,提示它们可能一直都是较为优势的山夫登堡亚群,已经较好地适应了环境。另外,1株水源和1株分离自食品的山夫登堡沙门菌与其他8株人源菌株表现出完全相同的PFGE带型,这些菌株亲缘关系十分密切,很可能是同源菌株在环境、食品和人中相互地播散。正是由于这种特性,导致它们更容易范围性地播散,给公共卫生安全带来巨大威胁。目前已经在国外出现过山夫登堡沙门菌大范围的流行和暴发[16-17],并且现在地区之间的联系和交流越来越紧密,我们也应该加强对山夫登堡沙门菌的监测,警惕这支沙门菌亚群大范围的播散。
而聚类B中的山夫登堡沙门菌都分离于上海市,表明聚类B更有可能为上海地区的一个流行亚群。聚类B中有4株菌从食品中分离而来,还有1株从污水中分离而来。3株食源、1株人源的菌株和污水分离来的菌株表现出完全相同的PFGE带型。以上结果显示,同一山夫登堡克隆可能在污水、食物和人中能相互传播,这与聚类A中的分析结果一致。因此,通过对环境和食品中山夫登堡沙门菌的监测有利于我们分析它们导致人感染事件发生的传播途径,指导我们开展正确的防治措施。
从耐药情况上来看,70株山夫登堡沙门菌对多种抗生素表现出高敏感性,但是对磺胺异噁唑耐药性很高,这可能与抗生素的使用和此类耐药基因容易在群体中扩散有关。虽然这些菌株对头孢和喹诺酮类药物耐药性不高,但是也出现了3株对头孢噻呋耐药的菌株。目前沙门菌感染首选药物是复方磺胺、环丙沙星、头孢噻肟等,本研究结果表明目前的治疗方案较为合理有效。
本研究结果表明,加强不同地区和不同来源山夫登堡沙门菌的监测有利于研究它们之间传播和变异变迁的关系,指导我们做出正确的预防和控制措施。并且山夫登堡沙门菌还有流行暴发的潜在威胁,我们应该做好该类病原体的监测工作,防止山夫登堡沙门菌进一步扩散。
[1]Ma j owicz SE,Mu s to J,Scallan E,etal.The global bu r den of nontyphoidal Salmonella gastroenteritis[J].C lin I nfect Di s,2010,50 (6):882-889.
[2]B a r ton B eh r ave s h C,J one s TF,Vugia D J,et al.Death s a ss ociated with bacte r ial pathogen s t r an s mitted commonly th r ough food:foodbo r ne di s ea s e s active s u r veillance netwo r k(FoodNet),1996-2005[J].J I nfect Di s,2011,204(2):263-267.
[3]P i r e s SM,Vig r e H,Makela P,etal.U s ing outb r eak data fo r s ou r ce att r ibution of human s almonello s i s and campylobacte r io s i s in Eur ope[J].Foodbo r ne P athog Di s,2010,7(11):1351-1361.
[4]毛雪丹,胡俊峰,刘秀梅.用文献综述法估计我国食源性非伤寒沙门氏菌病疾病负担[J].中华疾病控制杂志,2011,15(7):622-625..
[5]Hend r ik s en R S,J oen s en K G,L ukwe s a-Mu s yani C,etal.E x t r emecly d r ug-r e s i s tant Salmonellaenterica s e r ova r Senftenberg infection s in patient s in Zambia[J].J C lin.Mic r obiol,2013,51(1):284-286.
[6]周晓红,商晓春,帅慧群,等.89株山夫登堡沙门菌脉冲场凝胶电泳分子分型及耐药性分析研究[J].疾病监测,2012,27(10): 764-767.
[7]王爱英.山夫登堡沙门菌引起的婴幼儿腹泻分析[J].现代中西医结合杂志,2010,19(16):2043.
[8]P ede rs en T B,O l s en J E,B i s gaa r d M.P e rs i s tence of Salmonella Senftenbe r g in poult r y p r oduction envi r onment s and inve s tigation of it s r e s i s tance to de s iccation[J].Avian P athol,2008,37(4):421-427.
[9]Hu Q,C obu r n B,Deng W,etal.Salmonella enterica s e r ova r Senftenberg human clinical i s olate s lacking S PI-1[J].J C lin Mic r obiol,2008,46(4):1330-1336.
[10]C linical and L abo r ato r y Standa r d s I n s titute.P e r fo r mance s tanda r d s fo r antimic r obial di s k s u s ceptibility te s t s app r oved s tanda r d-eleventhedition[E B/O L].[2014-08-10].http://antimic r obiano s.com.a r/ AT B/wp-content/upload s/2012/11/01-CL S I-M02-A11-2012.pdf.
[11]R ibotEM,Fai r MA,Gautom R,etal.Standa r dization of pul s ed-field gel elect r opho r e s i s p r otocol s fo r the s ubtyping of Escherichia coli O157:H7,Salmonella,and Shigella fo r P ul s eNet[J].Foodbo r ne P athog Di s,2006,3(1):59-67.
[12]崔恩博,陈素明,张成龙,等.2009—2013年我国16省市社区获得性细菌性腹泻病原菌分布及临床耐药分析[J].传染病信息,2014,27(3):143-147.
[13]黄瑛,张新,曲梅,等.脉冲场凝胶电泳技术用于两起山夫登堡沙门菌疫情溯源[J].中国卫生检验杂志,2013,23(6):1575-1576.
[14]B ouma r t Z,R oche SM,L alande F,et al.Hete r ogeneity of pe rs i stence of Salmonella enterica s e r otype Senftenberg s t r ain s could e x plain theeme r genceof thi ss e r otype in poult r y flock s[J].PL oS O ne, 2012,7(4):e35782.
[15]Tenove r F C,A r beit R D,Goe r ing R V,etal.I nte r p r eting ch r omos omal DNA r e s t r iction patte r n s p r oduced by pul s ed field gel elect r opho r e s i s:c r ite r ia fo r bacte r ial s t r ain s typing[J].J C lin Mic r obiol,1995,33(9):2233-2239.
[16]P ezzoli L,El s on R,L ittle C,etal.I nte r national outb r eak of Salmonella Senftenberg in 2007[J].Eu r o Su r veill,2007,12(6):e070613-e070614.
[17]P ezzoli L,El s on R,L ittle CL,et al.P acked with Salmonella--inve s tigation of an inte r national outb r eak of Salmonella Senftenberg infection linked to contamination of p r epacked ba s il in 2007[J]. Foodbo r ne P athog,2008,5(5):661-668.
(2014-08-15收稿 2014-09-25修回)
(责任编委 王永怡 本文编辑 张云辉)
M olecular subtyping of Salmonella enterica serotype Senftenberg from different regions and sources
YISheng-jie,XU Xue-bin,LIHao,LIANG Bei-bei,YANG Chao-jie,WANG-Jian,QIU Shao-fu*,SONG Hong-bin*
College of Basic Medical Sciences,Central South University,Changsha 410078,China
*Corresponding author.QIU Shao-fu,E-mail:qiushf0613@hotmail.com;SONG Hong-bin,E-mail:hongbinsong@263.net
Objective To study the relationship among the Salmonella enterica serotype Senftenberg isolates recovered from different regionsand sourcesand analyze their antimicrobialsusceptibilities.Methods Antimicrobial susceptibilitiesof70 Senftenberg isolateswere performed by K-B disk diffusionmethod,and pulsed field gel electrophoresis(PFGE)molecular subtypingmethod was applied to analyze their genetic relationships.Results Seventy isolates displayed low resistant rates for most antibiotics,but for sulfafurazole,resistant and intermediate resistant isolates reached more than 60%.Additionally,3 isolates displayed resistance to ceftiofur.The results of PFGE analysis showed that 70 isolates could be divided into 42 different PFGE patterns.Some isolates from Shanghai,Beijing and Nanjing,which were isolated from human,food and environment respectively,showed the exactly same PFGE pattern.The results suggested that they had a close relationship.Conclusion Salmonella enterica serotype Senftenberg displays genetic polymorphism and may infect human by the contaminated environment and food.We should enhance surveillance and avoid further dissemination of this pathogen.
Salmonella enterica serotype Senftenberg;antimicrobial susceptibility;pulsed field gel electrophoresis;molecular subtyping
R378.22;R181.2
A
1007-8134(2014)05-0292-04
国家“十二五”科技重大专项(2012ZX10004215);国家自然科学基金(81202252、81373053)
410078长沙,中南大学基础医学院(易胜杰);100071北京,军事医学科学院疾病预防控制所(易胜杰、李浩、梁蓓蓓、杨超杰、王建、邱少富、宋宏彬);200336,上海市疾病预防控制中心(许学斌)
邱少富,E-mail:qiushf0613@hotmail.com;宋宏彬,E-mail: hongbinsong@263.net
