大鼠退变髓核腰交感神经干注射对交感神经干炎症因子表达的影响
2014-06-01卞晶晶唐元章武百山倪家骧
卞晶晶,唐元章,武百山,范 婷,倪家骧*
(1.清华大学玉泉医院麻醉科,北京100049;2.首都医科大学宣武医院疼痛科,北京100053)
大鼠退变髓核腰交感神经干注射对交感神经干炎症因子表达的影响
卞晶晶1,唐元章2,武百山2,范 婷1,倪家骧2*
(1.清华大学玉泉医院麻醉科,北京100049;2.首都医科大学宣武医院疼痛科,北京100053)
目的观察X线引导下大鼠退变髓核腰交感干注射对腰交感神经干炎症因子表达的影响。方法实验用雄性SD大鼠共72只,随机分为三组:空白对照组、假手术组、髓核注射组。髓核注射组大鼠行X线下自体退变髓核悬液右侧腰交感干注射,假手术组注射等剂量生理盐水,空白对照组不做任何处理。注射后14天,取各组大鼠右侧腰交感干行组织学观察,并采用ELISA法定量分析炎性细胞因子IL-1β、IL-6和TNF-α表达变化。结果髓核注射组大鼠腰交感干组织学观察发现有明显的炎性细胞浸润及血管肿胀、充血;ELISA检测发现腰交感干IL-1β(20.1± 4.40pg/ml),IL-6(26.5±8.9pg/ml)及TNF-α(60.77±6.37pg/ml)蛋白含量比空白对照组IL-1β(8.02±1.31pg/ml),IL-6(10.30±1.43pg/ml),TNF-α(24.38±4.81pg/ml)及假手术组IL-1β(7.52±2.11pg/ml),IL-6(11.58± 2.56pg/ml),TNF-α(26.12±6.81pg/ml)表达显著增高(P<0.05)。结论大鼠自体退变髓核导致腰交感神经干炎症因子表达升高可能与盘源性内脏痛的发生有关。
炎症因子;交感干;炎性反应;髓核;大鼠
(Chin J Lab Diagn,2014,18:1567)
腰椎间盘突出症是临床的常见疾病,目前研究认为椎间盘后突出引起腰腿痛的主要原因是髓核外漏导致的脊神经根无菌性炎症[1-3]。腰椎间盘前突出在临床上并不少见[4]。由于腰交感神经干紧邻腰椎前方分布,因此,腰椎间盘前突出导致的无菌性炎症在理论上会刺激腰交感神经干产生交感神经相关症状;虽然交感神经的疼痛传导通路已经被证实[5,6],但是椎间盘前突与腰交感神经相关症状之间的关系在临床尚未被引起重视。本实验拟采用改良的X线引导下大鼠椎间盘退变模型,通过腰交感神经干周围注射大鼠退变髓核悬液,采用腰交感干组织学观察及ELISA法进行细胞因子检测观察大鼠退变髓核悬液对交感神经的致炎作用,以期揭示椎间盘前突导致交感神经炎性病变的产生,为临床上“椎间盘源性内脏痛”的发病机制提供理论依据。
1 材料和方法
1.1 主要试剂
ELISA试剂盒(IL-1β,IL-6,及TNF-α)购于美国R&D公司。造影剂(omnipaque-180dye)购于通用电气药业(上海)有限公司。
1.2 实验动物及分组
实验动物为雄性SD大鼠,8-10周,体重250-300g,由北京维通利华实验动物中心提供。所有实验动物适应环境3天后进入实验。所有的实验动物单笼饲养,72只大鼠随机分为空白对照组(n=24)、假手术组(n=24)和髓核注射组(n=24)。
1.3 动物模型制作
假手术组及髓核注射组动物建立大鼠退变髓核模型。大鼠退变髓核模型的建立参考Zhang等报道的方法[7],并改进为X线引导下穿刺,提高模型成功率及穿刺准确程度,减少损伤。具体方法为:在X线引导下,将21号穿刺针平行于尾椎终板,穿刺至Co4/5到Co8/9椎间盘中心。数秒之后,穿刺针拔出,局部压迫止血。
大鼠退变髓核模型建立2周之后,髓核注射组大鼠苯巴比妥钠麻醉后断尾,3-0丝线缝合断尾处。取尾椎Co4/5到Co8/9椎间盘髓核,见髓核呈胶冻样,将5个髓核混匀于0.5ml生理盐水。断尾缝合之后的大鼠至于X线下,取俯卧位,采用21号穿刺针(3.8cm长)在X线引导下穿刺与L2/3椎体右前外侧,正、侧位透视确定穿刺针位置,穿刺针穿刺到位后,缓慢注射0.5ml造影剂(omnipaque-180 dye),显示造影剂沿椎体前外侧上下扩散呈线性,证实穿刺到位。穿刺位置确定后10min,缓慢注射之前准备的0.5ml髓核混悬液于腰交感干周围。注射完毕后,缓慢退针,穿刺点局部压迫止血。假手术组行断尾术,腰交感干周围同样方法注射0.5ml生理盐水。空白对照组不行任何处理。
1.4 腰交感干组织学观察
腰交感干切片行HE(Hematoxylin and eosin)染色观察组织形态学变化。腰交感干注射后14天,每组大鼠随机取6只,苯巴比妥钠麻醉后行右侧L(Lumber)1-5交感干取出术。取出腰交感干标本先用10%甲醛液固定1天,再在0.003MEDTA,1.35NHCl溶液中脱钙24小时,石蜡固定,冠状切片(5μm),HE染色,镜下观察腰交感干组织学变化。
1.5 ELISA检测腰交感干细胞因子IL-1β,IL-6,及TNF-α蛋白含量
腰交感干注射后14天,采用ELISA检测方法定量分析大鼠右侧L1-5腰交感干IL-1β,IL-6,及TNF-α蛋白含量。因为大鼠单个腰交感干样本太小,定量分析数值太小很难测定,因此我们将每组中剩余18只大鼠随机每三只腰交感干合为一组,因此合并为6个检验样本。样本称重匀浆后,严格按照ELISA试剂盒操作顺序进行蛋白测定,蛋白浓度单位pg/ml。
1.6 统计学分析
采用SPSS17.0软件进行统计分析。ELISA检测数据以均数加减标准差(x—±s)表示,组间比较用单因素方差分析,以P<0.05认为有统计学意义。
2 结果
2.1 腰交感干组织学观察
大鼠腰交感干注射后14天,髓核注射组大鼠腰交感干切片HE染色可见明显的神经髓鞘内血管肿胀充血、炎性细胞浸润,提示腰交感干炎症反应的发生;空白对照组和假手术组腰交感干切片HE染色未见有明显的炎症反应(图1)。

图1 大鼠右侧L1-5腰交感干组织学观察镜下所见。石蜡切片空白对照组(A),假手术组(B)和髓核注射组(C)。髓核注射组可见明显的交感干炎症反应发生。直箭头:炎性细胞,燕尾箭头:血管肿胀和充血。HE×400
2.2 ELISA方法检测腰交感干IL-1β,IL-6,及TNF-α蛋白含量
腰交感注射后14天收集大鼠右侧L1-5腰交感干采用ELISA法定量分析IL-1β,IL-6,及TNF-α蛋白含量。髓核注射组IL-1β(20.1±4.40pg/ml),IL-6(26.5±8.9pg/ml)及TNF-α(60.77±6.37 pg/ml)蛋白含量明显比空白对照组IL-1β(8.02± 1.31pg/ml),IL-6(10.30±1.43pg/ml),TNF-α(24.38±4.81pg/ml)及假手术组IL-1β(7.52± 2.11pg/ml),IL-6(11.58±2.56pg/ml),TNF-α(26.12±6.81pg/ml)显著升高,有统计学意义(P<0.05);提示交感神经干炎症的发生。假手术组与空白对照组相比,无明显统计学差别(P>0.05,图2)。
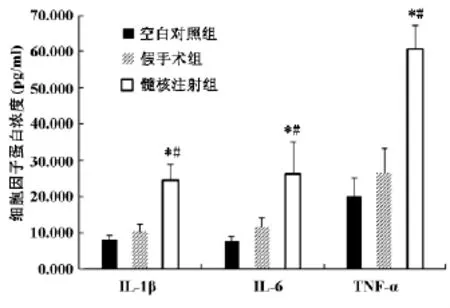
图2 ELISA检测各组大鼠右侧L1-5腰交感干细胞因子IL-1β,IL-6,及TNF-α表达。*示与空白对照组相比有统计学意义(P<0.05),#示与假手术组相比有统计学意义(P<0.05)。
3 讨论
虽然腰椎间盘前突出已经被认为是椎间盘突出的类型之一,但是,椎间盘前突导致的症状常被临床忽视。Wong-Chung等[8]报道一例因椎间盘前突而导致腹痛的患者,作者推测椎间盘前突导致的交感神经炎症反应是该患者腹痛的主要原因。我们在前期[9]进行了一项腰椎间盘前突导致内脏痛的临床队列研究,应用单次交感神经阻滞技术评价患者的内脏痛来源于椎间盘前突出导致的交感神经炎症,对于单次交感神经阻滞有效的患者,给予CT引导下腰交感干置管,连续抗炎治疗。结果发现连续抗炎治疗对该类患者都取得明显效果,推测腰椎间盘前突、髓核外漏导致的交感神经炎症是盘源性内脏痛的主要原因。
炎性细胞因子在机体炎症反应中的作用已经被广泛研究,而且,炎性细胞因子的表达已经开始作为椎间盘后突出导致局部炎症反应的标记性物质。Andrade等[10]报道椎间盘突出患者间盘可分泌IL-1β和IL-6;de Souzaet等[11]报道大鼠椎间盘变性可分泌高浓度的IL-1和TNF-α。Zhang等[7]报道在椎间盘突出患者可在背根结发现有大量TNF-α表达阳性神经元。但是,细胞因子可以从退变椎间盘分泌,同时也可以从椎间盘退变导致局部炎症反应的炎性细胞分泌。Rand等[12]进一步研究报道体外培养椎间盘退变导致局部浸润的炎性细胞可分泌比正常细胞高75倍的IL-6,150倍的IL-10,但是IL-1和TNF-α分泌无增加,IL-1和TNF-α可能是在退变椎间盘细胞分泌的。因此,从上述研究来看,IL-1β,IL-6和TNF-α分泌可能来自于不同的细胞,包括椎间盘退变诱导的局部浸润炎性细胞和退变椎间盘自身细胞,因此,我们选用IL-1β,IL-6和TNF-α这三个细胞因子来检测,以证实局部炎症的产生。
我们应用先前研究椎间盘后突出导致脊神经根炎症的方法,将自体退变髓核注射于交感神经干周围,交感神经干组织学切片发现有明显的神经内血管扩张,大量炎性细胞浸润;并进一步应用ELISA法检测了交感神经干细胞因子含量,发现IL-1β,IL-6和TNF-α都显著增高;提示自体退变髓核引起明显的交感神经干炎症反应。
本实验结果证实:髓核前漏出会导致相邻交感神经的无菌性炎症的产生。该结论提示椎间盘源性内脏痛可能是由于腰椎前方腰交感神经干自体退变髓核导致的无菌性炎症累及导致的,同时为腰交感神经抗炎治疗盘源性内脏痛提供了理论依据。
[1]Sasaki N,Sekiguchi M,Shishido H,et al.A comparison of painrelated behavior following local application of nucleus pulposus and/or mechanical compression on the dorsal root ganglion[J].Fukushima J Med Sci,2011,57(2):46.
[2]Ahn U M,Ahn N U,Buchowski J M,et al.Cauda equina syndrome secondary to lumbar disc herniation:a meta-analysis of surgical outcomes[J].Spine(Phila Pa 1976),2000,25(12):1515.
[3]Bonaroti E A,Welch W C.Posterior epidural migration of an extruded lumbar disc fragment causing cauda equina syndrome.Clinical and magnetic resonance imaging evaluation[J].Spine(Phila Pa 1976),1998,23(3):378.
[4]Garg K,Nagi O N,Suri S,et al.CT of anterior intervertebral disc herniation[J].Australas Radiol,1988,32(4):458.
[5]Geiss A,Larsson K,Junevik K,et al.Autologous nucleus pulposus primes T cells to develop into interleukin-4-producing effector cells:an experimental study on the autoimmune properties of nucleus pulposus[J].J Orthop Res,2009,27(1):97.
[6]Murai K,Sakai D,Nakamura Y,et al.Primary immune system responders to nucleus pulposus cells:evidence for immune responsein disc herniation[J].Eur Cell Mater,2010,19:13.
[7]Zhang K B,Zheng Z M,Liu H,et al.The effects of punctured nucleus pulposus on lumbar radicular pain in rats:a behavioral and immunohistochemical study[J].J Neurosurg Spine,2009,11(4):492.
[8]Wong-Chung J K,Naseeb S A,Kaneker S G,et al.Anterior disc protrusion as a cause for abdominal symptoms in childhood discitis.A case report[J].Spine(Phila Pa 1976),1999,24(9):918.
[9]Tang Y Z,Shannon M L,Lai G H,et al.Anterior herniation of lumbar disc induces persistent visceral pain:discogenic visceral pain:discogenic visceral pain[J].Chin Med J(Engl),2013,126(24):4691.
[10]Andrade P,Hoogland G,Garcia M A,et al.Elevated IL-1beta and IL-6levels in lumbar herniated discs in patients with sciatic pain[J].Eur Spine J,2013,22(4):714.
[11]de Souza G A,Ferrari L F,Defino H L.Cytokine inhibition and time-related influence of inflammatory stimuli on the hyperalgesia induced by the nucleus pulposus[J].Eur Spine J,2012,21(3):537.
[12]Rand N,Reichert F,Floman Y,et al.Murine nucleus pulposusderived cells secrete interleukins-1-beta,-6,and-10and granulocyte-macrophage colony-stimulating factor in cell culture[J].Spine(Phila Pa 1976),1997,22(22):2598.
The effects of degenerative autologous nucleus pulposus injected to lumbar sympathetic trunk on expression of inflammatory cytokine in rats
BIAN Jing-jing1,TANG Yuan-zhang2,WU Bai-shan2,et al.(1.Department of anesthesiology,Yuquan Hospital of Tsinghua University,Beijing100049,China;2.Department of Pain Management,Xuanwu Hospital of Capital Medical University,Beijing100053,China)
ObjectiveThe aim of the study was to observe the inflammatory response of sympathetic trunk by autologous degenerative nucleus pulposus(NP)injection under fluoroscopy.MethodsA total 72rats was used,which divided in 3group:naïve group,sham group and NP-treated group.24rats in NP-treated group,autologous NP suspension was injected to right sympathetic trunk.14days after injection,right lumbar sympathetic trunk was harvested for histological assessment and ELISA quantitative determination of IL-1β,IL-6,and TNF-αprotein.ResultsIn the NP treated group,endoneural hyperemia and intensive infiltration of inflammatory cells can be seen in section of sympathetic trunk by Hematoxylin and Eosin(HE)stained,Meantime,elevated concentration of IL-1β(20.1±4.40pg/ml),IL-6(26.5 ±8.9pg/ml)and TNF-α(60.77±6.37pg/ml)by ELISA of sympathetic trunk in NP-treated group compared to naïveIL-1β(8.02±1.31pg/ml),IL-6(10.30±1.43pg/ml),TNF-α(24.38±4.81pg/ml)and controlIL-1β(7.52± 2.11pg/ml),IL-6(11.58±2.56pg/ml),TNF-α(26.12±6.81pg/ml)group(P<0.05).ConclusionElevated expression of inflammatory cytokine,which caused by degenerative autologous nucleus pulposus injected to lumbar sympathetic trunk,may be related to discogenic visceral pain.
inflammatory cytokine;sympathetic trunk;inflammation;nucleus pulposus;rat
R338.7
A
2014-01-20)
*通讯作者
