A-NK细胞促口腔鳞状细胞癌凋亡效应的研究
2014-06-01郭也也吴紫莺
万 哲,刘 红,张 真,许 垚,郭也也,吴紫莺,刘 映,祝 军*
(1.新疆医科大学附属中医医院口腔科,新疆乌鲁木齐830000;2.中南大学湘雅医学院临床专业,湖南长沙410000)
A-NK细胞促口腔鳞状细胞癌凋亡效应的研究
万 哲1,刘 红1,张 真1,许 垚2,郭也也2,吴紫莺2,刘 映2,祝 军1*
(1.新疆医科大学附属中医医院口腔科,新疆乌鲁木齐830000;2.中南大学湘雅医学院临床专业,湖南长沙410000)
目的通过观察A-NK细胞对裸鼠舌鳞状细胞癌移植瘤模型的体外生长特点以及口腔鳞状细胞癌(OSCC)凋亡指数的检测,探讨A-NK细胞对OSCC的免疫治疗机制。方法建立裸鼠舌鳞癌皮下移植瘤模型,随机分为对照组、A-NK细胞组和NA-NK细胞组,观察33天后瘤重,绘制肿瘤生长曲线;OSCC组织标本经末端脱氧核苷酸转移酶介导的UTP缺口标记(TUNEL)染色以鉴定凋亡细胞,并由阳性细胞百分比表示细胞凋亡指数(AI)。结果ANK细胞组第15天开始肿瘤体积显著小于对照组(P<0.05);NA-NK细胞组第27天后肿瘤体积显著小于对照组(P<0.05);A-NK细胞组第30天肿瘤体积显著小于NA-NK细胞组(P<0.05),且三组荷瘤裸鼠肿瘤生长重量均有明显差异,差异有统计学意义(P<0.05)。NK组病例活检癌组织AI为(0.71±0.66)%,A-NK组织AI为(1.76±0.83)%,二者间有显著性差异(P<0.01);对照组癌组织AI为(0.34±0.69)%,与前二者间有显著性差异(P<0.01)。结论 A-NK细胞和NA-NK细胞均可在裸鼠体内诱导明显的抗肿瘤效应,且A-NK的抑瘤作用大于NA-NK细胞。NK细胞对口腔鳞状细胞癌具有免疫杀伤效应,该作用是通过诱导靶细胞凋亡实现的。
A-NK细胞;NA-NK细胞;舌鳞状细胞癌;裸鼠移植瘤;抗肿瘤效应
(Chin J Lab Diagn,2014,18:1582)
A-NK细胞被认为是一个表型和功能独特的NK细胞亚群,具有高水平的NK细胞毒性和增殖能力,本课题旨在探索A-NK细胞在口腔鳞癌治疗中的作用效果,为A-NK细胞的临床应用提供动物实验基础。
1 材料与方法
1.1 仪器及试剂
人舌鳞状细胞癌细胞系Tca8113-Tb(上海交通大学医学院附属第九人民医院肿瘤生物实验室),BALB/C-nu/nu裸小鼠(上海斯莱克实验动物有限公司),磁珠分选仪((德国美天旎生物技术有限公司)),淋巴细胞分离液(sigma公司),rhIL-2(南京军区军事医学研究所),RPMI1640培养液(Gibco)。试剂蛋白酶K、辣根过氧化物酶标记的链霉亲和素购自日本Wako公司,TdT Buffer、TdT、DTT、Biotin-16-dUTP、CoCl2购自瑞士Roche公司,dATP购自美国Phamacia Biotech公司,3,3’-diaminobenzydine(DAB)购自日本Dojin公司。
1.2 实验方法
1.2.1 NK细胞的分离纯化 无菌抽取正常人群外周血,用淋巴细胞分离液分离出单个核细胞,经贴壁粘附和尼龙毛柱粘附去除单核细胞和B细胞。将上述分离去除单核细胞和B细胞后取得的单个核细胞(PBMC)溶红素处理,平衡盐充分洗涤后,加入到CD56单抗包被的磁珠系统中孵育,平衡盐再次洗涤,于miniMACS分离器磁场中上柱分选,平衡盐洗柱收集细胞。免疫磁珠仪检测所得细胞表面CD3,CD56分子,分析NK细胞回收率和纯化率。
1.2.2 A-NK和NA-NK细胞的分离 取免疫磁珠分选的高纯度NK细胞,用a-MEM培养基调整细胞浓度为2×106/ml,置于无菌塑料平皿中,与6000U/ml IL-2水平培养3h(37℃5%CO2)。用温a-MEM培养基洗脱收集非粘附的NA-NK细胞4次。加入PBS(含0.02w/vEDTA)4℃放置10min,冷a-MEM洗3次,收集粘附的A-NK细胞。
1.2.3 A-NK细胞和NA-NK细胞的体外扩增分别将收集的A-NK细胞和NA-NK细胞,用a-MEM培养基调整细胞浓度为2×106/ml,加入200 U/ml IL-2,培养于24孔板中。每3天更换新鲜培养液,补充细胞因子,保持细胞因子终浓度不变,细胞浓度在(3~4)×106/ml,并计数细胞,绘制出细胞生长曲线。
1.2.4 人舌鳞癌细胞皮下成瘤裸鼠模型的建立
取指数增殖期Tca8113细胞,用0.25%胰蛋白酶消化制成单细胞悬液,调整细胞密度至1.0×107/ml,台盼蓝染色计数活细胞占95%以上。于每只裸鼠右前肢背部皮下接种2.0×106个(0.2ml)细胞,33天后处死,分离移植瘤,10%甲醛固定、脱水、石蜡包埋、制片(4μm厚),HE染色,光学显微镜下观察。1.2.5 A-NK细胞免疫功能增强对口腔癌的效应
动物接种Tca8113细胞方法同人舌鳞癌细胞皮下成瘤裸鼠模型的建立。接种后第3天,将裸鼠随机分为3组,每组7只,分别为对照组、NA-NK细胞组和A-NK细胞组。对照组每2天于接种肿瘤细胞的局部皮下注射0.1ml生理盐水,NA-NK细胞组和A-NK细胞组每2天于接种肿瘤细胞的局部皮下分别注射相应细胞0.1ml(5.0×106)个,共注射3次。于接种肿瘤细胞2周后每3天用游标卡尺测量移植瘤的最小径a、最大径b,计算出移植瘤体积V=a2b/2,并得出裸鼠移植瘤体积生长曲线。第33天断颈处死小鼠,剥取移植瘤称重。
1.2.6 A-NK细胞对口腔鳞状细胞癌的凋亡诱导效应 ①TUNEL法具体操作按Roche试剂所附说明书进行。标记反应结束后,DAB显色,苏木精轻度复染,二甲苯透明,封片。②TUNEL结果评价方法,在200倍镜头下,每枚切片选择5处不同视野,辨别凋亡细胞,发生凋亡的细胞其核呈棕黄色,在癌组织中散在分布。凋亡细胞数占肿瘤细胞总数的百分比确定为AI。
1.3 统计学处理
采用SPSS 18.0软件系统的配对样本t检验、χ2检验及Kaplan-Meier法Log Rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 分离A-NK细胞和NA-NK细胞
本研究采用免疫磁珠技术对NK细胞进行分离纯化,计数细胞结果显示:A-NK细胞数占41%,NA-NK细胞数占59%。
2.2 A-NK细胞的体外增殖能力
A-NK细胞在a-MEM培养基中生长良好,细胞透亮有光泽,贴附于器皿底部(见图1),加入IL-2刺激因子后,A-NK细胞在第15天达到增殖高峰,NANK细胞于第12天达到增殖高峰。培养3周后,ANK细胞共增加39.33倍,NA-NK细胞仅增加16.33倍(见图2)。
2.3 人舌鳞癌细胞皮下成瘤裸鼠模型的建立
刚接种舌鳞癌细胞的裸鼠均可见圆形小皮丘,第2天后消退,接种肿瘤细胞2周后,肿瘤开始缓慢生长,于18天后出现快速生长期。HE染色可见大量的舌鳞状细胞癌细胞,细胞巢状排列,呈多角型,核大,深染,部分肿瘤细胞蜕变坏死,并伴有淋巴细胞浸润,提示建模成功(见图3)。
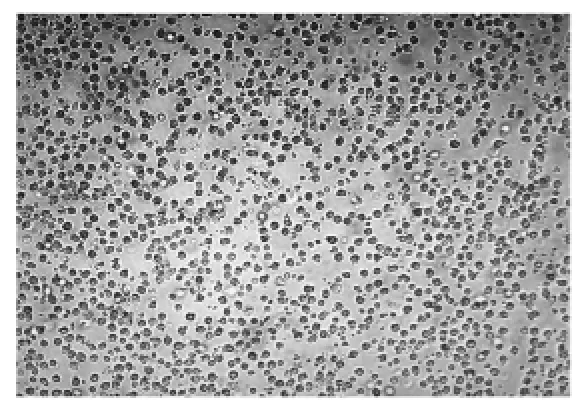
图1 A-NK细胞的体外培养(X20倍)

图2 A-NK细胞与NA-NK细胞生长曲线比较
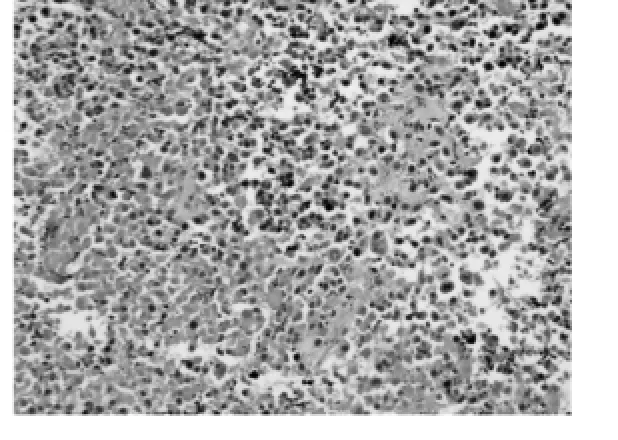
图3 舌鳞癌细胞的HE染色(X200)
2.4 A-NK细胞对裸鼠移植瘤的抑制作用
A-NK细胞组第15天开始肿瘤显著小于对照组,各时间点均P<0.05;NA-NK细胞组第27天后肿瘤显著小于对照组,P<0.05;A-NK细胞组第30天肿瘤显著小于NA-NK细胞组,P<0.05。实验结果提示局部应用A-NK细胞和NA-NK细胞对裸鼠口腔鳞癌移植瘤均有明显的抑制作用,但ANK细胞组对肿瘤的抑制作用强于NA-NK细胞组(见图4)。
2.5 三组裸鼠的瘤重比较
第33天,A-NK细胞组肿瘤重量显著较对照组轻,P<0.05;NA-NK细胞组肿瘤重量显著较对照组轻,P<0.05;A-NK细胞组肿瘤重量显著较NA-NK细胞组轻,P<0.05(见表1)。见图5。

表1 第33天各组裸鼠移植瘤重量(均数±标准差)
2.6 NK细胞对口腔鳞状细胞癌的凋亡诱导作用
NK组病例活检癌组织AI为(0.71±0.66)%,A-NK组织AI为(1.76±0.83)%,二者间有显著性差异(P<0.01);对照组癌组织AI为(0.34± 0.69)%,与前二者间有显著性差异(P<0.01)。
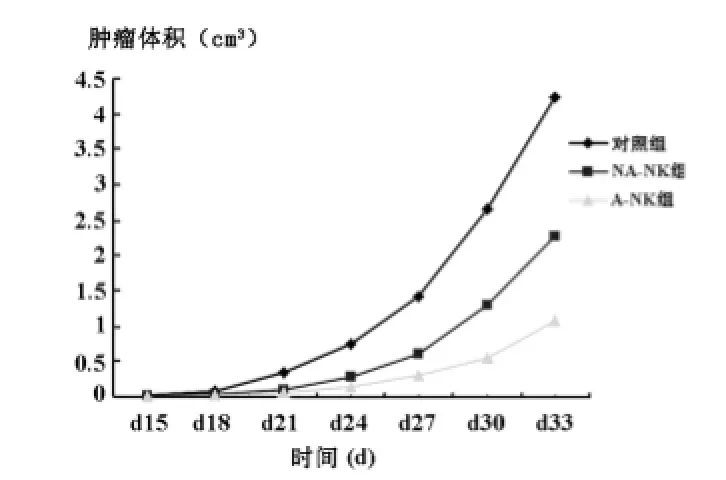
图4 裸鼠移植瘤体积生长曲线
图5 三组裸鼠的肿瘤标本
3 讨论
口腔鳞状细胞癌(OSCC)是由上皮组织恶变而来的口腔恶性肿瘤,约占口腔颌面部恶性肿瘤的80%以上,发病率高。尽管口腔鳞癌的治疗水平不断提高,经过以手术、放疗和化疗为主的综合序列治疗后5年生存率已达到64%左右,但仍有多于1/3的患者5年内死于肿瘤的局部复发和(或)远处转移,严重危害人类健康。因此,进一步阐明影响口腔鳞癌发生、发展和预后的分子机制,设计新型诊断方法和有效治疗药物,对于提高口腔鳞癌患者的生存率和生存质量具有十分重要的现实意义。
A-NK细胞(Adherent natural killer)是近年发现的表型和功能独特的NK细胞亚群,具有高水平的NK细胞毒性和增殖能力,能识别“自己”和“非己”,对自身细胞无杀伤作用,在体外和体内实验中均表现出强大的抗肿瘤和抗转移作用。但其在人体血液中数量较少,需体外扩增以达到临床级别的细胞数量[1,2]。体外培养NK细胞主要分为两个过程:贴壁和生长,细胞黏附至培养介质上,进而铺展,这是贴壁细胞生长的必要条件。须珏华等[3]对兔骨髓间充质干细胞在DMEM-HG,DMEM-LG,a-MEM三种培养基中贴壁效果进行实验研究,发现a-MEM有利于细胞贴附,本研究中采用a-MEM培养基,A-NK和NA-NK细胞贴服于培养基底,生长状态良好。A-NK细胞具有强大的体外扩增能力,有研究报道在IL-2参与下96hA-NK细胞增殖比NA-NK细胞快[4],本研究中A-NK细胞和NA-NK细胞培养3周后,A-NK细胞共增加39.33倍,NANK细胞仅增加16.33倍,提示A-NK细胞的增殖能力强于NA-NK细胞,也证实了这一实验研究。
良好的动物模型是研究肿瘤治疗干预途径的前提条件,SCID(Severe Combined Immune-deficiency)小鼠即严重免疫缺陷小鼠,是一种先天性B与T淋巴细胞双重免疫缺陷动物,可成为肿瘤免疫治疗的良好活体承载系统。但普通SCID小鼠有渗漏(Leaky)现象,约有2%-3%的子代具有少量的淋巴样细胞,且可产生少量免疫球蛋白。本研究选用的是SCID/BG小鼠,它是BALB/c-beige/beige同源近交系小鼠将beige基因引入C.B-17SCID小鼠体内,其体内NK细胞活性降低,且渗漏现象大幅降低,优于普通的SCID小鼠。
本研究中,A-NK细胞组第15天开始肿瘤显著小于对照组,NA-NK细胞组第27天后肿瘤显著小于对照组,可以证明局部应用A-NK细胞与NA-NK细胞均有显著抑瘤作用。A-NK细胞组第30天肿瘤显著小于NA-NK细胞组,提示A-NK细胞的抑瘤作用显著强于NA-NK细胞。
本研究中发现,NK细胞可以有效的诱导口腔鳞状细胞癌的瘤细胞凋亡,从而发挥抑制肿瘤的作用,而其中A-NK细胞的凋亡诱导作用明显强于NK细胞。因此,NK细胞系对于口腔鳞状细胞癌具有有效地免疫抑制作用。可能通过多种机制抑制肿瘤细胞:(1)通过穿孔素和颗粒酶介导途径,二者的协同作用可使A-NK细胞产生最佳效应的细胞毒作用;(2)直接接触肿瘤细胞发挥杀伤作用,NK细胞表达的TNF死亡配体可与肿瘤表面的死亡受体相结合发挥杀伤效应。(3)细胞因子介导途径,A-NK细胞分泌多种细胞因子,通过破坏肿瘤微循环或改变靶细胞表面的pH值,糖代谢等方式杀死肿瘤细胞。(4)ADCC介导途径[5]。本实验中发现肿瘤细胞凋亡与坏死同时存在,推断可能是多种机制共同作用的结果。
本研究提示A-NK细胞能有效抑制裸鼠舌鳞癌移植瘤的生长,但目前国内外对其研究还停留在基础实验阶段,其具体作用机制尚不明确,因此ANK细胞直接用于临床受多方面因素制约,尚需对A-NK细胞免疫功能重建进行更断深入探索研究,为临床应用提供合理依据。
[1]Chang DT,Colton E,Matsuda T,et al.Lymphocyte adhesion and interactions with biomaterial adherent macrophages and foreign body giant cells[J].J Biomed Mater Res A,2009,91(4):1210.
[2]Wei J,Satomi M,Negishi Y,et al.Effect of sera on the adhesion of natural killer cells to the endothelium in severe pre-eclampsia[J].J Obstet Gynaecol Res,2006,32(5):443.
[3]须珏华,胡静波,周 燕,等.培养基对兔骨髓问充质干细胞扩增与分化的影响[J].中国组织工程研究与临床康复,2007,11(3):467.
[4]蓝毓滨,蓝毓进,蓝毓新.A-NK细胞联IL-2,IL-12在肿瘤免疫治疗中的作用[J].生物磁学,2006,6(1):79.
[5]ChanCJ,Smyth MJ,Martinet L.Molecular mechanisms of natural killer cell activation in response to cellular stress[J].Cell death and differentiation,2013,21(1):5.
The experimental research of A-NK Cells and NA-NKcells on Tumor Growth Inhibition of Humantongue squamous cell car-cinoma
WAN Zhe,LIU Hong,ZHANG Zhen,et al.(Department of Stomatology,Affiliated Traditional Chinese Medicine Hospital,Xin jiang Medical University,Urumqi 830000,China)
ObjectiveBy observing the external growth and hyperplasia of A-NK cell,To explore the treatment effect and mechanism of A-NK on the subcutaneous transplanted tumor of tongue squamous cell carcinoma in nude mice.And provide the experimental foundation in clinical use of such treatment strategies for tongue squamous carcinoma.MethodsThe subcutaneous nude mice model with Tca8113cells was established and randomly assigned to three groups.Every group had 7nude mice.The control Group injected with normal saline,The experimental group injected with A-NK cells and NA-NKcells,All animals were killed after 33days,The tumor volumes and weight in each group were measured and to draw the curve of tumor growth.ResultsThe Volume of nude mice tumor in A-NK group is smaller than the control group after 15days(P<0.05);The Volume of nude mice tumor in NA-NK group is smaller than the control Group after 27days(P<0.05);and the Volume of nude mice tumor in A-NK group is smaller than theNA-NK Group after 30days(P<0.05),There were significant differences among the three groups in terms of the weight of nude mice tumor(P<0.05).ConclusionA-NK cells and NA-NK cells can significantly inhibit the subcutaneous transplanted tumors of nude mice and the A-NK group is stronger than the NA-NK group.
A-NK cells;NA-NK cells;Tongue squamous cell carcinoma;Nude mice model;Anti-tumor effect
R739.81
A
2013-09-11)
1007-4287(2014)10-1582-04
新疆维吾尔自治区科技支疆项目(201191158)
*通讯作者
