核转录因子-κB在动脉粥样硬化缺血性脑卒中模型大鼠脑组织中的表达1)
2014-05-29乔彬峻段虎斌皇甫斌范益民杨晓明
乔彬峻,段虎斌,皇甫斌,范益民,杨晓明
缺血性脑卒中(CIS)是严重威胁人类健康的疾病,其病因主要是由于脑动脉粥样硬化(AS)致血管管腔狭窄、阻塞等导致脑组织缺血、缺氧、变性、坏死而引起的[1]。本研究通过检测核转录因子-κB(NF-κB)在动脉粥样硬化缺血性脑卒中大鼠脑组织中的表达规律,研究动脉粥样硬化缺血性脑卒中的病理生理机制。
1 材料与方法
1.1 实验动物与分组 成年雄性Wistar大鼠48 只,体重265 g±15g,购自山西医科大学实验动物中心,随机分为对照组(8只)、AS模型组(40只),AS模型建立后又随机分为AS 模型假手术组及AS模型持续缺血0.5h、6h、12h、24h组,每组8只。
1.2 模型建立
1.2.1 大鼠动脉粥样硬化模型建立 对照组给予基础饲料,AS模型组均给予高脂饲料(2%胆固醇、0.2%猪胆盐、0.2%丙基硫氧嘧啶、10%猪油、87.6%基础饲料)喂养,自由摄水。喂食量为每只每天30g~40g,整个试验周期为6个月[2]。
1.2.2 动脉粥样硬化基础上缺血性脑卒中模型建立[3]参考Takeshi等方法制作双侧颈总动脉(2VO)结扎模型[4]。实验前动物禁食8h,自由饮水,称重,10%水合氯醛0.3mL/kg 进行腹腔注射麻醉,仰卧位,固定,沿颈中线切开,分离出双侧颈总动脉。对照组及AS 模型假手术组:仅作双侧颈总动脉分离,不结扎;AS 模型持续缺血组:采用外科3-0尼龙线永久结扎双侧颈总动脉,于相应时间点断头取脑,做免疫组化实验。
1.3 免疫组化实验检测脑组织NF-κB表达情况 将所取脑组织浸入甲醛中固定,蜡块包埋。制作石蜡切片,常规脱蜡至水,抗原热修复,正常山羊血清封闭。滴加比例适当稀释的一抗(按1∶200稀释,北京博奥森生物技术有限公司,bs-0465R),4℃湿盒过夜,磷酸盐缓冲液(PBS)漂洗,滴加生物素化二抗工作液,37℃孵育,PBS漂洗,滴加辣根酶标记链霉卵白素工作液,37 ℃孵育,PBS 漂洗,DAB 显色,常规复染,二甲苯透明,封片。
1.4 图像分析 应用MIAS-2000 图像分析系统进行定量分析[5],记录免疫组化结果中的平均光密度值。
1.5 统计学处理 采用SPSS 13.0软件分析,计量资料以均数±标准差表示。组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结 果
对照组和AS模型假手术组大鼠脑组织NF-κB 免疫组化染色阳性颗粒在脑组织中有少量表达,二者比较无统计学意义(P>0.05),在AS模型持续缺血各组脑组织中有不同程度NF-κB阳性表达,且主要分布于缺血区及其周边区。各AS模型持续缺血组与对照组比较,脑组织NF-κB 表达均有统计学意义(P<0.05);与AS模型假手术组比较有统计学意义(P<0.05),各AS模型持续缺血组比较有统计学意义(P<0.05)。详见表1。
表1 对照组及模型各组脑组织NF-κB表达情况 PU
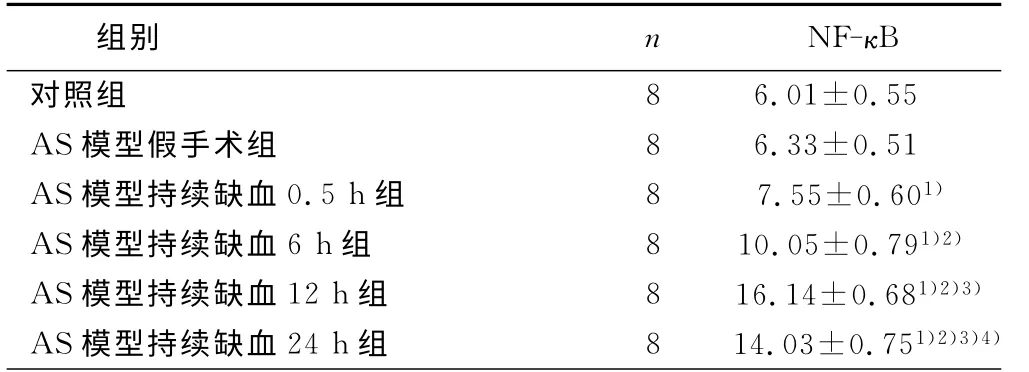
表1 对照组及模型各组脑组织NF-κB表达情况 PU
与对照组及假手术比较组比较,1)P<0.05;与AS模型持续缺血0.5h组比较,2)P<0.05;与AS模型持续缺血6h组比较,3)P<0.05;与AS模型持续缺血12h组比较,4)P<0.05。
组别 n NF-κB对照组 8 6.01±0.55 AS模型假手术组 8 6.33±0.51 AS模型持续缺血0.5h组 8 7.55±0.601)AS模型持续缺血6h组 8 10.05±0.791)2)AS模型持续缺血12h组 8 16.14±0.681)2)3)AS模型持续缺血24h组 8 14.03±0.751)2)3)4)
3 讨 论
缺血性脑卒中后常出现脑水肿,引起颅内压增高、脑组织继发性损伤等,成为影响缺血性脑损伤疗效的重要因素。越来越多的研究结果显示,NF-κB的活化是缺血性脑卒中后继发性损伤的一个重要枢纽。NF-κB是1986年Sen和Baltimore首先从B淋巴细胞核提取物中检测出的一种蛋白因子[6],它能与免疫球蛋白κ轻链基因的增强子κB序列特异结合,它也是一种具有多项转录激活功能的调节因子。正常情况下,大多数细胞中NF-κB与其抑制蛋白(Inhibitory Kappa B,IκB)结合形成复合体,IκB覆盖于NF-κB的核定位信号区,复合体以非活化状态下存在于静止期细胞的胞浆中。当诱导因子刺激时,由信号诱导激活的IκB激酶引起IκBa蛋白第32和36位丝氨酸的磷酸化,磷酸化的IκBQ 由泛素蛋白在多个位点形成泛素化。最后,泛素化的IκBa被26S蛋白酶水解,暴露出Rel蛋白上的核定位信号区,这样就使NF-κB快速易位进入细胞核内,与NF-κB的靶基因的同源序列位点结合,使这些靶基因表达增加,从而产生不同的基因产物。NF-κB转录调节的连接位点位于许多促炎细胞因子与免疫调节因子的启动区,对诱导炎症反应起着重要作用。NF-κB活化后,细胞因子和炎性介质在脑组织过度表达致使神经元赖以存在的环境发生变化,使神经元变性[7,8]。
本研究结果显示,对照组和AS模型假手术组脑组织NF-κB表达处于低水平状态;大鼠急性脑缺血后,脑组织NF-κB 表达显著增强,实验组大鼠皮层损伤区NF-κB表达0.5h即开始增高,6h明显增高,12h达到峰值,24h开始下降;总体上,随缺血时间延长,脑组织损伤程度也逐渐加重,损伤细胞主要以神经元为主。本实验使用动脉粥样硬化基础上缺血性脑卒中大鼠模型对NF-κB的表达及变化规律进行研究,更符合动脉粥样硬化病变基础上形成脑梗死的临床实际情况。本研究结果可为缺血性脑卒中的基础研究及临床干预治疗脑卒中提供新思路。
[1] Reinhard M,Wihler C,Roth M,et al.Andreas a cerebral autoregulation dynamics in acute ischemic stroke after rtPA thrombolysis[J].Cerebrovascular Diseases,2008,26(2):147-155.
[2] 夏添,刘跃亭,段虎斌,等.HIF-1α在缺血性脑卒中脑组织中表达的实验研究[J].中国医疗前沿,2011,6(3):26-27.
[3] 皇甫斌,段虎斌,刘跃亭,等.血管内皮生长因子在动脉粥样硬化缺血性脑卒中模型大鼠脑组织中的表达[J].中国动脉硬化杂志,2012,20(3):221-225.
[4] Matsuda T,Abe T,Wu JL,et al.Hypoxia-inducible factor-1alpha DNA induced angiogenesis in a rat cerebral ischemia model[J].Neurol Res,2005,27(5):503-508.
[5] 闫晓鹏,刘跃亭,段虎斌,等.大鼠液压冲击颅脑损伤后核因子κB在脑组织的表达变化的研究[J].中西医结合心脑血管病杂志,2008,6(6):685-687.
[6] Sen R,Baltimore D.Inducibility of kappa immunoglobulin enhancerbinding protein Nf-kappa B by aposttranslational mechanism[J].Cell,1986,47(6):921-928.
[7] de SáLima L,Kawamoto EM,Munhoz CD,et al.Ouabain activates NFκB through an NMDA signaling pathway in cultured cererellar cells[J].Neuropharmacology,2013,73:327-336.
[8] Nogueira L,Ruiz-Ontañon P,Vazquez-Barquero A,et al.The NFκB pathway:A therapeutic target in glioblastoma[J].Oncotarget,2011,2(8):646-653.
