亚低温干预下新生大鼠缺氧缺血性脑损伤脑组织Bax基因表达变化及意义1)
2014-05-29李迎敏阴怀清张晓佳冯钰淑
李迎敏,阴怀清,栗 红,张 巍,张晓佳,冯钰淑,张 新
新生儿缺氧缺血性脑损伤(HIBD)所致神经元损伤主要有坏死和凋亡两种方式。缺氧诱导因子1(HIF-1)、Bcl-2、Bax等分子共同参与和调节由缺氧引起的凋亡。生理或病理缺氧状态下HIF-1对维持机体氧平衡有重要作用[1-3],可通过作用于下游靶基因以减少Bax[4]等促凋亡因子。近年来的实验研究表明亚低温干预是治疗HIBD 最具有前途的措施之一[5-8]。亚低温干预可抑制并减少HIBD 所引起的神经元凋亡[9,10],对HIBD起到重要脑保护作用。
1 材料与方法
1.1 模型制作 新生7日龄Sprague-Dawley清洁级大鼠120只,由山西医科大学动物实验中心提供,雌雄不拘,体重10g~15g。HIBD 模型制备参照Rice[11]方法,大鼠采用乙醚麻醉后,分离出左颈总动脉并永久结扎,假手术动物仅分离出左侧颈总动脉,不予结扎,术后回笼恢复2h,再将鼠放入37℃水浴箱内的低氧箱中,箱底铺钠石灰以吸收二氧化碳,通入8%氧气和92%氮气的混合气,于出气孔检测氧浓度(Y-12C 型数字测氧仪,上海康华生化仪器制造有限公司),2h后开盖,在箱内与空气接触并恢复15min。
1.2 亚低温实施及实验分组 实验动物采用完全随机设计分为3组:假手术组(A 组,肛温37℃,n=40)假手术动物,缺氧缺血组(B组,肛温37 ℃,n=40),模型制备完成后笼内母乳喂养,亚低温干预组(C组,肛温33 ℃,n=40),模型制备完毕将动物放入半导体可调恒温水浴箱(温控范围10 ℃~50 ℃上海理工大学制冷工程研究所研制)的暖箱内(34℃),维持至亚低温结束,期间采用配方奶粉喂养[12]。其中各组又根据处死动物的时间(HIBD 后2h,6h,12h,24h,48h,)随机分为5个亚组,每个亚组8只。
1.3 行为及脑组织标本外观观察 实验动物置于缺氧环境中肉眼观察有无异常行为改变;采用断头法处死动物后,观察缺血侧与对侧脑组织外观形态的改变。
1.4 Bax mRNA 表达的测定 取缺血侧脑组织,按Trizol试剂说明提取脑组织总RNA;采用逆转录试剂盒合成cDNA;以cDNA 为模板,采用Real-time基因扩增仪(西安天隆科技有限公司)进行PCR 扩 增,内 参β-actin上 游 引 物5′-gtc agg tca tca cta tcg gca at-3′,下游引物5′-agaggt ctt tac gga tgt caa cgt-3′;Bax上游引物5′-tgc agagga tga ttg ctg ac-3′,下游引物5′-gat cag ctc ggg cac ttt ag-3′(两者均由上海生物工程技术有限公司合成)。RT-PCR操作按试剂盒说明进行。PCR 反应条件:94℃预变性10min,活化Tag酶;94 ℃变性15s,60 ℃退火60s,72 ℃延伸30s,45个循环结束;PCR 产物以荧光TaqMan的方法检测。计算2-ΔΔCT[13]值反映目的基因表达水平。
1.5 统计学处理 采用SPSS13.0统计软件分析,计量数据以均数±标准差表示。根据正态性及方差齐性检验结果,多组间比较采用完全随机设计因素方差分析,组间两两比较采用LSD 检验,检验水准a=0.05。
2 结 果
2.1 行为观察 实验前新生大鼠无行为异常的表现。置于缺氧环境中的新生大鼠,全部发生不同程度的异常行为改变,主要表现为:前期出现烦躁、多动、呼吸加深加快、全身紫绀,中期站立不稳、全身不断抖动、有时会出现夹尾左旋,后期烦躁消失,活动减少明显,出现淡漠、激惹,部分可能出现惊厥。假手术组行为能力正常。
2.2 脑组织标本外观 假手术组新生大鼠脑标本外观正常,左右对称;缺氧缺血组脑组织:2h肉眼观无明显改变,6h、12h缺血侧标本出现轻微的脑含水量增多,24h~48h出现明显的脑含水量增多,大小不等,缺血侧脑组织变小、萎缩;亚低温组双侧脑组织大小基本正常,无明显水肿、萎缩。
2.3 各组脑组织Bax mRNA 表达的比较(见表1)
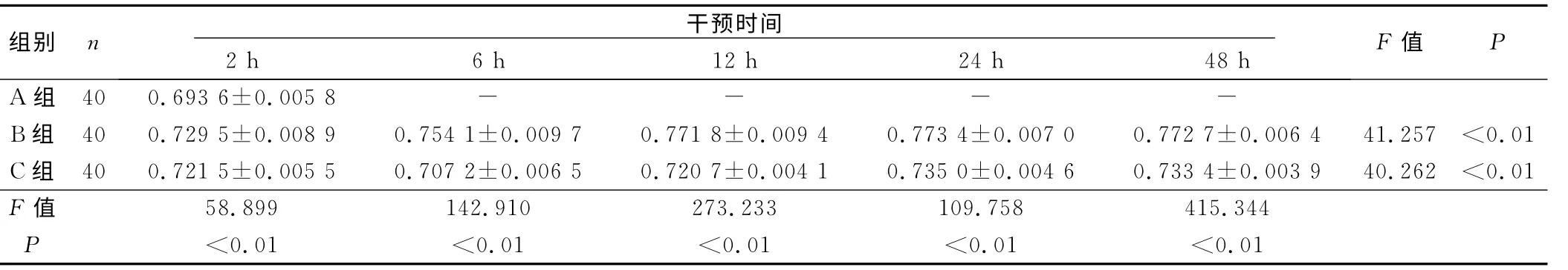
表1 各组脑组织Bax mRNA 表达的比较(2-ΔΔCT)
3 讨 论
HIBD 发生以凋亡为主的迟发性神经元死亡。一般认为,凋亡是一个需要能量的主动细胞死亡过程,具有阶段性和程序性,在一定的条件下可逆,因此在凋亡的可逆阶段抑制及减少缺氧缺血后神经元的过度凋亡,可作为脑损伤干预的重要措施之一。HIBD 诱发的细胞毒性物质作用于脑组织细胞,通过诱导前凋亡蛋白基因P53表达,使BH3-only蛋白通过间接激活模式[14,15]活化促凋亡分子Bax,Bax/Bcl-2的比例出现失衡,促凋亡分子Bax在线粒体膜上形成寡聚物,可促使线粒体通透性转换孔(PTP)开放,而PTP可作为线粒体的刺激感受器接受有关受体信号,包括膜间隙的腺嘌呤核苷酸信号和外膜的电位依赖性离子通道信号。PTP的开放会形成正反馈扩大过程,导致线粒体结构的破坏及其功能的紊乱,包括渗透压改变及失衡、线粒体外基质内流、细胞器发生肿胀,致使线粒体的内外膜依次裂解,释放出含半胱氨酸的天冬氨酸蛋白水解酶(caspase)蛋白激酶,进而激活caspase,凋亡信号的正反馈作用被级联放大,从而诱导细胞凋亡。
本实验证实经亚低温(32 ℃~34 ℃)干预的新生大鼠,缺血侧脑组织水肿程度较缺氧缺血组明显降低,且Bax mRNA 的表达在假手术组表达无明显变化;在缺氧缺血组2h即出现上升,12h达高峰,12h~48h维持在高峰;亚低温干预组各时间点Bax mRNA 的表达水平较缺氧缺血组明显降低:2h出现轻微上升,6h出现下降并达到最低水平,充分证实了亚低温干预可以减少缺血侧Bax mRNA 的表达,从而降低脑组织细胞的凋亡,延长损伤细胞存活时间,对HIBD 的脑组织具有确切的保护作用。然实验后期即HIBD 后12h~48h,Bax 基因的表达出现微升高,其可能作用机制为亚低温干预可上调HIF-1αmRNA 在脑组织的表达并延长其表达的时程[16],而引起具有保护作用的基因表达[17-19]。HIF-1α与p53结合,使p53稳定并发挥促进细胞凋亡的效应,即诱导Bax mRNA 表达微上调,下调Bcl-2,Bax/Bcl-2的比例增加,促进细胞凋亡以清除不适应缺氧缺血的细胞。
Bax参与了新生大鼠HIBD,同时亚低温干预能明显降低脑组织Bax mRNA 表达,减少神经细胞的凋亡,清除不适应缺氧缺血的细胞,对HIBD 后的脑组织具有肯定的保护作用。
[1] Goda N,Ryan HE,Khedive B,et al.Hypoxia-inducible factor-1alpha is essential for cell cycle arrest during hypoxia[J].Mol Cell Biol,2003,23(1):359-369.
[2] Gregg L,Semenza.Hypoxia-inducible factor 1:Regulator of mitochondrial[J].Biochim Biophys Acta,2011,1813(7):1263-1268.
[3] Tomoharu T,Takuhiko W,Hiroki D,et al.Persisting mild hypothermia suppresses hypoxia-inducible factor-1 protein synthesis and hypoxia-inducible factor-1-mediated gene expression[J].Am J Physiol Regul Integr Comp Physiol,2010,298:R661-R671.
[4] 张岚,邢达.JNK/Bim/Bax途径在TNF-α诱导分化PCI2细胞凋亡过程中的作用机制[J].生物化学与生物物理进展,2010,37(4):370-380.
[5] Glickman PD,Wyatt JS,Azaparat D,et al.Selective head cooling mild systemic hypothermia after neonatal encephalopathy:Multicentre randomized trial[J].Lancet,2005,365:663-670.
[6] Shankaran S,Laptook AR,Ehrenkranz RA,et al.Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy[J].N Engl J Med,2005,353:1574-1584.
[7] 选择性头部亚低温治疗新生儿HIE多中心协作组.亚低温治疗新生儿缺氧缺血性脑病临床多中心研究阶段性疗效分析[J].中国循证儿科杂志,2006,2(1):99-105.
[8] Zhang P,Cheng GQ.Research progress in mild hypothermia treatment of neonatal hypoxic-ischemic encephalopathy[J].CJCP,2013,15(10):918-922.
[9] Kessel I,Waisman D,Barzilai M,et al.Hypothermia as a treatment for hypoxic ischemic encephalopathy after neonatal asphyxiaupdate[J].Harefuah,2013,152(9):539-542;563.
[10] Buratti S,Lampugnani E,Tuo P,et al.Congenital diaphragmatic hernia repair during whole body hypothermia for neonatal hypoxic ischemic encephalopathy[J].J Perinatology,2012,32(12):981-984.
[11] Rice JE,Vannucci RC,Brierley JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):130-141.
[12] 卢耀增.实验动物学[M].北京:北京医科大学.中国协和医科大学联合出版社,1995:189-190.
[13] Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucl Acids Res,2001,29:2002-2007.
[14] Uren RT,Dewson G,Chen L,et al.Mitochondrial permeabilization relies on BH3ligands engaging multiple prosurvival Bcl-2 relatives,Not Bak[J].Cell Biol,2007,177(2):277-287.
[15] Willis SN,Fletcher JI,Kaufmann T,et al.Apoptosis initiated when BH3lignds engage multiple Bcl-2homologs,not Bax or Bak[J].Science,2007,315(5813):856-859.
[16] 李伟,阴怀清,武师润,等.亚低温干预下新生大鼠缺氧缺血性脑病时HIF-1基因表达变化及意义[J].中西医结合心脑血管病杂志,2013,10(7):847-848.
[17] Mu D,Chang YS,Vexler ZS,et al.Hypoxia-inducible factor-1alpha and erythropoietin up regulation with deferoxamine salvage after neonatal stroke[J].Exp Neurol,2005,195(2):407-415.
[18] Mu D,Jiang X,Shedon RA,et al.Regulation of hypoxia-inducible factor 1alpha and induction of vascular endothelial growth factor in a rat neonatal stroke model[J].Neurobiol Dis,2003,14(3):524-534.
[19] 赵琛,谭斐.低氧诱导因子-1激活的调节[J].生命科学,2013,25(1):40-46.
