急性肺损伤病人循环内皮祖细胞SDF-1α及其CXCR4受体表达研究1)
2014-05-28黄彦泽郭伟新王首红覃铁和
黄彦泽,郭伟新,王首红,覃铁和
急性肺损伤(acute lung injury,ALI)病理改变是肺泡毛细血管膜急性弥漫性损伤,修复肺泡毛细血管膜是治疗的关键。内皮祖细胞(endothelial progenitor cells,EPCs)参与血管内皮修复和新生,能整合至肺毛细血管,为修复肺泡-毛细血管膜提供基础[1]。最近研究发现,基质细胞衍生因子-1α(stromal cell derived factor 1alpha,SDF-1α)与CXCR4促进肿瘤细胞转移和肿瘤血管的新生[2,3]。本研究旨在观察急性肺损伤时EPCs的SDF-1α及CXCR4表达情况。
1 资料与方法
1.1 临床资料 急性肺损伤组:为2012年1月—2013年3月我科收治的急性肺损伤病人12例,男7例,女5例;年龄50岁~70岁(58.6岁±10.4岁)。急性肺损伤诊断严格按照2006 年中华重症医学分会提出ALI/ARDS的诊断标准选取急性肺损伤病人。标准如下:有相应的原发病或诱因和危险因素;急性起病,出现呼吸困难或窘迫;氧合指数(PaO2/FiO2)<300mmHg为ALI,PaO2/FiO2<200mmHg为急性呼吸窘迫综合征(ARDS);正位X线片示双肺肺浸润性阴影;肺动脉楔压(PCWP)<18mmHg,或无左心房压升高的临床证据。对照组:为年龄50岁~70岁的健康成人12名,男7名,女5名。两组均排除1年内脑梗死、心肌梗死病史,近期2周接受各种手术、肿瘤病人、糖尿病以及高血压病病人。所有入组受试者在进行实验抽血前均签署相关的知情同意书。
1.2 EPCs分离培养 诊断为急性肺损伤后24h内抽血分离单个核细胞,肝素抗凝取外周血10mL,密度梯度离心法获取单个核细胞,接种100mL培养瓶,M199培养基20mL(含20%胎牛血清)。血管内皮生长因子(VEGF)10ng/mL,上皮生长因子(EGF)10ng/mL,成纤维细胞生长因子(bFGF)2ng/mL,胰岛素样生长因子(IGF-1)2ng/mL诱导分化培养4d后用PBS洗去非贴壁细胞,换液培养至7d。
1.3 EPCs鉴定 按3×106/mL 接种于纤维连接蛋白包被的24孔板,细胞爬片培养第4天取出,以DiI-acLDL(2.4g/mL)37℃孵育1h,以检测EPC 摄取DiI-acLDL;用2%多聚甲醛固定细胞10min,PBS浸洗,将FITC-UEA-I(10g/mL)37 ℃孵育1 h,激光共聚焦显微镜鉴定UEA-I和DiI-acLDL 双染阳性细胞被认为是正在分化的EPCs。
1.4 Western Blot检测SDF-1α、CXCR4蛋白表达水平 按照参考文献和本实验室已经建立的常规方法进行。SDF-1α、CRCX4等各种分子抗体购自Cell Signaling Technology公司。垂直电泳分离蛋白,对于小分子量蛋白采用Bio-RAD 半干转仪,而大分子蛋白采用湿转,将蛋白转至PVDF膜上,相应一抗4 ℃摇床孵育过夜,使用对应二抗孵育2h,PBS冲洗后ECL 化学发光法曝光感光底片,显影定影洗涤,扫描底片经过Band Scan图像分析软件半定量分析目的蛋白条带。
1.5 统计学处理 采用SPSS 13.0统计软件进行统计分析,计量资料以均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 共聚焦显微镜观察 EPCs 摄取荧光双染阳性×200。DiL-acLDL染色细胞呈红色;FITC-UEA-I染色细胞呈绿色;双染色细胞同时呈红、绿色。通过共聚焦显微镜鉴定,FITC-UEA-I和DiL-acLDL双染色阳性细胞被认为是正在分化的EPCs。
2.2 SDF-1α、CXCR4蛋白表达(见表1、图1)
表1 两组SDF-1α、CXCR4蛋白表达

表1 两组SDF-1α、CXCR4蛋白表达
组别 n SDF-1αCXCR4对照组12 0.83±0.05 0.28±0.02病例组 12 0.31±0.02 0.15±0.01 P <0.05 <0.05
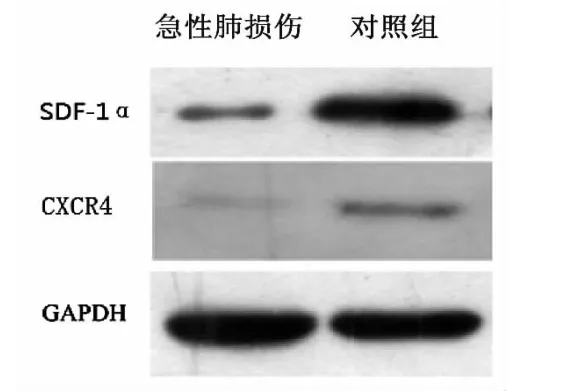
图1 组SDF-1α、CXCR4蛋白表达
3 讨 论
ALI是ICU 危重病病人最主要的病理生理表现之一,容易演变成ARDS。其主要的病理生理改变是肺泡-毛细血管膜的急性弥漫性损伤,受损的肺泡毛细血管屏障导致肺血管通透性增加、肺泡渗出增加、肺水肿以致于肺脏的通气/血流灌注比例失调,最终导致顽固性的低氧血症[1,2]。修复受损的血管内皮细胞最主要的手段之一。
肺泡-毛细血管膜再生和修复与EPCs有着密切关系。研究证实,EPCs能定向分化为内皮细胞和具有优先定位于血管和组织损伤处的特性,因而对受损部位的血管再生和内皮修复有着重要的作用[3]。最新的研究证明在油酸诱导的兔急性肺损伤模型,EPCs能定植至受损的肺血管,但不能大量定植[4]。Burnham 等[5]报道,急性肺损伤病人的生存率与其外周血EPCs的集落数呈显著正相关。这证明EPCs生物学功能的提高直接影响到疾病的预后,如何提高急性肺损伤病人循环EPCs的生物学功能已经成为治疗的关键。
最近发现基质细胞衍生因子-1α在血管新生中起着重要作用。已有研究证实EPCs能自分泌SDF-1α[6]。SDF-1α均能提高EPCs的动员、归巢及分化功能。SDF-1α 可与EPCs膜表面受体CXCR4 结合,诱导成熟或不成熟的祖细胞动员,并参与血管的生成[7]。在本研究中发现急性肺损伤组循环内皮祖细胞SDF-1α及CXCR4表达均有下降,可能是由于以下原因,一些研究已经表明,在严重的炎症阶段和炎性细胞因子的抑制SDF-1α的表达在体内和体外[8]。急性肺损伤是急性炎症导致肺血管内皮和上皮屏障的破坏,在这种生理和病理状态,SDF-1α、CXCR4的表达受到抑制。SDF-1α是一个强有力的趋化细胞表达CXCR4的CD34+细胞,骨髓来源的间充质干细胞[9,10]。SDF-1α可以导致这些祖细胞归巢增加。如使用外源性SDF-1α能改善急性肺损伤内皮祖细胞,从而改善肺泡-毛细血管膜的急性弥漫性损伤。
[1] Mutunga M,Fulton B,Bullock R,et al.Circulating endothelial cells in patients with septic shock[J].Am J Respir Crit Care Med,2001,163:195-200.
[2] Orfanos SE,Mavrommati I,Korovesi I,et al.Pulmonary endothelium in acute lung injury:From basic science to the critically ill[J].Intensive Care Med,2004,30:1702-1714.
[3] Minamino T,Komuro I.Regeneration of the endothelium as a novel therapeutic strategy for acute lung injury[J].J Clin Invest,2006,116:2316-2319.
[4] Lam CF,Liu YC,Hsu JK,et al.Autologous transplantation of endothelial progenitor cells attenuates acute lung injury in rabbits[J].Anesthesiology,2008,108:392-401.
[5] Burnham EL,Taylor WR,Quyyumi AA,et al.Increased circulating endothelial progenitor cells are associated with survival in acute lung injury[J].Am J Respir Crit Care Med,2005,172:854-860.
[6] Askari AT,Unzek S,Popovic ZB,et al.Effect of stromal cell-derived factor-1on stem cell homing and tissue regeneration in ischemic cardiomyopathy[J].Lancet,2003,362(9385):697-703.
[7] Lataillade JJ,Clay D,Dupuy C,et al.Chemokine SDF-1enhances circulating CD34+cell proliferation in synergy with cytokines possible role in progenitor survival[J].Blood,2000,95:756-768.
[8] Romagnani P,Lasagni L,Annunziato F,et al.CXC chemokines:The regulatory link between inflammation and angiogenesis[J].Trends Immunol,2004,25:201-209.
[9] Ma Ming,Ye Jieyu,Deng Ruixia,et al.Mesenchymal stromal cells may enhance metastasis of neuroblastoma via SDF-1/CXCR4and SDF-1/CXCR7signaling[J].Cancer Letters,2011,312:1-10.
[10] Oswald J,Boxberger S,Jorgensen B,et al.Mesenchymal stem cells can be differentiated into endothelial cells in vitro[J].Stem Cells,2004,22:377-384.
