水飞蓟宾诱导人肝癌细胞HepG2死亡及机制研究
2014-05-25孟冠敏浙江省立同德医院杭州310012
刘 丹 张 慰 孟冠敏 姜 凯 金 鑫 浙江省立同德医院 杭州310012
水飞蓟宾诱导人肝癌细胞HepG2死亡及机制研究
刘 丹 张 慰 孟冠敏 姜 凯 金 鑫 浙江省立同德医院 杭州310012
目的 探讨水飞蓟宾对人肝癌细胞HepG2的杀伤作用及其机制。方法 不同浓度水飞蓟宾处理HepG2细胞,采用MTT法检测HepG2细胞增殖情况,流式细胞术检测水飞蓟宾诱导HepG2细胞的凋亡情况。利用ROS荧光探针二氢乙啶(DHE)检测水飞蓟宾是否诱导HepG2细胞ROS的产生,并用ROS抑制剂抗坏血酸预处理后检测水飞蓟宾对HepG2的杀伤活性及诱导凋亡的能力。结果 水飞蓟宾可显著抑制HepG2细胞的增殖并诱导其发生凋亡。水飞蓟宾处理后HepG2细胞的ROS显著增高(P<0.05,P<0.01),用抗坏血酸预处理后水飞蓟宾对HepG2的增殖抑制作用降低,并抑制水飞蓟宾诱导的凋亡。结论 水飞蓟宾通过诱导ROS的产生引起人肝癌细胞发生凋亡。
肝癌细胞;HepG2;凋亡;ROS;水飞蓟宾
肝癌是危害人类健康的世界性难题,其预后差,生存时间较短,死亡率居所有恶性肿瘤的第3位[1],手术、化疗、放疗等方法目前仍然是治疗肝癌的主要手段,但长期化疗副反应很大,且易产生耐药性,采取一系列辅助治疗降低化疗药物用量以及提高治疗效果显得尤为重要。水飞蓟宾(silibinin)是水飞蓟素(silymarin)中最主要的生物活性成分,临床上主要用于保肝护肝[2]。近年来,水飞蓟宾还被发现具有抗肿瘤活性,对于多种肿瘤均具有良好抑制作用[3-4],然而其对肝肿瘤的抑制作用却很少报道,且抗肿瘤作用的机制也不十分清楚。因此,笔者通过研究水飞蓟宾对人肝癌细胞系HepG2的生物作用,观察水飞蓟宾诱导肝肿瘤细胞凋亡作用,报道如下。
1 实验材料
1.1 细胞来源 人肝癌细胞株HepG2来自于ATCC,由浙江大学医学院提供,细胞培养在RPIM-1640培养基中,其中含有10%胎牛血清(FBS)。
1.2 试 剂 RPIM-1640培养基购自于Gibco公司,胎牛血清(FBS)购于杭州四季青生物工程有限公司。水飞蓟宾(Silibinin)、噻唑蓝(MTT)、抗坏血酸(ascorbic acid,AA)购于美国Sigma公司,二氢乙啶(dihydroethidium,DHE)购于美国Molecular Probes公司。碘化丙啶(PI)和AnnexinⅤ购自美国ebioscience。
2 实验方法
2.1 细胞生长抑制检测 将HepG2细胞按1×104/孔接种于 96孔板,加入 200μL含 10%FBS的RPIM-1640培养,设置3个复孔,并分别加入0、10、20、50和100μM的Silibinin培养24h及48h,之后加5mg/mL MTT 20μL,继续培养4h。弃上清,往孔中加150μL DMSO,震荡使紫色絮状物完全溶解,570nm波长下用酶标仪检测OD值,细胞生长抑制率计算公式:抑制率=(ODPBS-ODSilibinin)/ODPBS× 100%。
2.2 细胞凋亡及ROS产生检测 在HepG2细胞培养瓶中分别加入0、10、20、50和100μM的Silibinin培养24h,之后按照试剂说明书将PI和annexin-V加入细胞中孵育20min,采用流式细胞术检测肿瘤细胞的凋亡[5],细胞凋亡率用PI、annexin-V双阳性细胞占所有细胞比值表示;同时用DHE染料采用流式细胞术检测HepG2细胞内活性氧簇(reactive oxygen species,ROS)产生情况[6]。DHE(二氢乙啶,Dihy droethidium)可自由透过活细胞膜进入细胞内,并被细胞内的超氧阴离子型ROS氧化,形成氧化乙啶,氧化乙啶可掺入染色体DNA中,产生红色荧光,流式细胞检测可分成两个亚群:ROS阴性细胞仅有很低的荧光强度,ROS阳性细胞有较强的红色荧光,ROS阳性率按照发出较强红色荧光的细胞占所有细胞的比值表示。
在HepG2细胞培养瓶中先加入1mM AA预处理2h,之后加入100μM的Silibinin培养24h,检测Silibinin对肿瘤细胞的杀伤活性、ROS的产生及凋亡。
2.3 统计学方法 所有实验重复三次,实验数据应用SPSS 11.0统计软件进行处理,采用非配对双边t检验以及单因素方差分析,P<0.05为差异有统计学意义。
3 实验结果
3.1 水飞蓟宾对人肝癌细胞系HepG2的抑制作用HepG2细胞在不同浓度Silibinin的作用下相比于0μm Silibinin组均呈现出抑制效应(P<0.05,P<0.01),用Silibinin处理48h较24h抑制作用更加明显(P<0.05,P<0.01),提示Silibinin对肿瘤细胞的杀伤作用有剂量和时间依赖性。见表1。
3.2 水飞蓟宾对肝癌细胞HepG2活性氧簇(ROS)生成及凋亡的诱导效应 HepG2细胞在不同浓度Silibinin的作用下相比于0μm Silibinin组ROS产生明显升高(P<0.05,P<0.01),其阳性率随着水飞蓟宾浓度的增加而升高,表明水飞蓟宾能诱导肿瘤细胞ROS产生且呈剂量依赖性。相似地,在Silibinin的处理下,HepG2细胞的凋亡率也随着Silibinin剂量的增加而增加(P<0.05,P<0.01),见表2。
表1 各组HepG2肿瘤细胞抑制率比较(±s)

表1 各组HepG2肿瘤细胞抑制率比较(±s)
注:与0μM Silibinin组比较,*P<0.05,**P<0.01;与同浓度水飞蓟宾处理24h的抑制率比较,△P<0.05,△△P<0.01 Silibimin:水飞蓟宾
组 别n/孔24h抑制率/%48h抑制率/% 0μM Silibinin组10μM Silibinin组20μM Silibinin组50μM Silibinin组100μM Silibinin组33333 0 5.1±1.5* 11.5±2.7* 28.6±3.5** 56.3±6.7** 0 11.7±2.4*△20.8±3.9**△60.2±5.2**△△79.5±7.4**△△
表2 各组HepG2肿瘤细胞凋亡率比较(±s)

表2 各组HepG2肿瘤细胞凋亡率比较(±s)
注:与0μM Silibinin组比较,*P<0.05,**P<0.01 Silibimin:水飞蓟宾
组 别n/孔ROS阳性率/%HepG2凋亡率/% 0μM Silibinin组10μM Silibinin组20μM Silibinin组50μM Silibinin组100μM Silibinin组33333 1.3±0.2 4.8±1.1* 14.8±2.9* 22.1±4.0** 33.5±4.2** 0.5±0.1 3.0±0.6* 10.1±2.0** 20.7±4.4** 29.4±4.5**
3.3 抗坏血酸(AA)抑制ROS产生与细胞凋亡作用
流式细胞术检测发现相比于未加AA直接加Silibinin的HepG2细胞,用AA预处理过的HepG2细胞在用Silibinin治疗后ROS产生明显降低(P<0.05,P<0.01),凋亡率和对Silibinin的敏感性也同样明显降低(P<0.05,P<0.01)。见表3。
4 讨 论
在本实验中,我们发现水飞蓟宾能快速引起肝肿瘤细胞的氧化应激,进而使肝肿瘤细胞产生过量的ROS。ROS能损伤细胞的DNA和酶,干扰细胞的代谢过程,从而诱导细胞走向凋亡[7],此外ROS还可以引起下游凋亡诱导通路的激活来促进细胞死亡,比如ROS可以引起细胞线粒体失能[8]及激活MAPK途径来诱导肿瘤细胞凋亡[9],这些已经被证实存在于各种类型的肿瘤细胞中,因此给予肿瘤细胞足够的氧化应激,使之产生过量的活性氧簇进而诱导肿瘤细胞死亡是现在肿瘤治疗的一个十分重要的思路。
表3 ROS对水飞蓟宾诱导HepG2凋亡的影响(±s)
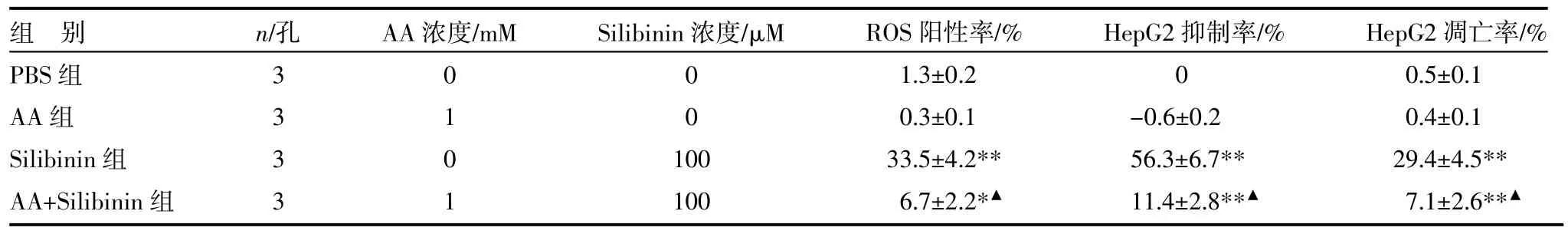
表3 ROS对水飞蓟宾诱导HepG2凋亡的影响(±s)
注:与PBS组比较,*P<0.05,**P<0.01;与Silibinin组比较,▲P<0.01 PBS:胎牛血清;AA:抗坏血酸;Silibimin:水飞蓟宾
组别PBS组AA组Silibinin组AA+Silibinin组n/孔AA浓度/mM Silibinin浓度/μM 3333 0101 00 100 100 ROS阳性率/% 1.3±0.2 0.3±0.1 33.5±4.2** 6.7±2.2*▲HepG2抑制率/% 0 -0.6±0.2 56.3±6.7** 11.4±2.8**▲HepG2凋亡率/% 0.5±0.1 0.4±0.1 29.4±4.5** 7.1±2.6**▲
抗坏血酸(AA)是人体必需的一种高效抗氧化剂,保护身体免于自由基的威胁,然而最近的研究发现AA能通过降低肿瘤细胞ROS的产生从而降低化疗药物的疗效[10]。水飞蓟宾是从水飞蓟属植物种子中提取的一种黄酮类化合物,临床上主要用来保护肝细胞,对黄疸、肝炎、酒精肝等疾病有良好的疗效,是一种低毒安全的肝脏治疗药物[11]。本组结果显示,Silibinin可抑制HepG2肿瘤细胞增殖,并通过诱导HepG2产生ROS,促进HepG2凋亡。但AA可以干扰Silibinin的抗增殖与促凋亡作用。
[1] Siegel R,Naishadham D,Jemal A,et al.Cancer statistics 2012[J].CA Cancer J Clin,2012,62:10-29.
[2]Wang Y,Zhang L,Wang Q,et al.Recent advances in the nanotechnology-based drug delivery of Silybin[J].J Biomed Nanotechnol,2014,10(4):543-558.
[3]Akhtar R,Ali M,Mahmood S,et al.Anti-proliferative action of silibinin on human colon adenomatous.cancer HT-29 cells[J].Nutr Hosp,2014,1,29(2):388-392.
[4]Oh SJ,Jung SP,Kim JH,et al.Silibinin inhibits TPA-induced cell migration and MMP-9 expression in thyroid and breast cancer cells[J].Oncol Rep,2013,29(4):1343-1348.
[5]Gao M,Li Y,Li Y,et al.Down-regulation of CD59 inhibits proliferation and promotes apoptosis of HeLa cells[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2014,30(6):585-587.
[6]Hail N Jr.Mitochondrial reactive oxygen species affect sensitivity to curcumin-induced apoptosis[J].Free Radic Biol Med,2008,44,1382-93.
[7]Zeng L,Li Y,Xu H,et al.Chem Asian J.Selenium-Platinum Coordination Compounds as Novel Anticancer Drugs:Selectively Killing Cancer Cells via a Reactive Oxygen Species(ROS)-Mediated Apoptosis Route[J].Chem Asian,2014,5:20.
[8]David F,Stowe,Amadou K.S.Camara.Mitochondrial Reactive Oxygen Species Production in Excitable Cells:Modulators of Mitochondrial and Cell Function[J].Antioxid Redox Signal,2009,11(6):1373-1414.
[9]Anne Riemann,Bettina Schneider,Michael Gekle,et al. Acidic Environment Leads to ROS-Induced MAPK Signaling in Cancer Cells[J].PLoS One,2011,6(7):e22445.
[10]Subramani T,Yeap SK,Alitheen NB,et al.Vitamin C suppresses cell death in MCF-7 human breast cancer cells induced by tamoxifen[J].J Cell Mol Med,2014,18(2):305-313.
[11]Mili N,Milosevi N,Abenavoli L,et al.New therapeutic potentials of milk thistle(Silybum marianum)[J].Nat Prod Commun,2013,8(12):1801-10.
Silibinin Induced Cell Death in Hepatoma Cell line HepG2 and Its Mechanism
LIU Dan,ZHANG Wei,MENGGuan Min,JIANG Kai,JIN Xin.Tongde Hospital of Zhejiang Province,Hangzhou(310012),China
Objective To investigate the effect of silibini on proliferation of HepG2 cells and the underlying mechanism.Methods HepG2 cells were treated with various concentrations of silibinin;then the proliferation of HepG2 cells treated with silibinin was determined by using MMT assay and the apoptosis of HepG2 cells was detected by flow cytometry.The generation of ROS in HepG2 cells induced by silibinin was observed by using fluorescent probe with DHE and then was inhibited by ascorbic acid to observe whether the effect of silibinin on proliferation of HepG2 cells was dependent on ROS.Results Silibinin significantly inhibited the proliferation of HepG2 cells,inducing apoptotic cell death.The ROS significantly increased in HepG2 cells treated with silibinin(P<0.05,P<0.01).After ascorbic acid treatment,the suppression as well as apoptosis of HepG2 cells induced by silibinin decreased.Conclusion Silibinin can induce apoptotic cell death of HepG2 cells via upregulating ROS.
hepatocarcinoma cells;HepG2;apoptosis;ROS;silibinin
2014-06-13
2014-06-30
