毛细支气管炎患儿血清T细胞亚群及γ干扰素、白细胞介素-6的检测及意义
2014-05-24李靖红麻瑞芹张鸿英黄国英滕爱兰
许 倩,李靖红,麻瑞芹,张鸿英,黄国英,滕爱兰
(甘肃省第二人民医院,甘肃 兰州 730000)
毛细支气管炎是婴幼儿时期常见的下呼吸道感染性疾病,仅见于2岁以下的婴幼儿,多数为6个月以内的婴儿。临床以咳嗽、喘憋为主要表现,容易发生心力衰竭及呼吸衰竭等并发症。具有特应质或过敏体质者,毛细支气管炎可出现反复喘息发作,且容易发展成哮喘,其发病机制尚未完全清楚,目前认为免疫失衡在发病过程中起重要作用[1],其中T细胞亚群及细胞因子可能在发病中起主要作用。本研究通过检测毛细支气管炎患儿血清T细胞亚群及IFN-γ、IL-6,探讨其与毛细支气管炎患儿喘息的相关性及发病中的临床意义。
1 资料与方法
1.1 一般资料
选择2012年10月—2013年5月本科收治的毛细支气管炎患儿36例为毛细支气管炎组。所有患儿均为首次感染性喘息发作,符合《诸福棠实用儿科学》第7版的诊断标准[2],男21例,女 15 例;年龄 3~20 个月,平均年龄(8.19±4.96)个月;体重6.5~13.5 kg,平均 8.9 kg;病程 6~19 天,平均 9 天。排除支气管炎、婴幼儿哮喘和先天性心脏病等。正常对照组为门诊健康体检儿童30例,其中男17例,女13例;年龄4~22个月,平均年龄(8.63±3.66)个月;体重 3.9~11.0 kg,平均 6.9 kg;无过敏性疾病史,近两周无呼吸道感染。两组在性别、年龄上无统计学差异(P>0.05),具有可比性。本研究取得入选对象监护人知情同意。
1.2 检测方法
毛细支气管炎组患儿入院诊断明确后于次日清晨空腹采集颈静脉血4 m l,正常对照组在取得家长同意后空腹采集颈静脉血4ml,分别为静脉肝素抗凝血和非抗凝血各2ml。抗凝血用于检测T细胞亚群,方法为免疫荧光流式细胞技术(六色流式细胞仪,美国BD公司)检测血清CD3+T、CD3+CD4+T、CD3+CD8+T,试剂盒由卫生部武汉生物制品研究所提供。非抗凝血2 ml,于3 500 r/min离心10分钟,分离血清后置于-20℃冰箱保存待检,用于集中检测IFN-γ和IL-6,采用酶联免疫吸附法(ELISA)测定血清IFN-γ和IL-6,试剂盒由深圳晶美生物有限公司提供,所有检测均严格按试剂盒说明书进行。
1.3 统计学处理
2 结果
(1)毛细支气管炎组和正常对照组T细胞亚群系列水平比较,毛细支气管炎组CD3+CD4+T、CD3+CD8+T与正常对照组比较,差异无统计学意义(P>0.05);毛细支气管炎组CD3+T、CD3+CD4+T/CD3+CD8+T与正常对照组比较,差异有统计学意义(P<0.05),见表 1。
表1 两组T细胞亚群系列水平比较(±s)
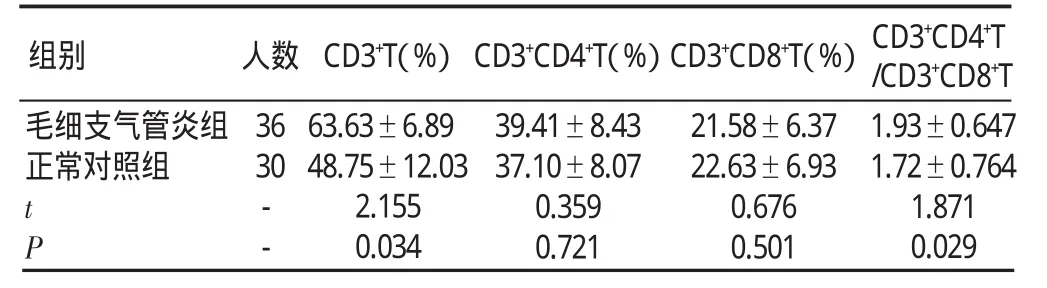
表1 两组T细胞亚群系列水平比较(±s)
组别 人数毛细支气管炎组正常对照组36 30 tP--CD3+T(%)63.63±6.89 48.75±12.03 2.155 0.034 CD3+CD4+T(%)39.41±8.43 37.10±8.07 0.359 0.721 CD3+CD8+T(%)21.58±6.37 22.63±6.93 0.676 0.501 CD3+CD4+T/CD3+CD8+T 1.93±0.647 1.72±0.764 1.871 0.029
(2)毛细支气管炎组和正常对照组IFN-γ、IL-6水平比较,毛细支气管炎组IFN-γ降低,IL-6增高,与正常对照组比较,差异有统计学意义(P<0.05),见表 2。
表 2 两组 IFN-γ、IL-6 水平比较(±s,mg/L)

表 2 两组 IFN-γ、IL-6 水平比较(±s,mg/L)
组别 人数毛细支气管炎组正常对照组36 30 tP--IFN-γ 67.36±31.29 99.74±15.37 3.211 0.026 IL-6 135.67±56.32 78.25±20.12 2.157 0.018
3 讨论
毛细支气管炎是婴幼儿期的呼吸道病毒感染性疾病,也是婴幼儿住院的主要原因,目前被国内外广泛关注,其主要由呼吸道合胞病毒(RSV)引起。毛细支气管炎的临床表现主要为喘憋,认为其机制与免疫功能紊乱有关。淋巴细胞及其亚群的检测是判断机体细胞免疫水平的重要指标。
T淋巴细胞是体内重要的免疫细胞,在胸腺中发育成熟后进入外周血。T淋巴细胞介导的细胞免疫在机体免疫应答和免疫调节方面起着核心作用。根据T淋巴细胞不同的表面标记和功能可分为CD3+T、CD3+CD4+T和CD3+CD8+T亚群。T细胞亚群中CD3+T是所有T淋巴细胞的表面标志,是机体细胞免疫的基础;CD3+CD4+T细胞又称辅助性/诱导性T淋巴细胞Th,Th细胞通过释放多种细胞因子辅助B细胞和效应T细胞活化,促进体液和细胞免疫,调节机体的免疫功能[3];Th1和Th2是Th细胞的两个亚群,Th1细胞主要分泌IFN-γ、IL-2和TNF-α等炎症因子,在抗细胞内病原体(病毒、细菌及寄生虫等)感染中发挥重要作用;Th2细胞主要分泌IL-4、IL-5、IL-6和IL-10等炎症因子,能激活B淋巴细胞合成IgE和IgG,介导体液免疫应答、过敏性和感染性疾病,在拮抗细胞外病原体(如细菌、寄生虫)、B细胞增殖分化以及哮喘病等方面具有重要作用。此外,还可通过负性调节机制抑制Th1细胞介导的免疫反应,当它们维持在一定平衡状态时,机体行使生理防御、自身稳定和免疫监视的免疫功能。一旦平衡状态被打破,出现Th1或Th2增多,表现为Th细胞向Th1或Th2偏移,称之为Th1或Th2优势状态。CD3+CD8+T细胞又称抑制性/杀伤性T淋巴细胞Ts,Ts细胞直接损伤靶细胞,抑制免疫功能[4]。Th、Ts细胞在功能上相互诱导、相互制约,形成T细胞网络,对机体正常免疫功能的维持有重要的调节作用。正常情况下CD3+CD4+T/CD3+CD8+T比值维持动态平衡,是反映免疫系统内环境稳定的重要指标,一旦失去平衡,可以导致机体免疫功能紊乱而致病[5]。
Roe等[6]认为在毛细支气管炎中,CD3+CD4+T细胞和CD3+CD8+T细胞可能被诱导产生编程性细胞死亡,导致急性毛细支气管炎患儿外周血中淋巴细胞一过性减少。毛细支气管炎的临床主要表现类似哮喘样发作,结合哮喘发病机制,认为其机制与免疫功能紊乱有关。研究报道毛细支气管炎患者CD3+CD4+T/CD3+CD8+T比值增高[7]。本研究中,毛细支气管炎组CD3+CD4+T、CD3+CD8+T与正常对照组相比,差异无统计学意义(P>0.05),CD3+T 百分比增高,CD3+CD4+T/CD3+CD8+T比值高于正常对照组(P<0.05),差异有统计学意义,表明在毛细支气管炎急性感染期存在T细胞亚群紊乱,这与国内某些研究中发作期哮喘患儿外周血T细胞亚群有类似变化[8]的结论相同。
毛细支气管炎的发病机制是一个复杂的病理过程,与病毒直接引起的细胞病理改变、免疫反应以及个体遗传差异性等的共同作用有关[9],其中免疫学机制是致病的重要过程,有研究显示,毛细支气管炎和儿童哮喘可能存在着相同或相似的免疫学发病机制[10]。T淋巴细胞Th1/Th2亚群比例和功能失衡是哮喘的重要免疫发病机制,表现为Th1细胞功能低下,Th2细胞功能亢进。目前很多实验显示,在毛细支气管炎的发病过程中,Th1/Th2处于失衡状态,Th2类细胞因子表达和释放增加,Th1类细胞因子相对受抑制,使毛细支气管炎患儿体内呈现Th2优势免疫应答[11]。呼吸道合胞病毒所致毛细支气管炎患者IFN-γ明显降低,而IL-6升高[12]。本研究结果亦显示,毛细支气管炎患儿发病时IFN-γ低于正常对照组(P<0.05),而IL-6水平高于正常对照组(P<0.05),差异有统计学意义,与 Bueno SM 等报道相符。提示RSV毛细支气管炎急性感染期发生细胞免疫失调,即Th1细胞功能受到抑制,Th2细胞功能亢进。
IL-6是B细胞产生抗体所必需的分化因子,可促进B细胞分化,且辅助Th2细胞产生IL-4,IL-4在IgE产生中起关键作用,并可促进IgE合成分泌亢进。IFN-γ由吞噬细胞和活化的Th1细胞分泌,调节免疫反应,最重要的是诱导Th0细胞向Th1转化,通过抑制IL-4的产生而对抗Th2细胞的功能。因此,毛细支气管炎患儿Th细胞功能紊乱是导致患儿发生喘息的免疫学机制。
Puthothu等[13]认为,RSV毛细支气管炎的发生、发展与Th1/Th2细胞的免疫失衡有关,在RSV感染过程中,伴随疾病进展,Th2细胞反应占优势,而在疾病恢复期Th1细胞反应占主导。婴幼儿严重的RSV感染更易发展为哮喘,而在哮喘的发病机制中Th2细胞介导的免疫反应占主导[14]。
本研究结果表明,毛细支气管炎患儿T淋巴细胞亚群比例改变及其分泌的细胞因子IFN-γ和IL-6的变化,提示毛细支气管炎患儿存在免疫功能异常,为毛细支气管炎患儿临床免疫治疗提供了理论依据。
[1]Berger A.Th1 and Th2 responses:what are they[J].BMJ,2008,321(58):424-430.
[2]胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2002.
[3]Brown DM,Román E,Swain SL.CD4 T cell responsesto influenza infection[J].Semin Immunol,2004,16(3):171-177.
[4]Small BA,Dressel SA,Lawrence CW,et al.CD+8 T cellmediated injury in vivo progresses in the absence of effector T cells[J].Exp Med,2001,194(12):1835-1846.
[5]Woodland DL.Cell-mediated immunity to respiratory virus infections[J].Cure Opin Immunol,2003,15(4):430-435.
[6]Roe MF,B loxham DM,White DK,et al.Lymphocyte apoptosis inacu te respiratory syncytial virus bronch iolitis[J].C lin Exp Immuno,2004,137(1):139-145.
[7]陈启文,黄正刚.毛细支气管炎患儿T细胞亚群的变化及其临床意义[J].实用临床医学,2008,9(12):96-97.
[8]安肃英,孙宗芝,李根山.哮喘儿童血免疫球蛋白E、T细胞亚群与细胞因子动态观察及临床意义[J].实用儿科临床杂志,2004,19(2):117-119.
[9]刘恩梅,彭才静.呼吸道合胞病毒感染防治进展[J].临床儿科杂志,2011,29(8):705-707.
[10]陈福将,李昌崇,罗运春,等.毛细支气管炎患儿血清MCP-4、MDC和 IL-4 水平及临床意义[J].临床儿科杂志,2007,25(5):361-363.
[11]Legg JP,Hussain IR,Wanrer JA,et al.Type1 and type2 cytokine imbalance in acute respiratory syncytial virus bronchiolitis[J].Am JRespir CritMed,2003,168(6):633-639.
[12]Bueno SM,Gonz lez PA,Pach eco R,et al.Host immunity during RSV path ogenesis[J].International Immunopharmacology,2008,8(10):1320-1329.
[13]Puthothu B,K ruegerM,Forster J,et al.In terleuk in (IL)-18 polymorph ism 133C/G is associated with severe respiratory syncytial virus infection[J].Pediatr Infect Dis J,2007,26(12):1094-1098.
[14]Castro M,Toni Schweiger,Yin-Declue,et al.Cytokine response after severe respiratory syncytial virus bronchiolitis in early life[J].Journal of Allergy and Clinial Immunology,2008,122(4):726-733.
