新生霉素通过诱导DNA损伤抑制慢粒白血病细胞增殖
2014-05-19黄立森陈显凌许建文许建华吴丽贤
黄立森,陈显凌,柯 方,许建文,郑 鸣,许建华,吴丽贤
(1.福建医科大学药学院药理系,福建 福州 350004;2.福建省天然药物药理学重点实验室,福建福州 350004;3.福建医科大学药学院药化系,福建福州 350108;4.福建医科大学解剖系,福建 福州 350108;5.福建医科大学附属协和医院血液科,福建福州 350001;6.福建省血液病研究所,福建福州,350001)
慢性粒细胞白血病(CML)[1],是一种骨髓造血功能紊乱的克隆异常增生性疾病,以嵌合染色体BCR-ABL[2]阳性为主要特点,该基因产物为分子质量210 ku的具有酪氨酸酶活性的p210蛋白。伊马替尼(IM)是p210蛋白的竞争性抑制剂,能够竞争抑制p210蛋白的酪氨酸酶活性,发挥抗CML的作用,对BCR-ABL阳性初始治疗的慢性期CML患者疗效明显,随着临床的长期广泛使用,暴露出越来越多的问题,其一、IM对急性期、急变期以及 BCR-ABL突变(如 T315I突变[3])的 CML患者疗效差;其二、IM耐药案例不断增加;因此探寻其它具有抗CML的药物,研究新的作用机制和作用靶点,对于治疗CML和解决CML的耐药问题具有重要的意义。
损伤DNA是当前临床治疗肿瘤常用的放射治疗及绝大多数抗癌药物共同的分子机制。虽然DNA损伤的分子机制不尽相同,但都可以通过6条修复通路予以修复。在DNA损伤中,双链断裂对肿瘤细胞是最致命的打击,它的修复主要通过两种机制实现:一种是同源重组(HR),使用姐妹染色体的同源序列重新合成 DNA,需要 Rad51、NBS1、BRCA1和BRCA2等参与,这些蛋白在DNA损伤处形成聚集点(foci);另一种是非同源末端连接 (NHEJ),断裂的DNA末端重新连接,可以在没有模板的情况下进行 DNA修复,但也更容易发生错误,主要依赖Ku70/80异二聚体与DNA依赖的蛋白激酶催化亚单位(DNA-PKcs)结合形成DNA-PK全酶,后者募集XRCC4和DNA连接酶Ⅳ完成NHEJ修复。DNA修复能力异常激活和增强是导致肿瘤对DNA损伤剂耐药的重要分子基础;相反,修复缺陷则使肿瘤对其高敏感。目前已有10余种靶向不同DNA修复分子的化合物正在进行不同阶段的临床试验。
新生霉素(novobiocin,Nov)是香豆素类抗生素的代表药物,对DNA拓扑异构酶Ⅱ有很好的抑制作用[4],对多种癌细胞有抑制作用,可以用于抗癌药联合应用以及逆转抗癌药的耐药性,还有研究表明Nov是热休克蛋白 90(HSP90)的 C端抑制剂[5],能够抑制HSP90的分子伴侣功能,影响客户蛋白的正确结构和功能,间接发挥抗肿瘤作用。本文从DNA损伤的角度探寻Nov治疗肿瘤的新机制,为更深入全面地研究Nov抗肿瘤机制以及开发更多活性更强的NOV衍生物奠定理论基础。引起细胞DNA损伤的因素有很多,包括物理因素、化学因素和自身的代谢产物。在细胞正常生理活动时可以产生ROS,但是在药物作用下ROS产生过多,对肿瘤细胞可产生毒性作用如DNA损伤,杀伤肿瘤细胞。因此,本实验旨在探讨Nov诱导DNA损伤的效应是否通过产生大量ROS,为今后本课题组合成活性更高的、有DNA损伤作用的新型Nov衍生物提供理论基础。
1 材料与方法
1.1 材料 Nov购于美国Sigma公司,溶解于二甲基亚砜(DMSO)中,配成储存液 400 mmol·L-1于-20℃备用,使用前解冻,用培养液稀释成所需浓度。IM购于Higher Biotech Co Ltd,溶解于DMSO中,配成储存液10 mmol·L-1于-20℃备用,使用前解冻,用培养液稀释成所需浓度。Hyclone RPMl 1640培养基和Hyclone胎牛血清均购于Thermo Scientific Co Ltd。MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)购置于美国Sigma公司,用磷酸盐缓冲液(PBS)稀释成5g·L-1存储液,小剂量分装 ,-20℃避光储存。r-H2AX、p-ATM、p-CHK1、p-CHK2、Parp、p-p53、CDC25A、CDC25C、cleaved Caspase-3单克隆抗体均购置于Cell Signaling Technology公司,β-actin单克隆抗体和羊抗鼠、羊抗兔IgG-HRP二抗购于凯基生物公司。ECL Western blotting Detection System超强发光底物购置于Signalway Antibody公司。苯甲基磺酰氟(PMSF)、蛋白酶抑制剂、磷酸酶抑制剂、BCA蛋白定量试剂盒、流式凋亡检测试剂盒均购自瑞士Roche公司,JC-1线粒体膜电位检测试剂盒购于凯基生物公司,CFSE、RNA酶和碘化丙啶(PI)购于美国Sigma公司,ROS检测试剂盒购于碧云天公司。Image station 4000MM成像系统购于柯达公司;BD FACSCantoⅡ流式细胞仪购于BD公司,电泳、转膜仪为BIORAD公司产品。
1.2 方法
1.2.1 细胞培养 K562细胞采用含0.1的胎牛血清 RPMI 1640,青霉素(1×105IU·L-1)和链霉素(50 mg·L-1),在 37℃、5%的 CO2孵育箱中培养,K562/G01细胞采用含10%的胎牛血清RPMI 1640,青霉素(1×105IU·L-1)和链霉素(50 mg·L-1)以及维持4μmol·L-1IM,在37℃、5%的 CO2孵育箱中培养,取对数生长期细胞用于实验。
1.2.2 MTT法研究Nov对K562和K562/G01细胞增殖的抑制作用 96孔培养板上每孔种植1×104个细胞,体积为200μl,实验组分别加入不同浓度的Nov和IM,对照组不加药,另设空白组(只加培养基,无细胞),每组设3个复孔,37℃培养48 h,每孔加入 5 g·L-1的 MTT溶液20μl,继续培养4 h,800×g离心5 min弃上清,加入DMSO 150μl,振荡10 min,用全自动酶标仪(Therm公司)检测570 nm处的吸光度(OD)值,结果采用GraphPad Prism 5软件分析,并绘制相应的抑制率-对数浓度曲线,计算药物的IC50。
1.2.3 CFSE检测Nov对K562及K562/G01细胞增殖代数的影响[6]取对数生长期的 K562及K562/G01细胞,用 5μmol·L-1CFSE 37℃预先处理10 min,加入冰冷的含有0.1 FBS的RPMI 1640培养液终止反应并洗涤细胞2次,分组并加入不同浓度的Nov和IM处理72 h。收集细胞,PBS洗涤2次,上机检测,结果采用Modfit软件分析。
1.2.4 流式细胞技术检测Nov对K562及K562/G01细胞ROS的影响 通过使用氧化敏感的荧光探针(DCFH-DA)检测细胞内 ROS的水平[7]。不同浓度的Nov处理细胞24 h。收集细胞,用PBS洗涤2次,37℃下用10μmol·L-1的 DCFH-DA孵育细胞20 min(根据产品说明)。DCFH-DA被细胞内的非特异性酯酶脱去乙酰基,被ROS氧化成荧光性化合物DCF,流式细胞仪检测DCF荧光强度。
1.2.5 流式检测 Nov对 K562和K562/G01细胞DNA损伤的影响 取对数生长期K562及K562/G01细胞,10μmol·L-1的 Brdu预处理 30 min,不同浓度的Nov和IM处理细胞24 h,收集细胞,以800 r·min-1离心5 min,弃上清,破膜,DNase处理1 h,anti-BrdU,anti-H2AX,anti-cleaved parp荧光探针室温孵育20 min,按试剂盒说明操作。转入到流式管中,上机检测。
1.2.6 流式细胞仪检测药物对K562及K562/G01细胞线粒体膜电位[8]的影响 取对数生长期的K562和 K562/G01细胞,分组并加入不同浓度的Nov和IM处理4 h;收集细胞,800×g离心5 min;用冷PBS重悬洗涤细胞2次;按试剂盒说明进行JC-1染色,37℃避光孵育20 min;流式细胞仪检测。
1.2.7 碘化丙啶染色法流式细胞仪检测细胞周期
取对数生长期的K562及K562/G01细胞,分组并加入不同浓度的Nov和IM,37℃培养48 h;收集细胞,800 g离心5 min;用冷的 PBS重悬洗涤细胞1次,再用0.5 ml冷PBS重悬细胞,并将其缓慢的滴加4.5 ml预冷体积分数为0.75乙醇中,-20℃冰箱中放置过夜;800×g离心5 min,弃去乙醇,用PBS洗涤1次,用0.5 ml含有50 mg·L-1RNA酶和50 mg·L-1碘化丙啶的PBS重悬细胞,室温避光孵育30 min,流式细胞仪检测。实验结果采用Modifit软件进行分析。
1.2.8 流式细胞仪检测药物对K562及K562/G01细胞凋亡的影响 取对数生长期的K562和K562/G01细胞,不同浓度的Nov和IM处理48 h,收集细胞,800×g离心5 min,冷PBS重悬洗涤细胞2次,用500μl含有分别含有5μl Annxin V-FITC和5μl PI的Binding Buffer重悬混匀细胞,室温避光孵育15 min,转移入流式管中,流式细胞仪上机检测。
1.2.9 蛋白免疫印迹法检测药物对K562和K562/G01细胞相关蛋白表达的影响 取对数生长期的K562和K562/G01细胞,不同浓度的 Nov处理48 h,收集裂解细胞,蛋白定量,98℃蛋白变性,SDS聚丙烯酰胺凝胶电泳、转膜,封闭,相应一抗过夜孵育,TBST洗涤3次,每次10 min,室温下二抗孵育1 h,TBST洗涤3次,每次10 min,用 ECL Western blotting Detection System超强发光底物在Image station 4000MM成像系统进行曝光显影。
1.3 统计方法 实验数据采用¯x±s表示,实验独立重复3次,采用One-Way analysis of variance统计分析。
2 结果
2.1 Nov可明显抑制 K562和 K562/G01细胞的增殖 不同浓度的Nov和IM处理K562和K562/G01细胞48 h后,MTT法检测,结果采用GraphPad Prism5软件分析(Fig 1),可以明显看出随着药物浓度的增加,Nov能明显抑制K562和K562/G01细胞的增殖,IC50分别为(232.50±0.22)μmol·L-1和(237.10±0.13)μmol·L-1。
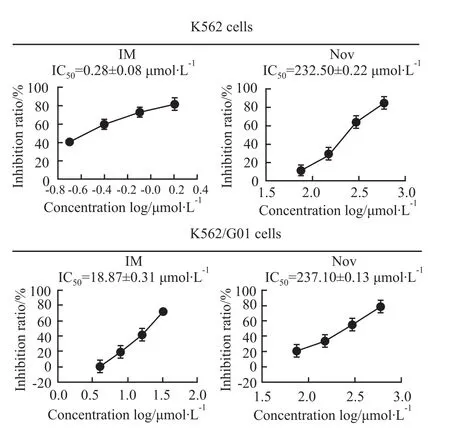
Fig 1 Proliferation inhibition of K562 and K562/G01 with Nov treatments
CFSE是一种能够轻易穿透细胞膜并对细胞无毒性作用的荧光染料[9]。在细胞分裂增殖过程中,标记荧光可平均分配至子代细胞中,荧光强度会随着细胞的分裂而逐级递减,因此可用于检测细胞增殖、细胞周期的估算及细胞分裂等情况。实验结果表明Nov能减少K562和K562/G01细胞的增殖分裂代数,抑制细胞的增殖(Fig 2)。
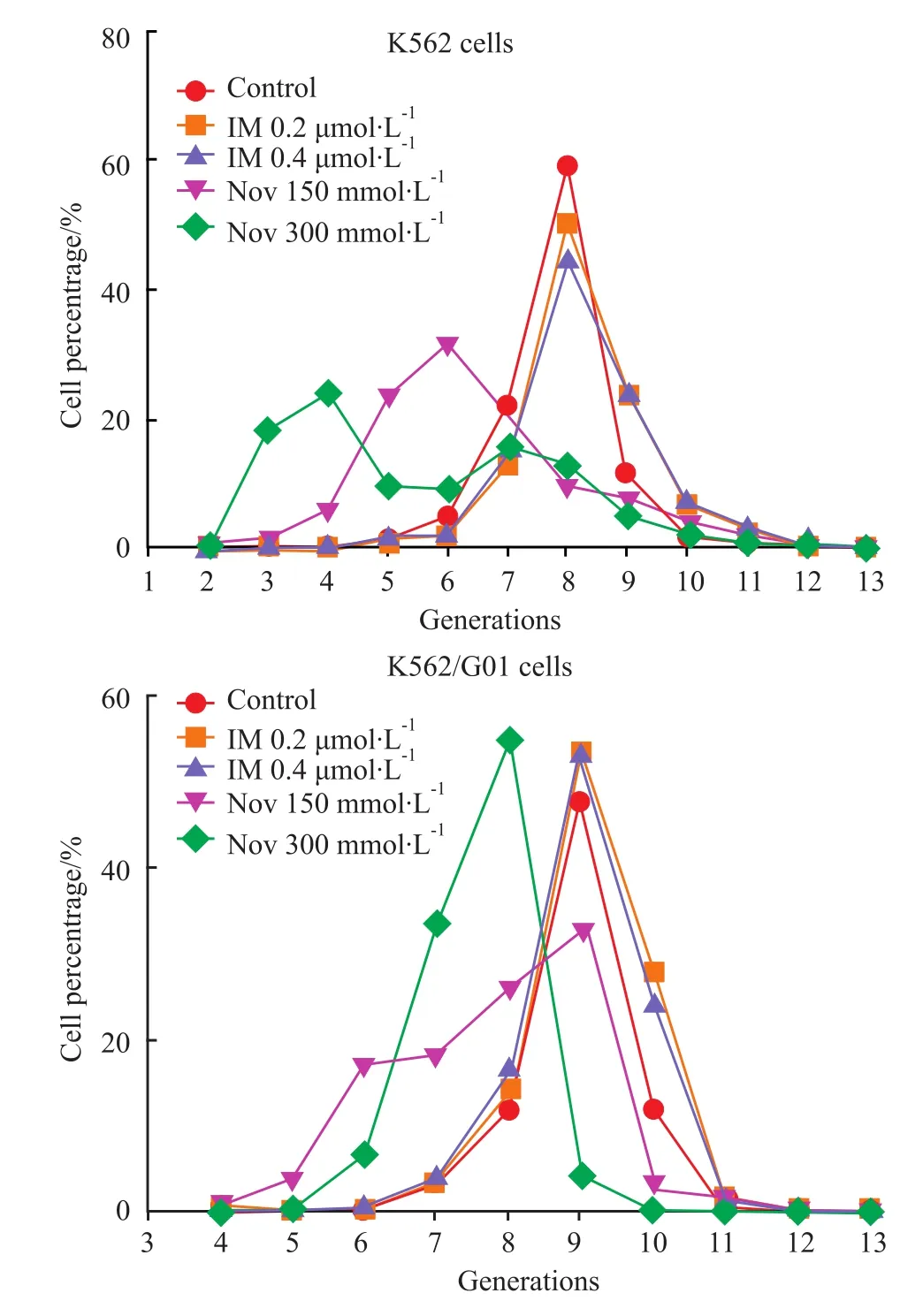
Fig 2 Effect of Nov treatments on proliferation generations of K562 and K562/G01
2.2 Nov明显增加 K562和 K562/G01细胞内ROS水平,并诱导DNA的损伤 不同浓度的Nov和IM处理K562和K562/G01细胞24 h后,ROS检测表明Nov能明显增加K562及K562/G01细胞内ROS的水平。ROS能够氧化DCFH-DA成荧光性化合物DCF,因此检测DCF的荧光强度可以间接反映ROS的水平。与对照组相比0.2、0.4μmol·L-1IM,150、300μmol·L-1Nov,5 mmol·L-1NAC,5 mmol·L-1NAC+300μmol·L-1Nov处理 K562细胞24 h DCF增加的倍数分别为1.09±0.03(NS),1.23±0.02(P<0.01),1.44±0.03(P<0.01),1.67±0.04(P<0.01),0.98±0.02(NS),1.09±0.02(NS)(P<0.01,n=3);对于 K562/G01细胞,0.2、0.4μmol·L-1IM,150、300μmol·L-1Nov,5 mmol·L-1NAC,5 mmol·L-1NAC+300μmol·L-1Nov处理24 h DCF增加的倍数分别为1.02±0.01(NS),1.06±0.02(NS),1.56±0.05(P<0.01),1.71±0.03(P<0.01),0.97±0.03(NS),1.01±0.01(NS)(Fig 3)。

Fig 3 Effect of Nov treatments on intracellular ROS(¯x±s,n=3)
r-H2AX是DNA损伤的一个灵敏性标志物[10],在DNA损伤时,其聚集在DNA损伤处,招募DNA损伤应答的相关蛋白。Parp是DNA损伤修复的功能蛋白,当其被切割成 cleaved-parp便失去修复DNA损伤的功能,从本实验的结果可以看出Nov能明显增加K562和K562/G01细胞中r-H2AX的表达和Parp的切割,而NAC预先处理1 h能逆转Nov对r-H2AX和Parp的改变(Fig 4)。
2.3 Nov降低 K562和 K562/G01线粒体膜电位
不同浓度的Nov和IM处理K562和K562/G01细胞24 h,JC-1染色流式细胞术检测线粒体膜电位的改变,结果表明随着Nov药物浓度的增加JC-1 Red/Green的比值随之减小。5 mmol·L-1NAC预先处理细胞1 h能够逆转Nov诱导的线粒体膜电位的降低(Fig 5)。
2.4 Nov使K562和K562/G01细胞周期阻滞G2/M期和增加细胞的凋亡率 不同浓度的Nov和IM处理K562和K562/G01细胞48 h,PI染色流式细胞术检测细胞周期,结果表明随着Nov药物浓度的增加,G2/M期K562和K562/G01细胞比例明显增加,而IM对细胞周期的影响较小(Fig 6)。
不同浓度的Nov和IM处理K562和K562/G01细胞48h,PI和Annexin V-FITC双染流式细胞术检测细胞凋亡结果表明,对于K562细胞,与对照组相比,0.2,0.4μmol·L-1IM,150,300μmol·L-1Nov,5 mmol·L-1NAC,5 mmol·L-1NAC+300 μmol·L-1Nov诱导细胞凋亡率分别为(9.70±0.57)%(P<0.01),(18.50±0.60)%(P<0.01),(9.30±0.98)%(P<0.01),(30.40±0.93)%(P<0.01),(3.867±0.93)% (NS),(7.467±0.41)%;对于K562/G01细胞,与对照组相比0.2、0.4μmol·L-1IM,150、300μmol·L-1Nov,5 mmol·L-1NAC,5 mmol·L-1NAC+300μmol·L-1Nov诱导细胞凋亡率分别为(13.27±1.31)%(NS),(12.23±1.56)%(NS),(29.63±0.58)%(P<0.01),(42.77±1.45)%(P<0.01),(10.27±1.27)%(NS),(11.43±1.49)%(NS),Fig 7。
2.5 Nov对 K562及 K562/G01蛋白表达的影响
不同浓度的Nov和IM处理K562和K562/G01细胞48 h,蛋白免疫印迹结果表明,Nov能明显增加r-H2AX、p-ATM、p-CHK1、p-CHK2、p-p53、细胞色素 C的表达以及 Parp和 Caspase-3的切割,而降低CDC25A和CDC25C的表达(Fig 8)。

Fig 4 Nov induced DNA damage and inhibited the function of parp(¯x±s,n=3)
3 讨论
新生霉素在抗肿瘤方面的研究并不很多,可能源于其抗肿瘤的活性较低,从本实验的结果可以看出Nov虽然能够抑制K562和K562/G01细胞的增殖,但IC50偏高,活性偏低,相对于CML治疗的新型靶向药物IM,IM抗CML活性是Nov的1 000倍,但Nov也具有其优点:其一是毒性低、价格低廉;其二是Nov对K562和IM耐药K562/G01细胞都具有相当的活性。因此研究Nov的作用机制对于合成新的活性更高的衍生物提供了理论基础,也为解决CML耐药问题提供一个新的策略。ROS在DNA损伤过程中起到重要的作用[11],它能够攻击细胞的重要结构,如细胞膜、细胞核以及DNA,导致这些结构的损伤,使细胞的功能受到损害。随着Nov浓度的增高,细胞内ROS水平也随之增高,说明Nov能够激活ROS。当先用抗氧化剂NAC预处理细胞1 h,再加上Nov处理,从本实验的结果可以看到ROS水平明显降低,与对照组没有明显差异,证实Nov的确能够诱导ROS的产生。Nov是否通过ROS途径诱导DNA的损伤?通过流式检测DNA损伤的标志物r-H2AX以及修复蛋白Parp的变化,实验结果表明,随着药物浓度的增加,r-H2AX表达随着增加,Parp的切割成cleaved Parp也明显增加,但预先用NAC处理1 h,会逆转r-H2AX和Parp的变化,同样蛋白免疫印迹结果也表明Nov能增加r-H2AX和Parp蛋白的切割,进一步证实Nov是通过激活ROS进而诱导DNA损伤。
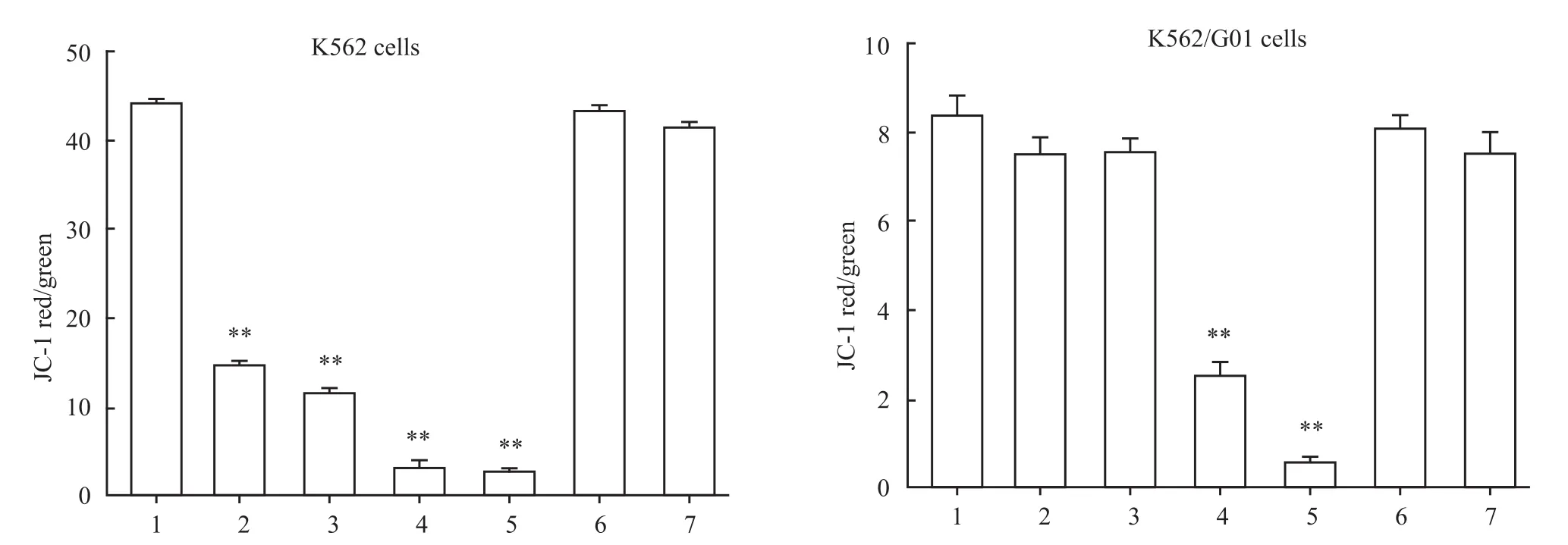
Fig 5 Nov decreased mitochondrial membrane potential of K562 and k562/G01 cells(¯x±s,n=3)
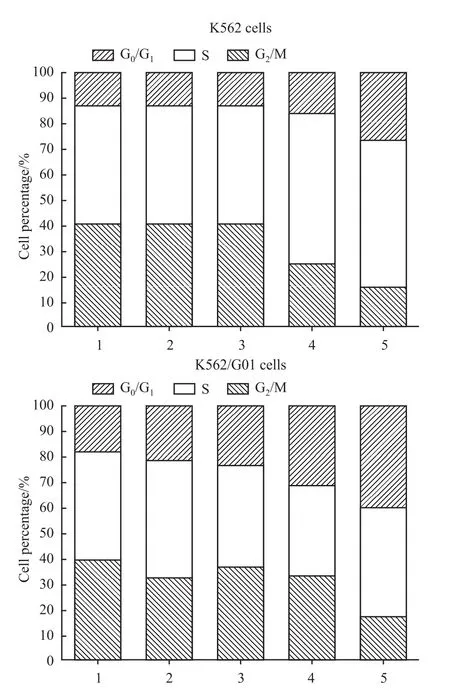
Fig 6 Nov induced cell cycle G2/M phase arrest of both K562 and k562/G01 cells
细胞在遭受DNA损伤时,会激活DNA损伤应答反应[12],包括激活细胞周期检测点,使损伤细胞周期发生阻滞,为细胞启动DNA损伤修复提供时间,Chk1和Chk2蛋白在细胞周期检测过程中发挥重要的作用[13],在细胞DNA发生损伤时,磷酸化而活化,识别细胞DNA损伤发生的时相,影响下游的相关蛋白的表达和修饰如抑癌基因产物p53的磷酸化等,使细胞阻滞某个周期时相。本实验结果表明Nov能够使 K562和 K562/G01细胞 DNA损伤,激活细胞周期检测点功能,使Chk1和Chk2磷酸化,使细胞周期阻滞在G2/M期。CDC25A和CDC25C在维持细胞周期G2/M的正常功能发挥重要的作用[14],在 正 常 的 细 胞 周 期 进 程 中 CDC25A和CDC25C参与有丝分裂促进因子MPF(mitosis-promoting factor or M-phase-promoting factor)[15]的形成,保证细胞能正确顺利完成有丝分裂。当CDC25A和CDC25C表达减少时,MPF复合物形成受阻,功能缺失,细胞不能跨过G2/M期完成有丝分裂进程。从实验结果可以看出Nov能够明显降低CDC25A和CDC25C的表达,是Nov诱导K562和K562/G01细胞周期阻滞在G2/M期的分子机制。当DNA损伤不能有效修复,细胞便通过激活程序性死亡途径,诱导凋亡[16],本实验结果证明,由于Nov的作用,DNA损伤修复蛋白Parp的切割增加,导致功能丧失,细胞不能及时正确完成修复功能,随之启动线粒体凋亡通路诱导细胞凋亡,表现为线粒体膜电位的降低、Cytometrome C释放、Cleaved Caspase-3水平增加,流式凋亡检测也表明随着Nov浓度增加,细胞凋亡率随之增加。

Fig 7 Nov increased the apoptotic ratio of both K562 and K562/G01 cells(¯x±s,n=3)

Fig 8 Effect of proteins expression on K562 and K562/G01 cells with Nov treatment
4 结论
Nov通过激活ROS,诱导K562及K562/G01细胞DNA的损伤,激活细胞周期检测点,阻滞细胞于G2/M期,抑制损伤修复相关蛋白的功能,使受损细胞得不到及时有效的修复,激活线粒体凋亡通路诱导细胞凋亡。
参考文献:
[1]吴丽贤,许建华,张昆仲,等.Hsp90C-端抑制剂新生霉素与HSP90N-端抑制剂联合应用对白血病细胞的作用[J].中国药理学通报,2008,24(2):165-71.
[1]Wu L X,Xu JH,Zhang K Z,et al.Effects of cotreatment or sequence treatment with Hsp90 C-terminal inhibitor NB and HSP90 N-terminal inhibitor GA on leukemia cells[J].Chin Pharmacol Bull,2008,24(2):165-71.
[2]吴丽贤,许建华,张昆仲,等.新生霉素抑制HL-60/Bcr-Abl细胞增殖与阻断Hsp90伴侣功能的关系[J].中国药理学通报,2007,23(11):1419-24
[2]Wu L X,Xu JH,Zhang K Z,et al.The mechanisms of apoptosis in HL-60 cells induced by Hsp90 inhibitor novobiocin[J].Chin Pharmacol Bull,2007,23(11):1419-24.
[3]Icolini F E,Ibrahim A R,Soverini S,et al.The BCR-ABLT315I mutation compromises survival in chronic phase chronic myelogenous leukemia patients resistant to tyrosine kinase inhibitors,in a matched pair analysis[J].Haematologica,2013,98(10):1510-6.
[4]Paul JS,Sandra M B.A DNA topoisomeraseⅡ-independent route for novobiocin-mediated resistance to DNA binding agents[J].Cancer Chemother Pharmacol,1990,26(2):257-62.
[5]Wu L X,Xu JH,Zhang K Z,et al.Disruption of the Bcr-Abl/Hsp90 protein complex:a possible mechanism to inhibit Bcr-Ablpositive human leukemic blasts by novobiocin[J].Leukemia,2008,22(7):1402-9.
[6]Du Y,Yan L,Wang J,et al.b1-Adrenoceptor Autoantibodies from DCM Patients Enhance the Proliferation of T Lymphocytes through the b1-AR/cAMP/PKA and p38 MAPK Pathways[J].PLoSOne,2012,7(12):e52911.
[7]Chen H,Zhang B,Yao Y,et al.NADPH oxidase-derived reactive oxygen species are involved in the HL-60 cell monocytic differentiation induced by isoliquiritigenin[J].Molecules,2012,17(11):13424-38.
[8]Sun H J,Meng L Y,Shen Y,et al.S-benzyl-cysteine-mediated cell cycle arrest and apoptosis involving activation of mitochondrial-dependent caspase cascade through the p53 pathway in human gastric cancer SGC-7901 cells[J].Asian Pac J Cancer Prev,2013,14(11):6379-84.
[9]Xu W L,Li S L,Wen M,et al.Tracking in vivo migration and distribution of antigen-specific cytotoxic T lymphocytes by 5,6-carboxyfluorescein diacetate succinimidyl ester staining during cancer immunotherapy[J].Chin Med J,2013,126(16):3019-25.
[10]Zhang T,Tan Y,Zhao R,et al.DNA damage induced by oridonin involves cell cycle arrest at G2/M phase in human MCF-7 cells[J].Wspolczesna Onkol,2013,17(1):38-44.
[11]Swindall A F,Stanley JA,Yang E S.PARP-1:Friend or Foe of DNA damage and repair in tumorigenesis[J].Cancers,2013,5(3):943-58.
[12]Wu L,Shao L,An N,et al.IKKb Regulates the repair of DNA double-strand breaks induced by Ionizing radiation in MCF-7 breast cancer cells[J].PLoSOne,2011,6(4):e18447.
[13]Hu Z,Kong F,Si M,et al.Riccardin D exerts its antitumor activity by inducing DNA damage in PC-3 prostate cancer cells in vitro and in vivo[J].PLoSOne,2013,8(9):e74387.
[14]Zhao Y,Cui Y,Han J,et al.Cell division cycle 25 homolog c effects on low-dose hyper-radiosensitivity and induced radioresistance at elevated dosage in A549 cells[J].J Radiat Res,2012,53(5):686-94.
[15]Zhao Y,Haccard O,Wang R,et al.Roles of greatwall kinase in the regulation of cdc25 phosphatase[J].Mol Biol Cell,2008,19(4):1317-27.
[16]陈 俊,唐安洲,梁 钢,等.苦参碱改构体X调控Caspase-3,Caspase-8和Caspase-9蛋白表达诱导人鼻咽癌CNE1凋亡的研究[J].中国药理学通报,2013,29(8):1136-40.
[16]Chen J,Tang A Z,Liang G,et al.Matrine derivant X induces apoptosis of human nasopharyngeal carcinoma CNE1 cells by regulation of Caspase-3,Caspase-8 and Caspase-9 expression[J].Chin Pharmacol Bull,2013,29(8):1136-40.