白芍总苷对糖尿病大鼠肾组织Toll样受体信号通路调节的研究
2014-05-19章超群武晓旭吴永贵徐兴欣
章超群,武晓旭,吴永贵,徐兴欣,张 炜,王 坤
(安徽医科大学第一附属医院肾内科,安徽合肥 230022)
新近研究表明炎性参与糖尿病肾病(diabetic nephropathy,DN)发生、发展[1]。Toll样受体(Tolllike-receptors,TLR)是一个主要分布于炎症细胞的识别病原分子的受体超家族,其中TLR2与TLR4可以通过髓分化因子88(myeloid differentiation factor88,MyD88)依赖和MyD88非依赖途径,激活NF-κB,介导下游信号传导,引起前炎症因子TNF-α、IL-1β表达增加,后者再进一步激活NF-κB,继而诱发炎症信号不断放大[2]。多个研究表明TLRs家族的成员可能参与介导DN的发生、发展。白芍总苷(total glucosides of paeony,TGP)是从白芍干燥根中提取的混合物,主要成分为芍药苷、羟基芍药苷、芍药花苷、芍药内酯苷、苯甲酰芍药苷等,对多种炎症性病理如大鼠佐剂性关节炎、角叉菜胶诱导的大鼠足爪肿胀和环磷酰胺诱导的细胞和体液免疫增高或降低等具有明显的抗炎和免疫调节作用[3]。我们以前的研究表明TGP对DN有明显保护作用,并与抑制肾组织NF-κB激活,抑制 TNF-α、IL-1β表达有关[4-5],但TGP对DN肾内TLR信号通路调节作用尚未阐明,本实验进一步观察TGP对糖尿病大鼠肾组织TLR通路相关蛋白表达的影响,为TGP用于DN临床干预提供实验基础。
1 材料与方法
1.1 动物 昆明种Munich-Wistar大鼠50只,由安徽医科大学实验动物中心提供,体质量180~200 g,于(22±2)℃、(55±5)%相对湿度、12 h~12 h光照周期环境中适应饲养1周后实验。
1.2 药品与试剂 TGP由安徽医科大学临床药理研究所魏伟教授惠赠,使用前溶于1%的羧甲基纤维素钠溶液中;链脲佐菌素(streptozotocin,STZ)系Sigma公司生产,用前于 0.01 mmol·L-1枸橼酸缓冲液中溶解,pH 4.5;尿白蛋白测定试剂盒购自法国SPI公司;TLR2、TLR4、MyD88、NF-κB多克隆抗体和ED-1单克隆抗体购自美国 Santa Cruz公司;p-IRAK1和p-IRF3多克隆抗体购自北京博奥森公司;辣根酶标记山羊抗兔/小鼠IgG购自武汉博士德公司,硝酸纤维膜(NC)购自美国Amersham公司;ECL发光试剂购自Pierce公司。TLR2、TLR4、MyD88及GAPDH引物及探针由上海生工公司合成;M-MLV反转录酶、RNA酶抑制剂购自美国Promega公司;d-NTP、随机引物购自上海生工公司;Tag酶及MgCl2购自美国Roche公司;TRIzol试剂购自美国Invitrogen公司。
1.3 建立糖尿病大鼠模型 实验大鼠腹腔1次性注射STZ 65 mg·kg-1,48~72 h后于尾静脉采血,应用血糖仪测定全血血糖,血糖在16.7 mmol·L-1以上者确定为糖尿病模型,正常组仅注射等量枸橼酸缓冲液。
1.4 动物分组及处理 大鼠随机分为:正常组(Normal,n=10)、糖尿病模型组(Diabetic model,n=10)、糖尿病+TGP组(Control diabetic+TGP,n=30)。其中TGP组再随机分为3组,每组10只,按50、100、200 mg·kg-1·d-1灌胃给药,正常组与糖尿病模型组给予等量溶媒。实验期间不应用胰岛素,观察8周。
1.5 标本收集 大鼠处死前1 d放入代谢笼中准确收集24 h尿液,离心后分装,-80℃保存,待测尿白蛋白含量。然后在戊巴比妥腹腔注射麻醉下行右侧颈总动脉插管收集血标本,4℃离心取血浆保存于-20℃待测血糖水平。然后,通过右侧颈总动脉插管注入4℃预冷的生理盐水反复灌洗肾脏,至整个肾脏颜色变苍白后游离,置于冰上,取8 mm3大小肾组织置于4%多聚甲醛溶液中固定,石蜡包埋,制成厚度为2μm经多聚赖氨酸处理的石蜡切片,进行免疫组化研究,剩余组织迅速放入-80℃冰箱待测。
1.6 尿白蛋白排泄率(AER)的测定 采用ELISA法测定尿白蛋白含量,AER为尿白蛋白含量与24 h尿量乘积。
1.7 免疫组织化学 石蜡切片常规脱蜡至水,微波热修复抗原,3%H2O2封闭内源性过氧化物酶,山羊血清封闭非特异性抗原,分别滴加兔抗大鼠TLR2多克隆抗体(1∶75)、兔抗大鼠TLR4多克隆抗体(1∶400)、小鼠抗大鼠 ED-1单克隆抗体(1∶100),4℃孵育过夜,滴加聚合物增强剂及辣根酶标记山羊抗兔/小鼠IgG多聚体,DAB显色,阴性正常采用PBS代替一抗。每张切片在高倍镜视野(×400)下随机选择10个肾小球和10个肾小管-间质区,使用Image-ProPlus6.0图像分析软件计数每个肾小球及肾小管-间质区阳性细胞数及阳性%。
1.8 Western blot 将取出的100 mg肾组织放置于冰上,并用冷生理盐水(含0.1%蛋白酶抑制剂)冲洗,加入适量裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)冰上裂解后超声匀浆,4℃离心30 min取上清液测蛋白浓度。取30 mg蛋白煮沸5 min后,经6%~15%SDS-PAGE电泳,电转移至NC膜上,在5%脱脂奶粉-PBST溶液4℃封闭过夜,洗膜后加入免抗大鼠 TLR2(1∶200);TLR4(1∶200);MyD88(1∶500);p-IRAK1(1∶100);p-IRF3(1∶100);NF-κB p65(1∶100)和 β-actin(1∶500)4℃过夜,洗膜后再用 HRP标记的二抗(1∶2 000)杂交,37℃,1 h。洗膜后在暗室中加ECL发光试剂,X线胶片曝光1~2 min后显影、定影。杂交信号在图像分析系统中进行光密度扫描。应用管家基因β-actin作为蛋白上样量正常,其余组与其相比得到相对量,取均值。
1.9 实时定量PCR TRIzol法进行组织总RNA提取,核酸蛋白紫外分析仪检测RNA质量和浓度,要求A260/A280在1.8~2.0,并调整RNA浓度至1 mg·L-1。TLR2引物序列:上游 5′-AAACTGTGTTCGTGCTTTCTGA-3′,下 游 5′-CTTTCTTCTCAATGGGTTCCAG-3′;TLR4引物序列:上游,5′-GAATGAGGACTGGGTGAGAAAC-3′,下游 5′-ACCAACGG CTCTGGATAAAGT-3′;MyD88引物序列:上游 5′-ATACGCAACCAGCAGAAACAG-3′,下 游 5′-TATCATTGGGGCAGTAGCAGA-3′;GAPDH引物序列:上游 5′-CCACCCATGGCAAATTCC-3′,下游 5′-TGGGATTTCCATTGATGACAAG-3′。采 用 SYBR Green PCR试剂盒进行PCR,终体积25μl。于AB I 7000 Real Time PCR扩增仪进行反转录及PCR反应,每个样本均设3个复孔,取均值。获得平均Ct值,按照2-ΔΔCt计算目的基因表达值。
1.10 统计学处理 采用SPSS 17.0统计软件包进行数据分析,正态分布资料的实验数据用¯x±s表示,AER为非正态分布资料,采用对数转换后,用几何均数×/÷耐受因子表示。组间比较采用单因素方差分析。
2 结果
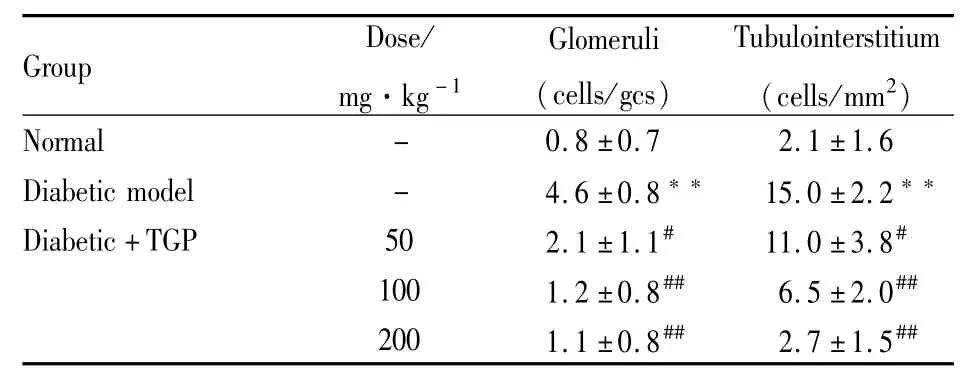
2.1 各组大鼠一般指标的变化 糖尿病模型组大鼠表现为血糖升高、体重下降、相对肾重增加,TGP组不能抑制大鼠血糖升高与体重下降。TGP组大鼠相对肾重与糖尿病模型组相比有所下降,但差异无显著性。糖尿病模型组大鼠AER明显高于正常组(P<0.01),TGP组大鼠AER水平明显低于糖尿病模型组(P<0.05,0.01),见 Tab 1。
2.2 各组大鼠肾组织 TLR2、TLR4和ED-1表达的变化 免疫组化显示糖尿病模型组大鼠肾小管-间质TLR2蛋白表达明显高于正常组(P<0.01),TGP给药组(50、100、200 mg·kg-1·d-1)肾小管 -间质TLR2蛋白表达明显低于糖尿病模型组(P<0.01),见Fig 1,Tab 2;糖尿病模型组大鼠肾小球与肾小管-间质TLR4蛋白表达明显高于正常组(P<0.01),TGP给药组(50、100、200 mg·kg-1·d-1)肾小球与肾小管-间质TLR4蛋白表达明显低于糖尿病模型组(P<0.05,0.01),见 Fig 2,Tab 2;糖尿病模型组大鼠肾小球与肾小管-间质ED-1阳性细胞数明显高于正常组(P<0.01),TGP给药组(50、100、200 mg·kg-1·d-1)肾小球与肾小管 -间质ED-1阳性细胞数明显低于糖尿病模型组(P<0.05,P<0.01),见 Fig 3,Tab 3。
2.3 各组大鼠肾组织 TLR2、TLR4、MyD88、p-IRAK1,p-IRF3与 NF-κB p65蛋白表达变化 Western blot条带光密度分析显示糖尿病模型肾组织TLR2、TLR4、MyD88、p-IRAK1、p-IRF3与 NF-κB p65蛋白表达明显高于正常组(P<0.01),TGP 50、100、200 mg·kg-1给药8周肾组织 TLR2、TLR4、MyD88、p-IRAK1、p-IRF3与NF-κB p65蛋白表达明显低于糖尿病组(P<0.05,P<0.01),见 Fig 4a、4b,Fig 5。

Tab 1 General and metabolic parameters in five groups of rats(¯x±s,n=10)

Fig 1 Immunostaining of TLR2 in the kidneys(×400)

Tab 2 Semiquantitative assessment of TLR2 and TLR4 by immunohistochemistry staining in five groups of rats(¯x±s)

Fig 2 Immunostaining of TLR4 in the kidneys(×400)

Fig 3 Immunostaining of ED-1 in the kidneys(×400)

Fig 4a Expression of TLR2,TLR4,MyD88,p-IRAK1 and p-IRF3 determined by Western blot analysis in the kidney

Fig 4b Densitometric analysis of TLR2,TLR4,MyD88,p-IRAK1 and p-IRF3 determined by Western blot analysis in the kidney(¯x±s,n=10)

Fig 5 Densitometric analysis of NF-κB determined by Western blot analysis in the kidney(¯x±s,n=10)
Tab 3 Semiquantitative assessment of ED-1immunohistochemistry staining in five groups of rats(¯x±s)
2.4 各组大鼠肾组织 TLR2,TLR4和 MyD88 mRNA表达变化 实时定量PCR分析显示糖尿病模型肾组织TLR2、TLR4和MyD88 mRNA表达明显高于正常组(P<0.01)。TGP 50、100、200 mg·kg-1给药8周肾组织 TLR2、TLR4和 MyD88 mRNA表达明显低于糖尿病模型组(P<0.05,P<0.01),见Fig 6。
3 讨论
Toll样受体(TLR)是一类病原分子识别受体,共有11个成员[6-7],属于 I型跨膜蛋白,其胞外区结构有富含亮氨酸的重复序列,负责识别不同的病原分子,胞内区与IL-1受体的胞内区相似,负责受体活化后的信号转导[8]。近年来研究发现,TLR是参与免疫炎症反应的一个关键因素,且认为TLR是介导免疫和炎症反应的主体[9]。TLR2和TLR4受体是发现最早的TLR亚型,其在免疫炎症性疾病中的作用也越来越多地引起关注。TLR2和TLR4能特异性地识别PAMP,通过跨膜结构将病原相关分子刺激信号导入细胞内,启动包括MyD88依赖性及非依赖性信号转导途径,使转录因子NF-κB和AP-1活化。NF-κB是存在于细胞质中的一种快反应转录因子,属 NF-κB/Bel家族的一员,由 p50和p65组成的异源二聚体。当细胞受到氧化应激或者细胞因子等作用的情况下,NF-κB抑制蛋白发生磷酸化和降解,并与NF-κB解离,解离后的NF-κB转移到细胞核与其调控的靶DNA上的特异位点结合,激活其靶基因的转录[1]。激活的NF-κB可诱导免疫细胞的多种炎症相关基因表达[10],进而参与免疫炎症反应调控。
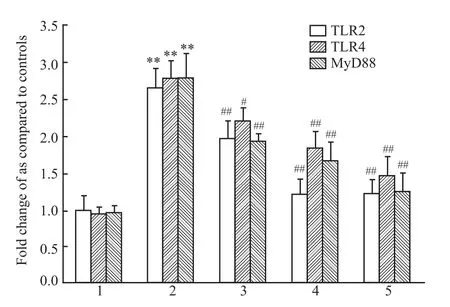
Fig 6 Expression of TLR2,TLR4 and determined by Real-time PCR in the kidney(¯x±s,n=10)
DN是一种进行性发展的疾病,炎症机制是DN发生、发展的关键因素,TLR信号通路在糖尿病及其相关并发症的发生、发展中的作用已得到肯定,已有实验证明TLR2和TLR4在糖尿病肾组织中表达增加[11]。DN大鼠肾组织 TLR2及其内源性配体(HSP70和HMGB1)的表达增加,并与MyD88和MCP-1表达呈正相关[12]。李贞琼等[13]研究初步证实了TLR4参与DN肾小球硬化的发生和发展,肾小球中TLR4表达增加,一方面激活免疫细胞和肾脏实质细胞,分泌大量炎症介质和细胞因子,促进肾小球硬化,另一方面经由连接蛋白MyD88依赖性或非依赖性信号转导途径诱导NF-κB活性增加,NF-κB被激活后除调节炎性因子的基因转录外还调节多种纤维相关因子的基因转录,同时NF-κB本身也可导致成纤维细胞增生、分化,促进肾小球硬化的发生及发展,抑制TLR信号通路激活在防治DN病程进展中具有重要的意义。
现代药理研究发现TGP可以有效抑制巨噬细胞分泌TNF-α、IL-1β、IL-2等多种炎性介质,同时可促进特异性T调节细胞和非特异性T调节细胞的诱导,这可能是TGP发挥免疫调节作用的基础,但是TGP抗炎作用的转录因子水平的机制至今仍不十分清楚。在临床与动物实验中已证实TGP治疗类风湿关节炎、免疫性肝损害、系统性红斑狼疮及系膜增生型肾炎疗效确切,无明显毒副作用。我们的实验研究[14]表明,TGP可通过恢复肾小球Nephrin表达而明显减轻糖尿病大鼠尿白蛋白排泄,同时抑制肾组织细胞外基质蛋白Ⅳ型胶原的产生,对糖尿病大鼠肾小管-间质损伤有明显的保护作用,而且,我们前期研究表明,TGP可抑制糖尿病肾组织TNF-α、IL-1及 ICAM-l的高表达[4-5]。
TGP对DN肾内TLR信号通路的调节作用尚未阐明,进一步研究TGP对DN的作用机制可为TGP应用于DN临床干预提供实验基础。本实验结果显示正常组大鼠中 TLR2、TLR4、MyD88、p-IRAK1、p-IRF3和NF-κB p65表达呈现弱表达,而糖尿病组模型肾组织中 TLR2、TLR4、MyD88、p-IRAK1、p-IRF3和NF-κB p65表达明显上调,AER明显高于正常组,提示TLR信号通路的表达上调,与肾组织损伤加重有关,参与了DN的进展。糖尿病中存在高糖、血液动力学障碍等均可损伤肾脏固有细胞,细胞受损后TLR信号通路表达上调,同时促进白细胞滤出到损伤部位并活化。活化的炎症细胞除本身可表达TLR,还可以释放大量的炎症介质,从而TLR信号通路介导的获得性免疫反应被触发、炎症细胞因子及效应细胞分子大量产生,导致肾脏炎症反应,进一步证实了炎症反应参与了DN的发生、发展过程。而 TGP治疗组肾组织中 TLR2、TLR4、MyD88、p-IRAK1、p-IRF3和 NF-κB p65表达明显下调,AER改变明显有所减轻,提示TGP对DN的保护作用与抑制TLR信号通路相关,其可能通过阻断了TLR信号通路介导的多种炎症与细胞因子形成,从而减轻肾脏炎症损害,进一步减轻肾脏损伤。本实验同样发现糖尿病组大鼠肾组织中巨噬细胞浸润明显高于正常组,经TGP干预后,与糖尿病模型组比较,肾组织中巨噬细胞浸润明显减少。但TGP作用于TLR炎性信号通路的具体机制尚不明确,可在今后的体内、体外研究中进一步阐明。
参考文献:
[1]Mora C,Navano JF.The role of inflammation as a pathogenic factor in the development of renal disease in diabetes[J].Curr Diab Rep,2005,5(6):399-401.
[2]Li M,Yu L,She T,et al.AstragalosideIV attenuates Toll-like receptor 4 expression via NF-κB pathway under high glucose condition in mesenchymal stem cells[J].Eur J Pharmacol,2012,696(1):203-9.
[3]徐叔云,陈敏珠,魏 伟,等.免疫药理与临床[M]//周金黄,刘干中,主编.中药药理与临床研究进展.第1册.北京:中国科学技术出版社,1992:49-59.
[3]Xu SY,Chen M Z,Wei W,et al.Immunological pharmacology and clinic[M]//Zhou JH,Liu G Z ed.Progress in Herbal pharmacology and clinical research.Beijing:China Science and Technology Publishing House,1992:49-59.
[4]Wu Y G,Ren K J,Liang C,et al.Renoprotective effect of total glucosides of paeony(TGP)and its mechanism in experimental diabetes[J].J Pharmacol Sci,2009,109(1):78-87.
[5]Su J,Zhang P,Zhang JJ,et al.Effects of total glucosides of paeony on oxidative stress in the kidney from diabetic rats[J].Phytomedicine,2010,17(3):254-60.
[6]Kelly D,Conway S.Bacterial modulation of mucosal innate immunity[J].Mol I immunol,2005,42(8):895-901.
[7]O’Neill LA.Immunology.After the Toll rush[J].Science,2004,303(5663):1480-2.
[8]Akira S,Takeda K.Toll-like receptor signaling[J].Nat Rev Immunol,2004,4(7):499-511.
[9]Lim A K,Tesch G H.Inflammation in Diabetic Nephropathy[J].Mediators Inflamm,2012,2012:1-12.
[10]Koike N,Takamura T,Kaneko S.Induction of reactive oxygen species from isolated rat glomeruli by protein kinase C activation and TNF-alpha stimulation,and effects of a phosphodiesterase inhibitor[J].Life Sci,2007,80(18):1721-8.
[11]Rocchi R.Kimura H.Tzou SC,et al.Toll like receptor,Myd88 and Fc receptor pathways of mast cell mediate the thyroid dysfunctions observed during nonthyroidal illness[J].Proc Natl Acad Sci USA,2007,104(14):6019-24.
[12]Li F,Yang N,Zhang L,et al.Increased expression of toll-like receptor 2 in rat diabetic nephropathy[J].Am J Nephrol,2010,32(2):179-86.
[13]李贞琼,刘建社,全正莉.氯沙坦对实验性糖尿病大鼠肾脏的炎症作用[J].中国中西医结合肾脏病杂志,2007,8(10):569-571.
[13]Li ZQ,Liu JS,Quan ZL.Anti-inflammation effect of losartan on experimental diabetic Nephropathy in rats[J].Chin J Integr Tradit Wes Nephrol,2007,8(10):569-71.
[14]张 培,张晶晶,苏 静,等.白芍总苷对糖尿病大鼠肾脏足细胞相关蛋白Nephrin表达的影响及机制[J].中国药理学通报,2009,25(3):366-70.
[14]Zhang P,Zhang JJ,Su Jet al,Effects of total glucosides of paeony on the expression of Nephrin in the kidney from diabetic rats[J].Chin Pharmacol Bull,2009,25(3):366-70.