ABCA1、ACAT1 DNA甲基化在Hcy致THP-1单核源性泡沫细胞胆固醇流出中作用研究
2014-05-19杨安宁周龙霞王艳华曹成建陈久凯马文斌姜怡邓
杨安宁,王 磊,周龙霞,赵 丽,王艳华,蔡 欣,曹成建,杨 程,陈久凯,马文斌,姜怡邓
(宁夏医科大学1.基础医学院、2.检验学院,宁夏银川 750004)
动脉粥样硬化(atherosclerosis,AS)是以单核源性巨噬细胞大量吞噬脂质并堆积在血管内膜下形成泡沫细胞为特征的慢性疾病[1]。腺苷三磷酸结合盒转运体 A1(ATP-binding cassette transporter A1,ABCA1)和酰基辅酶A胆固醇酰基转移酶1(acylcoenzyme A:cholesterol acyltransferase-1,ACAT1)在此过程中扮演了重要角色。ABCA1介导细胞内磷脂和游离胆固醇转运至载脂蛋白A-1,促进高密度脂蛋白(high density lipoprotein,HDL)生成,启动胆固醇逆向转运,在机体清除脂质过程中发挥重要作用[2]。ACAT1是一种催化胆固醇和脂肪酰辅酶A合成胆固醇酯的酶,其可以降低游离胆固醇对细胞的毒性作用[3]。DNA甲基化作为表观遗传学的重要调控方式,在维持正常细胞功能、遗传印记、胚胎发育、肿瘤形成以及 AS发生中起重要作用[4-5]。循证医学证据表明,同型半胱氨酸(homocysteine,Hcy)是AS的重要独立危险因子,在体内,Hcy可能通过甲硫氨酸循环影响基因甲基化水平参与疾病发生[6]。因此,本文从DNA甲基化修饰角度探讨ABCA1和ACAT1在Hcy致THP-1单核源性泡沫细胞胆固醇流出中的作用及可能机制,为进一步认识泡沫细胞脂质转运平衡提供实验依据。
1 材料与方法
1.1 主要仪器和试剂 倒置相差显微镜(Olympus公司,日本);超净工作台(苏州安泰空气技术有限公司,中国);电泳仪(Bio-Rad,美国);CO2培养箱(Heraeus,德国);Epoch全波段酶标仪(BioTek,美国);BS110S型精密天平(Sartorius,德国);PCR仪(Bio-Rad,美国);HyClone RPMI 1640培养基(Thermo);胎牛血清(杭州四季青生物工程材料研究所);Hcy(Sigma);总胆固醇(TC)试剂盒和游离胆固醇(FC)试剂盒及油红O染色试剂盒(南京建成生物工程研究所);青、链霉素(碧云天生物技术研究所);佛波酯(PMA,Promega);基因组DNA提取试剂盒(北京天根生物技术有限公司);DNA甲基化修饰试剂盒、DNA甲基化转移酶(DNMTs)活性分析试剂盒(Epigentek,美国);引物由上海生工生物工程有限公司合成。
1.2 THP-1单核源性泡沫细胞培养与分组 复苏THP-1单核细胞,加入含10%胎牛血清,1%双抗的RPMI 1640培养基,置37℃、5%CO2培养箱传代培养,以4×109·L-1个细胞接种于25 cm2培养瓶,加入终浓度为100 nmol·L-1PMA的低血清培养基,37℃、5%CO2培养48 h,观察细胞贴壁状态,确定THP-1单核细胞已分化为巨噬细胞。换用含终浓度50 mg·L-1ox-LDL的不同浓度Hcy的RPMI 1640培养基继续培养48 h,观察泡沫细胞形成,收集细胞用于后续实验。实验分组为 ① 对照组:0μmol·L-1Hcy泡沫细胞(单核细胞 +PMA+ox-LDL);②实验组:不同浓度 Hcy(50、100、200、500μmol·L-1)和 100μmol·L-1Hcy+30μmol·L-1叶酸 +30μmol·L-1维生素 B12(100+F+V)干预泡沫细胞,每组3瓶。
1.3 油红O染色观察泡沫细胞形成 小心倒去培养液,用PBS缓冲液漂洗泡沫细胞3遍,4%多聚甲醛固定10 min,60%乙醇浸泡1 min,油红O染色12 min,60%异丙醇分色3 min,37℃蒸馏水洗15 min,苏木素染色1 min,蒸馏水洗后待干,用水性封固剂封片观察。
1.4 巢式降落式甲基化特异性PCR(nMS-PCR)检测ABCA1和ACAT1 DNA甲基化改变并分析两者比值变化 提取细胞DNA并用核酸分析仪检测OD260/OD280值,分析DNA样品纯度和浓度。通过甲基化引物在线设计软件 http://www.urogene.org/methprimer/设计引物,见Tab 1。经PCR扩增后,琼脂糖凝胶电泳检测甲基化和非甲基化程度。
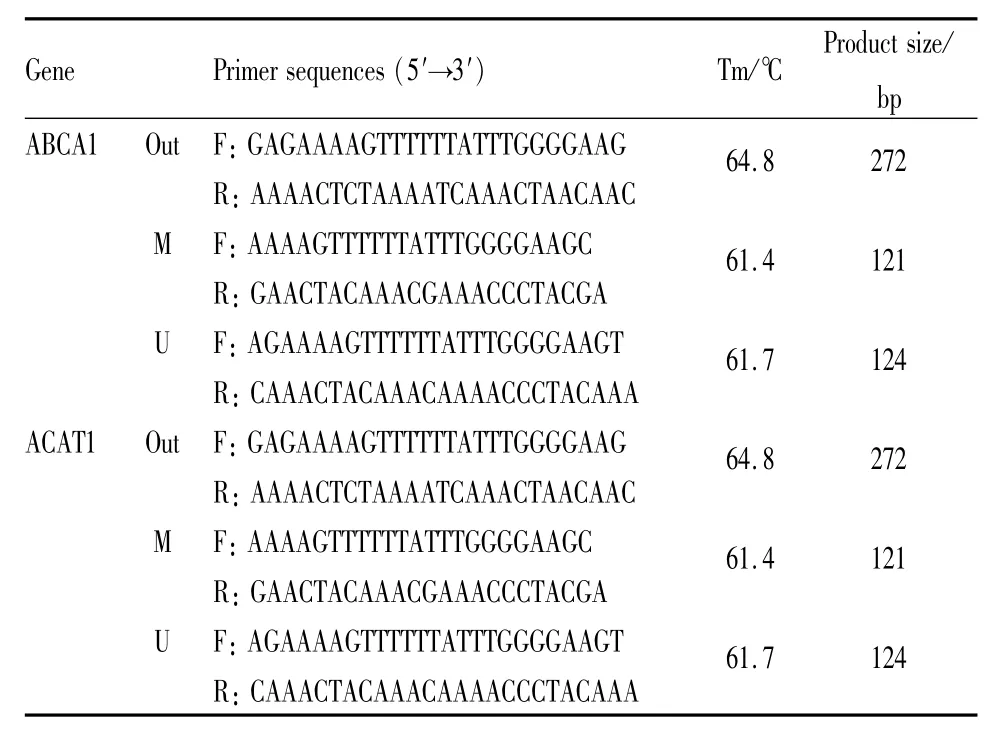
Tab 1 Primer sequence used for nMS-PCR
1.5 ELISA-like检测DNMTs活性 用细胞刮刀收集细胞,PBS洗涤3次,重悬于0.5 ml磷酸钠缓冲液(pH>7.4)中,超声裂解细胞1 min,按照DNMTs活性分析试剂盒说明书操作,用比色法检测泡沫细胞内DNMTs的吸光度值,进一步计算胞内DNMTs活性。
1.6 细胞内胆固醇含量分析 收集细胞,用超声细胞破碎仪破碎并收集上清,按照试剂盒说明书,采用化学酶促-比色法通过酶标仪检测细胞内总胆固醇含量(total cholesterol,TC)和游离胆固醇(free cholesterol,FC)含量,并计算:胆固醇酯(cholesterol ester,CE)含量(mmol·L-1)=TC-FC。Lowry法测定总蛋白含量,计算胆固醇与细胞内总蛋白的比值,分析胆固醇相对含量。
1.7 统计学方法 结果用¯x±s表示。两样本均数间比较用Student’s t检验,多样本均数间比较用One-way ANOVA检验,组间的两两比较用Student-Newman-Keuls检验。
2 结果
2.1 THP-1单核源性泡沫细胞培养和鉴定 THP-1单核细胞经PMA刺激48 h后,细胞由悬浮变为贴壁状态,形状呈长梭形或不规则形并有伪足伸出,即单核细胞分化为巨噬细胞。再给予ox-LDL刺激48 h后,油红O染色见细胞体积增大,胞内充满大量红色脂滴,呈泡沫样改变,细胞核呈蓝色,即单核源性泡沫细胞形成,见Fig 1。
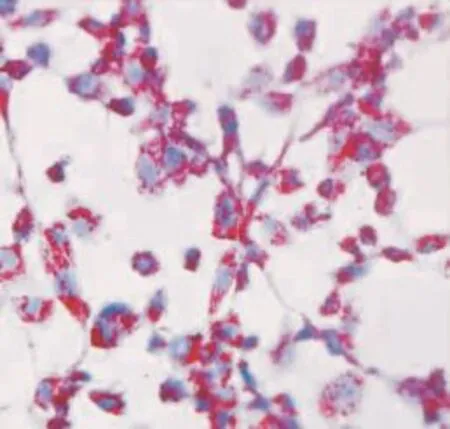
Fig 1 THP-1 monocyte-derived foam cells by oil red O staining(200×)
2.2 Hcy对THP-1单核源性泡沫细胞内ABCA1和ACAT1 DNA甲基化的影响及比值MABCA1/ACAT1改变 不同浓度Hcy刺激泡沫细胞后,分析各组细胞中ABCA1和ACAT1 DNA甲基化水平,并计算DNA甲基化比值MABCA1/ACAT1的变化。结果显示:与对照组比较,ABCA1 DNA甲基化程度在50、100、200、500μmol·L-1Hcy组分别增加了 38.28%、55.98%、47.12%、37.93%,给予100+F+V干预后,与100μmol·L-1Hcy组比较,ABCA1 DNA甲基化程度降低了28.34%;ACAT1 DNA甲基化程度以100μmol·L-1Hcy组低甲基化程度最明显,较对照组降低了8.32%,但变化不如ABCA1明显,给予100+F+V干预后,与100μmol·L-1Hcy组比较,ACAT1 DNA甲基化程度增加了14.95%;不同浓度Hcy诱导泡沫细胞形成过程中,与对照组比较,MABCA1/ACAT1分别增加了 31.37%、70.04%、43.29%、45.98%,而100+F+V组与100μmol·L-1Hcy组比较,MABCA1/ACAT1降低了 37.63%,见 Fig 2。
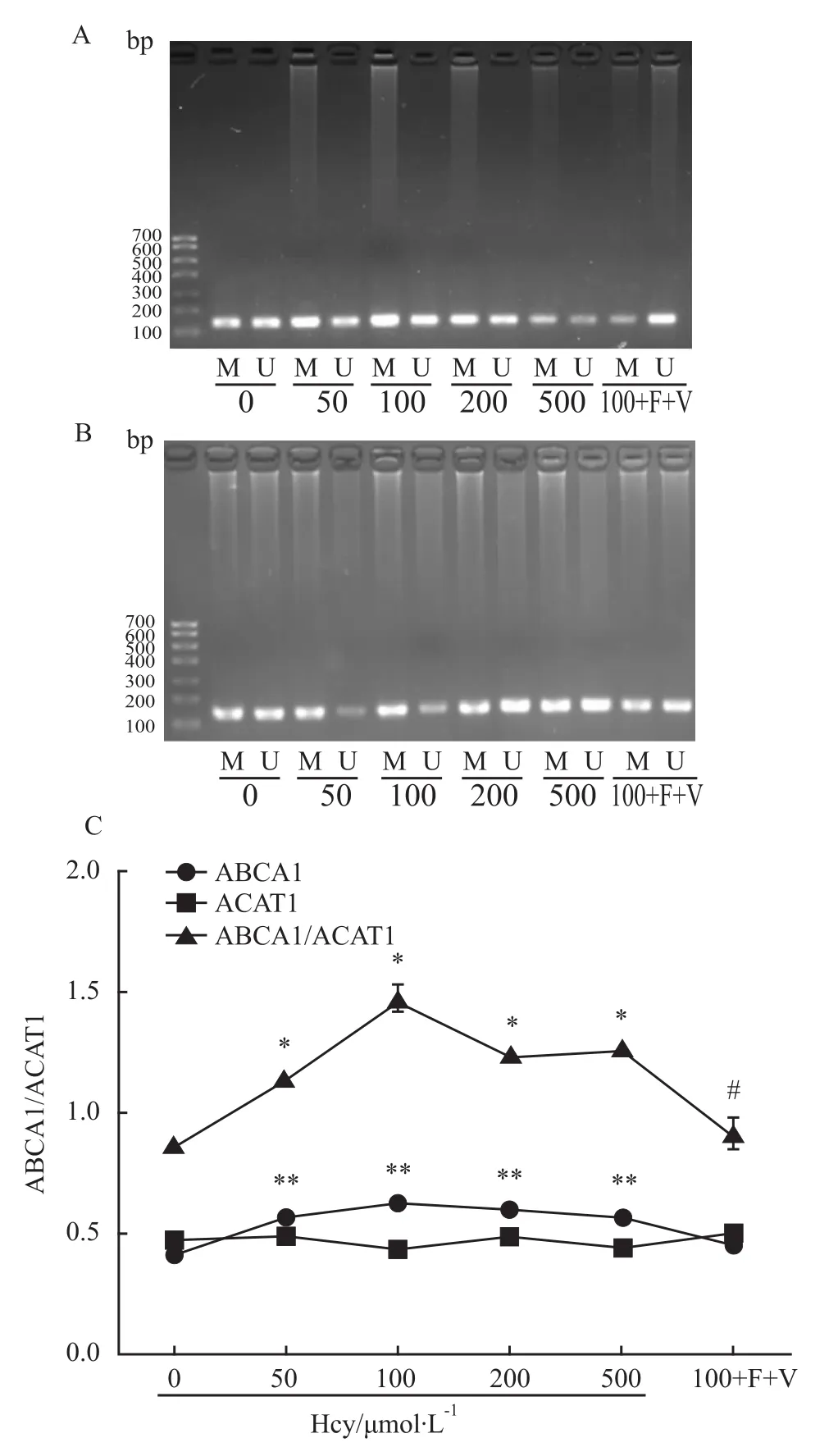
Fig 2 Changes of ABCA1 and ACAT1 DNA methylation levels
2.3 ELISA-like检测DNMTs的活性 不同浓度Hcy使THP-1单核源性泡沫细胞DNMTs活性增加,以50μmol·L-1Hcy组活性最高,与对照组比较,差异有显著性 (P<0.01);在 100μmol·L-1Hcy组,DNMTs活性与对照组比较也明显增加(P<0.05),见 Fig 3。
2.4 细胞内胆固醇含量分析 Hcy干预泡沫细胞后,胞内胆固醇明显增加,实验组与对照组比较,差异有显著性(P<0.05);胞内胆固醇含量与Hcy浓度不呈量效关系,以100μmol·L-1Hcy组胆固醇含量增加最明显(P<0.01),这说明Hcy减少了泡沫细胞内胆固醇流出,见Fig 4。
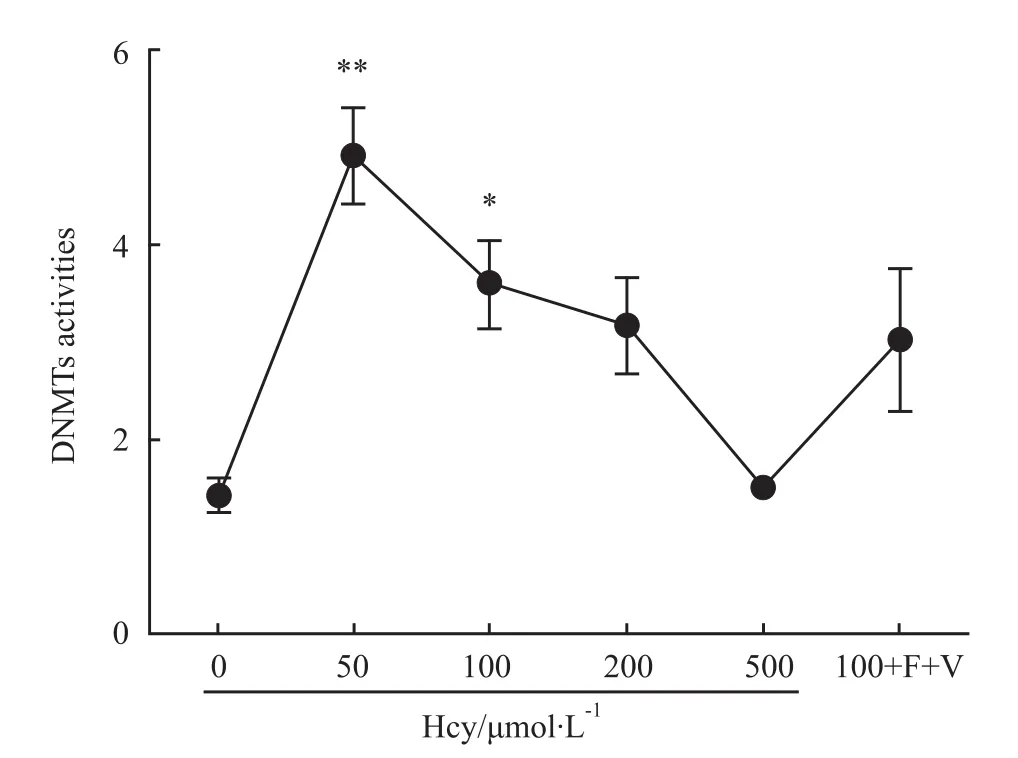
Fig 3 Hcy affects DNMTs activites of THP-1 monocyte-derived foam cells
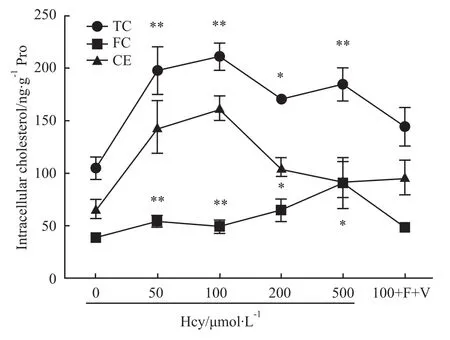
Fig 4 Levels of cholesterol in foam cells(¯x±s)
3 讨论
ABCA1可介导细胞内磷脂和游离胆固醇转运至载脂蛋白A-1,从而促进高密度脂蛋白生成,启动胆固醇逆向转运过程,在机体清除多余脂质的过程中发挥重要作用[7]。ACAT1是一种催化胆固醇和脂肪酰辅酶A合成胆固醇酯的酶,在巨噬细胞及血管平滑肌细胞中,胆固醇作为极性脂分子,易渗入膜脂质双分子层中,构成细胞膜,而剩余的胆固醇则在ACAT1的作用下生成胆固醇酯,由于胆固醇酯是高度非极性分子,主要以脂滴的形式储存于胞质中,细胞中过高浓度的胆固醇可形成结晶对细胞产生毒性作用,ACAT1的基本作用被认为是减少过高的游离胆固醇对细胞的毒性作用[8]。
Hcy是一种含硫氨基酸,其作为甲硫氨酸代谢的中间产物,参与了甲硫氨酸循环的关键环节[9]。实验结果表明,Hcy浓度升高引起DNMTs活性增加,这显然不可能是Hcy引起基因组广泛去甲基化的原因,而可能是细胞企图扭转基因组低甲基化的代偿反应。由于DNMTs的主要功能与维持甲基化状态有关,因此,它很可能是某些已经甲基化的CpG岛保持甲基化状态的关键因素,即DNMTs的上调很可能与Hcy在导致基因组DNA广泛去甲基化的同时引起某些基因启动子区的高甲基化有关,这可以造成某些特定基因的沉默[10]。本次研究结果显示,在Hcy干预下,THP-1单核源性泡沫细胞ABCA1基因启动子区DNA高甲基化也就是这个原因。这提示DNMTs活性的增加可能为对抗DNA去甲基化的一种代偿反应。
然而,泡沫细胞ACAT1启动子区DNA呈低甲基化改变,可能由于Hcy浓度增加,使S-腺苷同型半胱氨酸(S-adenosyl homocysteine,SAH)降解受阻,引起甲硫氨酸循环紊乱,关键酶功能失调所致,这又一次证实了Hcy引起基因组广泛去甲基化的结论。ABCA1基因高甲基化和ACAT1基因低甲基化,共同促进了泡沫细胞的形成,但ACAT1 DNA低甲基化程度不如ABCA1 DNA高甲基化程度明显,即DNA甲基化比值MABCA1/ACAT1增大,提示Hcy干预THP-1单核源性泡沫细胞后,胆固醇从细胞内流出明显减少,而细胞内胆固醇酯合成明显增多,引起泡沫细胞内脂滴聚集进一步增多。ABCA1和ACAT1启动子区DNA甲基化改变与Hcy并不呈剂量依赖关系,且在叶酸和VitB12干预下有逆转趋势,多次重复试验均提示这一效应并非偶然。综上所述,Hcy可能影响了甲硫氨酸循环中DNMTs活性,导致AS相关基因DNA甲基化改变,进而引起泡沫细胞形成过程中胆固醇代谢紊乱,此可能成为Hcy致AS的重要机制之一,这为我们进一步认识AS发病机制提供新的实验依据。
参考文献:
[1]Luque M C,Gutierrez P S,Debbas V,et al.Phage display identification of CD100 in human atherosclerotic plaque macrophages and foam cells[J].PLoSOne,2013,8(9):e75772.
[2]Ghorbanian B,Ravassi A,Kordi M R,Hedayati M.The effects of rope training on lymphocyte ABCA1 expression,plasma ApoA-I and HDL-c in boy adolescents[J].Int J Endocrinol Met,2013,11(2):76-81.
[3]Murphy S R,Chang C C,Dogbevia G,et al.Acat1 knockdown gene therapy decreases amyloid-βin a mouse model of Alzheime′s disease[J].Mol Ther,2013,21(8):1497-506.
[4]张 玲,盛树力,秦 川.表观遗传学药物的研究进展[J].中国药理学通报,2013,29(3):297-303.
[4]Zhang L,Sheng SL,Qin C.Research progress in the epigenetic drug[J].Chin Pharmacol Bull,2013,29(3):297-303.
[5]杨安宁,王 菊,杨晓玲,等.同型半胱氨酸引起平滑肌细胞LDLR启动子区甲基化改变的位点分析[J].中国药理学通报,2012,28(11):1507-10.
[5]Yang A N,Wang J,Yang X L,et al.Characteristics and function of homocysteine-induced LDLR promoter DNA methylation in vascular smooth muscle cells[J].Chin Pharmacol Bull,2012,28(11):1507-10.
[6]Jiang Y D,Zhang H P,Sun T,et al.The comprehensive effects of hyperlipidemia and hyperhomocysteinemia on pathogenesis of atherosclerosis and DNA hypomethylation in ApoE-/-mice[J].Acta Biochim Biophys Sin,2012,44(10):866-75.
[7]Zhao J F,Jim Leu SJ,Shyue SK,et al.Novel effect of paeonol on the formation of foam cells:promotion of LXRα-ABCA1-dependent cholesterol efflux in macrophages[J].Am J Chin Med,2013,41(5):1079-96.
[8]Xu J,Hu G,Lu M,et al.MiR-9 reduces human acyl-coenzyme A:cholesterol acyltransferase-1 to decrease THP-1 macrophage-derived foam cell formation[J].Acta Biochim Biophys Sin,2013,45(11):953-62.
[9]Krishna SM,Dear A,Craig JM,et al.The potential role of homocysteine mediated DNA methylation and associated epigenetic changes in abdominal aortic aneurysm formation[J].Atherosclerosis,2013,228(2):295-305.
[10]He M,Fan J,Jiang R,et al.Expression of DNMTs and genomic DNA methylation in gastric signet ring cell carcinoma[J].Mol Med Rep,2013,8(3):942-8.