大麻素受体在肝纤维化及肝硬化中的作用及研究进展
2014-05-19张自力段旭酉倪雯霞王妤清郑仕中
张自力,张 衍,张 涉,段旭酉,郭 瑶,倪雯霞,王妤清,郑仕中,3
(南京中医药大学1.药学院,2.中药学一级学科,江苏 南京 210023;3.江苏省中药药效与安全性评价重点实验室,江苏南京 210023)
肝纤维化(hepatic fibrosis,HF)是继发于各种慢性肝损伤之后组织修复过程中的代偿反应,其发病实质是肝内细胞外基质(extracellular matrix,ECM)合成大于降解,最终导致ECM过度沉积[1-2]。如无有效的治疗措施,随着病情的发展将导致肝脏纤维结节形成并破坏正常的肝脏结构与功能,最终发展成为肝硬化而出现肝脏功能的衰退,甚至演变为肝癌[3]。近年来大量文献显示大麻素受体在肝纤维化发生与发展中有着重要作用,研究证实在慢性肝病的发展过程中,肝脏的肌成纤维细胞和血管内皮细胞的大麻素受体蛋白表达升高,同时,内源性大麻素类物质特别是花生四烯酸乙醇胺(anandamina,AEA)在肝脏中的浓度也增高[4-5],许多学者由此认为大麻素受体是抗肝纤维化的潜在治疗靶点[6-7]。本文将就近几年来这方面的研究进展,论述大麻素受体在防治肝纤维化及肝硬化中的作用及研究进展。
1 大麻素系统概述
大麻在医药上已经应用了数千年,具有重要的药用价值。大麻的活性化合物是大麻素,1964年科学家首次阐释清楚了大麻素主要活性成分Δ9-四氢大麻酚(Δ9-THC)的化学结构[8]。在人体内也发现了与大麻素具有相似作用的化合物,称之为内源性大麻素,主要包括2-arachionoylglycerol、anandamide、noladinethe、virodhamine等[9]。内源性大麻素通过特异性大麻素受体发挥作用[10],近年来研究发现人体体内存在两种大麻素受体:CB1受体和CB2受体。
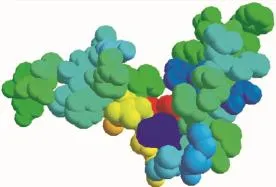
Fig 1 Structure of CB1
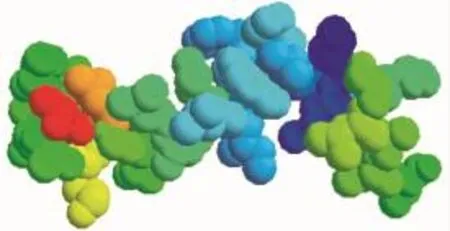
Fig 2 Structure of CB2
CB1、CB2受体都是G蛋白偶联受体,都是视紫红质样家族的7次跨膜受体,其配体结合部位是7个跨膜螺旋相互作用形成的中央核心[11]。CB1受体由473个氨基酸构成,CB2受体由360个氨基酸构成,基因克隆研究发现这两种受体有44%的氨基酸序列同源,相对分子质量大约为52 800左右[12]。人类大麻素受体与大鼠的大麻素受体氨基酸序列有97.3%同源,因此,成年大鼠可作为研究大麻素受体分布及功能的理想实验动物[12]。CB1受体主要位于脑、脊髓与外周神经系统中,脑内CB1受体主要分布于基底神经节(黑质、苍白球、外侧纹状体)、海马CA锥体细胞层、小脑和大脑皮层。CB1受体的这种分布可能与大麻素对记忆、认知、运动控制的调节有关。而CB2受体主要分布于外周,如脾脏边缘区、免疫细胞、扁桃体等,它的这种分布则可能与大麻素免疫抑制作用有关[13-14]。大麻素系统紊乱可导致神经系统、代谢、免疫系统、心血管系统、消化系统和癌症等疾病[15]。
2 大麻素受体与肝纤维化
肝纤维化是慢性肝病发展为肝硬化必经的病理过程。肝纤维化发生时肝星状细胞(hepatic stellate cells,HSCs)异常活化增殖,并合成与分泌大量的ECM。抑制HSCs增殖、促进其凋亡已成为当前抗肝纤维化治疗的主要策略[16-17]。通过对肝纤维化小鼠模型和肝纤维化患者的研究发现,大麻素受体通过复杂的信号通路调控肝星状细胞[18]。有实验在基因和药物水平上通过阻断CB1和CB2来研究内源性大麻素系统对肝纤维化的影响,结果发现大麻素受体有促进和抑制肝星状细胞的双重作用[19]。动物实验研究发现,四氯化碳(CCl4)或酒精诱导的肝纤维化动物模型中,给予CB2受体拮抗剂可以使肝纤维化的发生发展速度加快,纤维化程度明显加重,而激活CB2受体可以有效抑制肝纤维化的发生发展[20];对CB1受体研究发现,激活CB1受体可以促进肝纤维化发展,给予CB1受体拮抗剂(例如:SR141716A)可以减轻肝脏急性损伤时肝组织损伤修复反应,抑制肝纤维化的发展进程,给予CB1基因敲除小鼠四氯化碳或酒精诱导肝纤维化,CB1基因敲除小鼠肝脏纤维化发生发展较未CB1基因敲除小鼠的速度明显减慢,其纤维化程度也减轻[7]。有学者[21]通过体外实验研究大麻素受体对肝星状细胞的调控作用,结果发现体外激动或者拮抗HSCs大麻素受体,能够获得与上述体内实验相同的结果。由此可见,激活CB1受体能够起到促进肝纤维化的作用,而激活CB2受体则起到抗肝纤维化作用,但在应对能同时激活CB1和CB2受体的配体时,有学者[22]发现促进肝纤维化的CB1通路反应占主要地位。
2.1 大麻素受体拮抗剂与激动剂在肝纤维化中的作用 在体外实验研究中,有学者[21]应用MTT实验探讨CB1激动剂(NADA)与拮抗剂(AM251)、CB2激动剂(JWH015)与拮抗剂(AM630)对HSCs增殖的作用效果。结果表明,激动CB1可促进HSCs的增殖,相反拮抗CB1后则可以抑制HSCs的增殖。同时激动CB2也可抑制HSCs的增殖,但抑制CB2时对HSCs的增殖没有明显的影响。
在动物实验研究中,Javier等[23]把CB2选择性激动剂(JWH133)注入到肝硬化大鼠体内后发现,肝硬化大鼠肝脏组织的α-平滑肌蛋白和I型胶原减少,基质金属蛋白-2增加,肝纤维化程度也明显减轻;把 CB2选择性拮抗剂(AM630)注入到肝硬化大鼠体内后会得到相反的实验结果。Cudaback等[20]发现,CCl4或酒精诱导的肝纤维化动物模型中,给予CB1受体激动剂(NADA)可以促进肝纤维化发展,给予CB1受体拮抗剂(AM251)可以减轻肝组织损伤,抑制肝纤维化的发展进程,给予CB1基因敲除小鼠CCl4或酒精诱导肝纤维化,CB1基因敲除小鼠肝脏纤维化发生发展较正常组小鼠的速度明显减慢,其纤维化程度也较正常组的减轻。
根据体内外实验结果,Wasmuth等[24]总结了CB1受体拮抗剂防治肝纤维化的机制,他们认为CB1受体拮抗剂可以通过抑制HSCs的活化与肝内免疫调节达到治疗肝纤维化的目的,具体途径有3种,其一经活化TH1细胞促进IFN-γ分泌,其二提高血清脂联素水平进而降低胰岛素抵抗,其三促进活化HSCs的凋亡。
2.2 大麻素受体调控肝纤维化的信号通路 大麻素受体在肝纤维化的发生发展中具有重要的作用,但是其具体是通过调控哪些信号通路发挥治疗肝纤维化的作用?大麻素受体为G蛋白偶联受体,由此可以将CB1与CB2调控的信号通路分为依赖G蛋白的信号通路与不依赖G蛋白的信号通路两大类。前者主要包括:腺苷酸环化酶途径、MAP蛋白激酶途径、PI3激酶途径和FAK途径等。有研究者[21]应用CB1拮抗剂(AM251)作用于HSCs,观察其对 HSCs中 MAPK信号通路的影响。结果表明,CBR1拮抗剂能够明显抑制ERK与JNK的磷酸化,并呈剂量依赖性的关系,但对p38蛋白的表达没有什么影响,由此得出大麻素受体可能通过影响MAPK信号通路发挥抗肝纤维化作用。此外,还有学者[25]证实CB1受体可以偶联到Gs提高胞内cAMP的水平,也可以偶联到Gi介导ERK1/2和Ca2+信号的活化,从而调控肝纤维化发生与发展,然而与CB1相比,CB2只偶联到Gi并介导胞内腺苷酸环化酶的抑制信号。更有学者[26]发现随着肝纤维化程度的不断加重,小鼠肝组织中CB1 mRNA含量以及血清FAK mRNA水平也不断增高,两者呈显著正相关。肝纤维化发生时,CB1可能通过FAK介导的PI3K途径促进HSCs增殖,后者大量分泌 TGFβ1,TGFβ1通过 TGFβ/Smad途径促进HSCs激活,合成大量的ECM,进一步加剧肝纤维化的发生与发展。不依赖G蛋白的信号通路目前已经确认的包括:激活鞘磷酸脂酶和诱导一氧化氮和环氧合酶-2的合成。例如有学者[23]应用内源性大麻素或CB2特异性激动剂作用于HSCs时发现,其能剂量依赖性的抑制HSCs的增殖,然而再分别加入环氧合酶-2的抑制剂和抗氧化剂时能减弱上述效应,由此推测其机制可能是通过诱导COX-2的合成,进而抑制HSCs的增殖,通过启动细胞内的氧化应激进而促进其凋亡。除上述两种信号通路外,也有研究证实[27],大麻素受体可以调节钙离子和钾离子通路的开放,发挥防治肝纤维化的作用。
3 大麻素及其受体在肝硬化并发症中的作用
肝硬化患者的肝脏结构发生改变,导致肝脏解毒功能下降,从而使循环血液中内毒素增加,导致肝硬化失代偿期出现门脉高压、内毒血症、高动力循环综合征、肝性脑病等并发症。有学者研究发现[28],肝硬化各并发症过程中内源性大麻素含量异常增加,以内源性大麻素系统作为治疗肝纤维化的药物靶点,有望改善肝硬化并发症。
肝硬化门脉高压症患者,尤其是在失代偿期,常有门静脉内径增宽,食管胃底静脉曲张,血清白蛋白降低,腹腔积液等临床表现。近年来许多动物实验和一些临床试验均发现大麻素及其受体与肝硬化门静脉高压症有关。有研究者[28]发现持续地使用大麻素作用于人体,可以阻断肝纤维化的进展并且有利于肝硬化患者肝脏紊乱结构的恢复,也有实验[28]证实内源性大麻素系统可以通过影响血液循环动力作用而改善门静脉高压。另有研究者发现[29],将一种内源性大麻素的替代物质(具有与内源性大麻素相同的生理学作用,但其生物学活性较内源性大麻素更持久稳定)注入动物体内后观察到外周血管舒张、机体低血压、门静脉血流量增加等一系列血流动力学变化,由此证实这些改变由内源性大麻素作用产生,而不是其降解的产物所导致。
肝硬化患者随着肝功能的减退和门静脉高压的不断进展,最终将引起内毒血症的进展。在健康人群中,即使内毒素有可能经门静脉进入肝脏,也会被肝脏的单核巨噬细胞系统清除,而不会进入血液循环,也不会造成循环内毒素血症。但是肝硬化患者肝脏结构发生改变,导致肝脏解毒功能下降,从而使循环血液中内毒素增加。有研究表明[30],在内毒素作用下,巨噬细胞、血小板等中的内源性大麻素生成增加,其作用于CB1受体导致低血压、休克等症状。进一步的研究发现[31],胆汁淤积性肝硬化大鼠给予CB1受体拮抗剂(SR141716A)后低血压状况可以得到改善。
肝性脑病是严重的肝功能失调或障碍引起的、以代谢紊乱为基础的中枢神经系统失调的综合征。其主要临床表现包括神经和精神方面的异常,如意识障碍、行为失常和昏迷。肝性脑病是肝硬化常见并发症和死亡原因。有研究发现[32]激活CB2可以减轻急性肝损伤小鼠的神经评分和提高其认知功能,阻断CB1可以产生相似的作用。
综合这些研究表明,肝硬化时机体内毒素增加,刺激巨噬细胞、血小板等产生内源性大麻素,内源性大麻素作用于血管内皮相应的受体,激活受体使得全身血液循环以及肠系膜血液循环压力降低,有效循环血容量减少,门静脉血流量和压力增加,机体体液潴留使腹水加重,进一步导致肾功能不全。
4 展望
综上所述,虽然越来越多的证据表明大麻素受体在肝纤维化及肝硬化的发生发展中具有重要作用,但是人们对于其作用机制的了解还需要相当长的时间。关于大麻素受体在临床上治疗肝纤维化的数据有限,而且目前的研究结果均来源于动物和体外培养的细胞,药物方面又主要集中在CB1拮抗剂和CB2激动剂,所以对于大麻素受体的研究还有很长的路要走。总之,大麻素受体为肝纤维化及肝硬化的治疗带来了新的希望。
参考文献:
[1]Friedman SL.Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655-69.
[2]Friedman S L.Evolving challenges in hepatic fibrosis[J].Nat Rev Gastroenterol Hepatol,2010,7(2):425-36.
[3]Lim Y S,Kim WR.The global impact of hepatic fibrosis and endstage liver disease[J].Clin Liver Dis,2008,12(1):733-46.
[4]Biswas K K,Sarker K P,Abeyama K,et al.Membrane cholesterol but not putative receptors mediates anandamide-induced hepatocyte apoptosis[J].Hepatol,2003,38(3):1167-77.
[5]Siegmund S V,Uchinami H,Osawa Y,et al.Anandamide induces necrosis in primary hepatic stellate cells[J].Hepatol,2005,41(5):1085-95.
[6]Julien B,Grenard P,Teixeira-Clerc F,et al.Antifibrogenic role of the cannabinoid receptor CB2 in the liver[J].Gastroenterol,2005,12(8):742-55.
[7]Teixeira-Clerc F,Julien B,Grenard P,et al.CB1 cannabinoid receptor antagonism:a new strategy for the treatment of liver fibrosis[J].Nat Med,2006,12(6):671-6.
[8]Mechoulam R,Gaoni Y.A total synthesis of DL-delta-1-tetrahydrocannabinol,the active constituent of hashish[J].Am Chem Soc,1965,87(4):3273-5.
[9]Pacher P,Bátkai S,Kunos G.The endocannabinoid system as an emerging target of pharmacotherapy[J].Pharmacol Rev,2006,58(2):389-462.
[10]Devan W A,Hanus L,Breuer A,et al.Isolation and structure of a brain constituent that bind to the cannabinoid receptor[J].Science,1992,258(5090):B1946-9.
[11]Di Marzo V,Bifulco M,De Petrocelis L.The endocanna binoid system and its therapeutic exploitayion[J].Nat Rev,2004,3(9):3771-84.
[12]彭忠田,欧阳兵,王 培,等.大麻素受体与肝病[J].中国医药指南,2013,11(13):465-6.
[12]Peng Z T,Ouyang B,Wang P,et al.Cannabinoid receptors and liver disease[J].Chin Med Guide,2013,11(13):465-6.
[13]Galiègue S,Mary S,Marchand J,et al.Expression of central and peripheralcannabinoid receptors in human immune tissuesand leukocyte subpopulations[J].Eur J Biochem,1995,232(2):54-61.
[14]Ashton JC,Friberg D,Darlington CL,Smith PF.Expression of the cannabinoid CB2 receptor in the rat cerebellum:an immunohistochemical study[J].Neurosci Lett,2006,396(3):113-6.
[15]Sugiura T,Kishimoto S,Oka S,et al.Biochemistry,pharmacology and physiology of 2-arachidon-oylglycerol,an endogenous cannabinoid receptorligand[J].Prog Lipid Res,2006,45(1):405-46.
[16]Anthony B,Allen J T,Li Y S,McManus D P.Hepatic stellate cells and parasite-induced liver fibrosis[J].Parasi Vectors,2010,3(1):60.
[17]张 怡,平 洁,汪 晖.肝星状细胞凋亡信号途径及其药物治疗的研究进展[J].中国药理学通报,2009,25(1):16-8.
[17]Zhang Y,Ping J,Wang H.The research progress of hepatic stellate cell’s apoptosis signaling pathway and the relative drugs[J].Chin Pharmacol Bull,2009,25(1):16-8.
[18]Rockey D C.Hepatic fibrosis,stellate cells,and portal hypertension[J].Clin Liver Dis,2006,10(2):459-79.
[19]Siegmund SV,Qian T,de Minicis S,et al.The endocannabinoid 2-arachidonoyl glycerol induces death of hepatic stellate cells via mitochondrial reactive oxygen species[J].FASEB,2007,21(1):2798-806.
[20]Cudaback E,Marrs W,Moeller T,et al.The expression level of CB1 and CB2 receptors determines their efficacy at inducing apoptosis in astrocytomas[J].PLoSOne,2010,5(1):e8702.
[21]张自力,张 涉,郭 瑶,等.大麻素受体在肝星状细胞活化中的作用及姜黄素干预效应[J].中国药理学通报,2013,29(5):626-31.
[21]Zhang ZL,Zhang S,Guo Y,et al.Research on the role of cannabinoid receptors in hepatic stellate cell activation and interfering effects of curcumin[J].Chin Pharmacol Bull,2013,29(5):626-31.
[22]Siegmund S V,Schwabe R F.Endocannabinoids and Liver Disease.II.Endocannabinoids in the pathogenesis and treatment of liver brosis[J].Am J Physiol Gastrointest Liver Physiol,2008,294(2):G357-62.
[23]Javier M L,Josefa R,Fernandez V,et al.Regression of fibrosis after chronic stimulation of cannabinoid CB2 receptor in cirrhotic rats[J].Pharmacol Exp Ther,2008,324(2):478-83.
[24]Wasmuth H E,Trartwein C.CB1 cannabinoid receptor antagonism:A new strategy for the treatmen t of liver fibrosis[J].Hepatol,2007,45(2):543-5.
[25]Christie M J,Vaughan C W.Cannabinoids act backwards[J].Nature,2001,410(6828):527-30.
[26]杨 莉,赵召霞,侯军良,等.大麻素受体1、FAK、mRNA在小鼠肝纤维化形成过程中肝组织中的表达及相互关系[J].临床肝胆病杂志,2011,27(8):824-7.
[26]Yang L,Zhao Z X,Hou JL,et al.Hepatic expression of CB1 in rats with fibrosis and the relationship with FAK[J].J Clin Hepatol,2011,27(8):824-7.
[27]顾佩菲,吴春福.内源性大麻素样物质的可能作用机制[J].中国药理学通报,2003,19(11):1223-6.
[27]Gu PF,Wu CF.Possible mechanisms of endocannabinoids[J].Chin Pharmacol Bull,2011,27(8):824-7.
[28]张 建,戴二黑,姜慧卿.内源性大麻素系统对肝硬化的影响[J].世界华人消化杂志,2012,20(13):1112-7.
[28]Zhang J,Dai E H,Jiang H Q.Role of the endocannabinoid system in the pathogenesis of cirrhosis[J].World Chin J Digestol,2012,20(13):1112-7.
[29]Garcia N J,Jarai Z,Mirshahi F,et al.Systemic and portal hemodynamic effects of anandamide[J].Am J Physiol Gastrointest Liver Physiol,2001,280(1):G14-20.
[30]Varga K,Wagner JA,Bridgen D T,Kunos G.Platelet and macrophage derived endognous cannabinoids are involved in endotoxininduced hypotension[J].FASEB J,1998,12(1):1035-44.
[31]Batkai S,Jarai Z,Wagner JA,et al.Endocannabinoids acting at vascular CB1 receptors mediate the vasodilated state in advanced liver cirrhosis[J].Nat Med,2001,7(1):827-32.
[32]Avraham Y,Israeli E,Gabbay E,et al.Endocannabinoids affect neurological and cognitive function in thioacetamide-induced hepatic encephalopathy in mice[J].Neurobiol Dis,2006,21(2):237-45.