盐酸头孢卡品酯片在中国健康受试者体内的药动学*
2014-05-13周文佳张全英黄明华雯妍王蒙宗顺麟俞蕴莉
周文佳,张全英,黄明,华雯妍,王蒙,宗顺麟,俞蕴莉
(苏州大学附属第二医院临床药理实验室,苏州 215004)
盐酸头孢卡品酯片在中国健康受试者体内的药动学*
周文佳,张全英,黄明,华雯妍,王蒙,宗顺麟,俞蕴莉
(苏州大学附属第二医院临床药理实验室,苏州 215004)
目的 研究中国健康受试者单/多次口服盐酸头孢卡品酯片的药动学。方法将30例受试者随机分为3组,每组10例,男女各半,一组进行盐酸头孢卡品酯片低剂量(100 mg)的单/多次给药人体药动学试验,受试者每天服药3次,每次100 mg,一共服药12次;一组进行盐酸头孢卡品酯片中剂量(200 mg)的单次给药人体药动学试验;一组进行盐酸头孢卡品酯片高剂量(300 mg)的单次给药人体药动学试验。采用高效液相色谱-串联质谱(HPLC-MS/MS)法测定活性代谢产物头孢卡品的血浓度,采用DAS 2.0版软件计算其主要药动学参数,采用SPSS 17.0版软件对主要参数进行统计分析。结果单次空腹口服盐酸头孢卡品酯片100,200和300 mg后主要药动学参数:tmax分别为(1.42±0.54), (1.80±0.59)和(2.10±0.81)h;t1/2分别为(1.45±0.17),(1.60±0.22)和(1.44±0.18)h;MRT0-12h分别为(2.75±0.42), (2.99±0.33)和(3.31±0.57)h;Cmax分别为(1 419±384),(2 128±366)和(2 438±655)μg·L-1;AUC0-12h分别为(4 369± 1 078),(7 477±1 616)和(9 091±3 735)μg·h·L-1;AUC0-∞分别为(4 389±1 080),(7 528±1 640)和(9 146±3 749) μg·h·L-1;V/F分别为(52.13±21.81),(63.60±14.78)和(76.06±23.29)L;CL/F分别为(24.27±7.06),(27.61± 5.42)和(36.49±10.31)L·h-1。多次口服盐酸头孢卡品酯片100 mg后主要药动学参数:tmax为(1.90±0.70)h;t1/2为(1.63±0.16)h;MRT0-12h为(2.87±0.52)h;Cssmax为(1 133±200)μg·L-1;AUCss为(3 607±730)μg·h·L-1;AUC0-12h为(3 731±775)μg·h·L-1;AUC0-∞为(3 757±785)μg·h·L-1;V/F为(66.15±20.29)L;CL/F为(27.85±6.66)L·h-1,Cssmin为(105.4±57.17)μg·L-1;Cav为(450.9±91.2)μg·L-1;DF为(2.33±0.47);观察蓄积比Ro为(0.870±0.131)。结论盐酸头孢卡品酯片在剂量为100~300 mg范围内呈线性药动学特征,口服盐酸头孢卡品酯片,每日3次,每次100 mg,未发现蓄积现象。
头孢卡品酯,盐酸;头孢卡品;药动学;LC-MS/MS
头孢卡品酯是1985年由日本盐野义制药研究所开发的口服头孢菌素类抗菌药物。临床研究显示,头孢卡品酯片治疗呼吸系统、泌尿系统急性细菌感染抗菌活性强,细菌清除率高[1]。盐酸头孢卡品酯水合物吸收时通过肠壁酯酶水解生成抗菌活性体头孢卡品,头孢卡品通过阻断细菌细胞壁合成而发挥抗菌作用,头孢卡品与金黄色葡萄球菌的杀菌靶点青霉素结合蛋白(penicillin-binding protein,PBP)1,2,3有高亲和力,与大肠埃希菌及普通变形杆菌细胞壁合成的必要酶PBP3也有高亲和力[2]。体外抗菌研究显示,头孢卡品对我国近3年临床分离的致病菌仍保持较好的抗菌作用,特别是对流感嗜血杆菌和链球菌属。与临床常用品种比较,头孢卡品对革兰阳性菌和革兰阴性菌作用比较均衡,与头孢妥仑抗菌活性相似,针对革兰阳性菌,优于头孢泊肟和头孢克肟,针对革兰阴性菌,优于头孢泊肟[3]。目前,盐酸头孢卡品酯片仅在50~200 mg范围内的药动学参数有报道[4],笔者在本试验中首次报道了中国健康受试者空腹口服盐酸头孢卡品酯片100,200和300 mg后的药动学参数,为临床合理用药提拱参考。
1 材料与方法
本临床试验已获得国家食品药品监督管理总局的临床批准及苏州大学附属第二医院伦理委员会批准,严格遵守《赫尔辛基宣言》(the Declaration of Helsinki)的《人体医学研究的伦理准则》及国家食品药品监督管理总局颁布《药物临床试验规范》(Good Clinical Practice,GCP),研究人员向受试者说明了试验药物的性质、试验目的及方法、参加试验的获益及风险和自愿参加的原则,并获得了受试者的书面知情同意书。
1.1 受试者选择 健康受试者30例,男女各15例,均不吸烟、不嗜酒,无心脏、呼吸、内分泌、新陈代谢、肾脏、肝脏、胃肠道、皮肤、感染、恶性肿瘤、血液、神经系统疾病或精神病/机能紊乱等病史,一般体检、生化,血、尿常规及12导联心电图无有临床意义的异常,哺乳期或妊娠期妇女、育龄期妇女采用恰当的避孕措施,无药物、食物等过敏史,无直立性低血压史,入选前3个月内无献血史,入选前3个月内未参加过其他临床试验,试验前2周内未服用任何其他药物。30例健康受试者中男女各15例,平均(24±2)岁(20~30岁),身高(1.68±0.08)m(1.52~1.81 m),体质量(59.8± 8.0)kg(50.0~76.0 kg),体质量指数19~24。
1.2 试验设计 采用单周期、开放、平行设计方法进行盐酸头孢卡品酯片单/多次给药人体药动学试验。30例受试者随机分为3组,每组10例(男女各半),一组进行盐酸头孢卡品酯片低剂量(100 mg)单/多次给药人体药动学试验,一组进行中剂量(200 mg)单次给药人体药动学试验,一组进行高剂量(300 mg)单次给药人体药动学试验。根据预试验结果,头孢卡品血浆半衰期(t1/2)为1.5 h,tmax为1.0 h,根据《化学药物临床药动学研究技术指导原则》,设计采血时间点为给药前和给药后20,40 min,1,1.5,2,2.5,3,4,5,6,8,10和12 h,共14个点。
1.2.1 单次给药药动学 低、中、高剂量3组受试者于试验前禁食过夜10 h,于次日6∶30分别空腹口服盐酸头孢卡品酯片100,200和300 mg,温开水250 mL送服,给药后2 h内禁水,4 h内禁食。按采血时间点由前臂静脉采血3 mL,置肝素化离心试管中,立即离心(4℃,4 000 r·min-1,5 min),分离血浆,于-70℃冷冻保存待测。
1.2.2 多次给药药动学 低剂量组受试者在单次给药药动学试验采血结束后进行多次给药药动学试验。即试验第1天晚(22∶30)、试验第2~4天早(6∶30)、中(14∶30)、晚(22∶30)和试验第5天早(6∶30)分别空腹口服盐酸头孢卡品酯片100 mg,250 mL温开水送服。一共给药12次。在第3,4,5天早晨(6∶30)给药前由前臂静脉采血3 mL测定谷浓度,第5天给药后按单次给药药动学试验方法采集血样,血样处理方法同上。
1.3 样本的测定
1.3.1 试剂和仪器 盐酸头孢卡品酯片[石药集团中奇制药技术(石家庄)有限公司,批号:20100801,规格:每片100 mg];头孢卡品标准品[石药集团中奇制药技术(石家庄)有限公司,批号:20100928-4,含量: 99.52%];头孢拉定标准品[内标,中国食品药品检定研究院,批号:130427-200306,含量:91.8%);甲醇(美国Tedia公司,色谱纯),水为纯净水,醋酸铵(南京化学试剂有限公司,分析纯)。LC-MS/MS系统包括API-4000型三重四极杆串联质谱仪(美国Applied Biosys-tem Sciex公司);Agilent 1200高效液相色谱仪(美国Agilent公司);数据处理系统为Analyst 1.4.2(美国Applied Biosystem Sciex公司)。XS 105DU型分析天平(瑞士METTLER TOLEDO公司)。
1.3.2 测定方法 受试者血样采用已验证的LC-MS/MS方法进行测定[2]。血浆样品经甲醇沉淀蛋白法处理,以头孢拉定作为内标,用C18柱(Waters公司,Symmetry C18,3.9 mm×150 mm,5 μm)进行分离,以甲醇-2.5 mmol·L-1醋酸铵缓冲液(32∶68)为流动相,选用电喷雾(electrospray ionization,ESI)离子源,在负离子电离模式下,采用多反应监测(multiple reaction monitoring,MRM)的质谱扫描方式,头孢卡品的检测离子为:m/z452.1→409.1,内标头孢拉定的检测离子为m/z348.1→270.0。在选定的条件下,头孢卡品和内标头孢拉定的保留时间为2.35和3.82 min,内源性物质对测定无干扰;头孢卡品的线性范围为:3.600~3 600 μg·L-1,r=0.9998;最低定量限为3.600 μg·L-1;低、中、高浓度质控样本(10.00,300.0, 3 000 μg·L-1)批内RSD分别为4.3%,1.1%和0.8%,批间RSD分别为1.8%,2.1%和1.2%;血浆基质效应分别为92.0%,92.5%和94.2%;平均提取回收率分别为102.5%,98.3%和97.0%;内标头孢拉定的基质效应为97.2%,提取回收率为99.7%;稳定性试验考察结果显示低、中、高浓度血浆质控样本在室温下放置4 h、-70℃反复冻融3次、-70℃冻存17 d后仍稳定,处理后的待测样本在自动进样器8℃中放置26 h后仍稳定;储备液于-40℃冰箱中储存21 d后仍稳定[2]。试验结果显示测定方法符合要求。
1.4 药动学参数计算方法 采用DAS 2.0版软件计算药动学参数,tmax和Cmax均用实测值,AUC0-t和AUC0-∞以梯形面积法求;t1/2=0.693/Kel,AUC0-t=Σ(Ci+Ci-1)(ti+ti-1)/2,AUC0-∞=AUC0-t+Ct/Kel,AUMC0-t=Σ (Citi+Ci-1ti-1)(ti+ti-1)/2,MRT0-t=AUMC0-t/AUC0-t,CL/F=D/AUC0-∞。式中Kel为末端相消除速率常数,由末端相的ln(浓度)与时间的线性回归求得,Ct为服药后12 h的血药浓度。稳态谷浓度(Cssmin)和稳态峰浓度(Cssmax)为实测值,稳态曲线下面积AUCss=Σ(Ci+Ci-1) (ti+ti-1)/2,波动度DF=(Cssmax-Cssmin)/Cav,平均稳态血药浓度Cav=AUCss/τ,τ为给药时间间隔8 h,观察蓄积比R0=AUC0-t(多次)/AUC0-t(单次)。
1.5 数据处理与统计方法 采用SPSS 17.0版统计软件进行药动学参数分析,对各剂量组主要药动学参数性别间差异采用独立样本的t检验,对tmax进行Mann-Whitney非参数检验。对各剂量组间的t1/2采用Kruskal-Wallis非参数检验,分别对lnCmax-lndose、lnAUC0-t-lndose和ln AUC0-∞-lndose进行相关分析。对受试者多次口服盐酸头孢卡品酯片100 mg后的tmax和t1/2进行Wilcoxon非参数检验。P<0.05表示差异有统计学意义。
2 结果
2.1 不良事件 低、中、高剂量单次给药药动学试验和低剂量多次给药药动学试验过程中均未发生不良事件。试验完成后,对受试者进行出组体检,体检结果均无有临床意义的异常。
2.2 主要药动学参数 30例受试者单次空腹口服不同剂量盐酸头孢卡品酯片后的主要药动学参数见表1, 10例受试者多次口服盐酸头孢卡品酯片100 mg后的主要药动学参数如下:AUCss(τ=8 h)为(3 607±730) μg·h·L-1,AUC0-12h为(3 731±775)μg·h·L-1, AUC0-∞为(3 757±785)μg·h·L-1,tmax为(1.90± 0.70)h,t1/2为(1.63±0.16)h,MRT0-t为(2.87± 0.52)h,Cssmin为(105.4±57.17)μg·L-1,Cssmax为(1 133±200)μg·L-1,Cav为(450.9±91.2)μg·L-1,CL/F为(27.85±6.66)L·h-1,V/F为(66.15±20.29)L,Ro为(0.87±0.13),DF为(2.33±0.47)。
2.3 受试者平均血药浓度-时间曲线 30例受试者单次空腹口服盐酸头孢卡品酯片100,200和300 mg后的平均血药浓度-时间对比曲线见图1。低剂量组10例受试者单、多次空腹口服盐酸头孢卡品酯片后的平均血药浓度-时间对比曲线见图2。
表1 受试者单次空腹口服盐酸头孢卡品酯片100,200和300 mg后的药动学参数Tab.1 Pharmacokinetic parameters of cefcapene pivoxil hydrochloride tablets after a single oral dose of 100,200 mg and 300 mg in 30 fasting volunteers ±s,n=10

表1 受试者单次空腹口服盐酸头孢卡品酯片100,200和300 mg后的药动学参数Tab.1 Pharmacokinetic parameters of cefcapene pivoxil hydrochloride tablets after a single oral dose of 100,200 mg and 300 mg in 30 fasting volunteers ±s,n=10
组别tmax/h Cmax/μg·L-1AUC0-12hAUC0-∞(μg·h·L-1) V/F/L t1/2MRT0-12 h h CL/F/(L·h-1) 100 mg组1.42±0.541 419±3844 369±1 0784 389±1 08052.13±21.811.45±0.172.75±0.4224.27±7.06 200 mg组1.80±0.592 128±3667 477±1 6167 528±1 64063.60±14.781.60±0.222.99±0.3327.61±5.42 300 mg组2.10±0.812 438±6559 091±3 7359 146±3 74976.06±23.291.44±0.183.31±0.5736.49±10.31
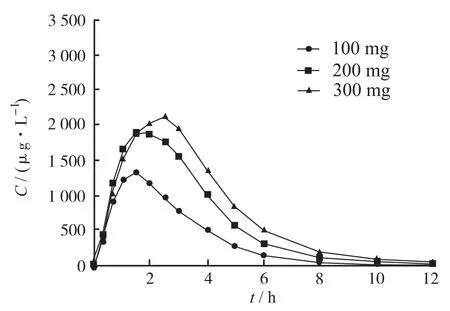
图1 30例受试者单次空腹口服100,200和300 mg盐酸头孢卡品酯片后的平均血药浓度-时间对比曲线Fig.1 Mean plasma concentration-time curves after a single oral dose of 100,200 mg and 300 mg cefcapene pivoxil hydrochloride tablets in 30 fasting volunteers
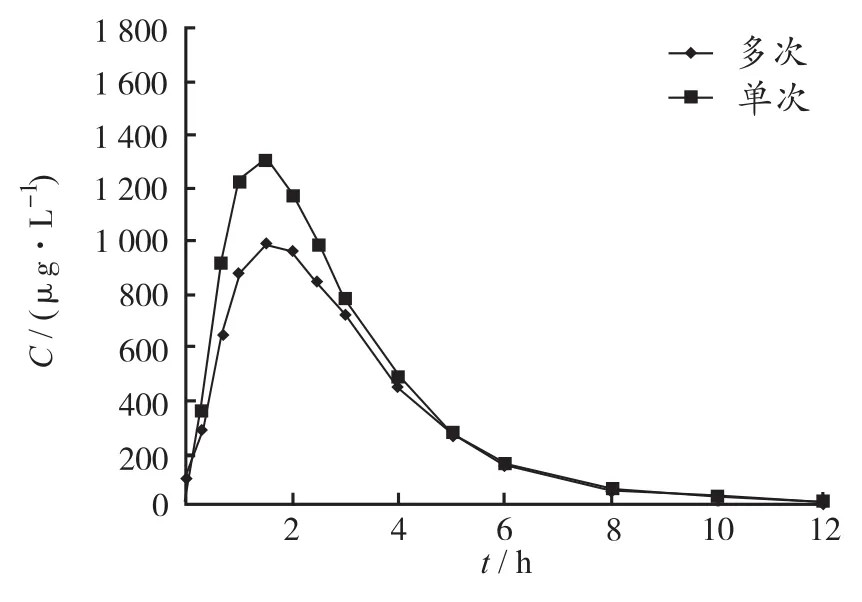
图2 10例受试者多次口服100 mg盐酸头孢卡品酯片后的平均血药浓度-时间对比曲线Fig.2 Comparison of mean plasma concentration-time curve after single or multiple oral dose of 100 mg cefcapene pivoxil hydrochloride tablets in 10 fasting volunteers
3 讨论
3.1 给药方案确定依据 为了考察该药在人体内药动学的线性特征,单次给药试验中选择100,200和300 mg进行试验。其中100 mg为盐酸头孢卡品酯片的最小剂量单位,根据该药的说明书,成人服用盐酸头孢卡品酯片每次100 mg,每日3次,因此本试验采用日剂量300 mg作为最大单次给药剂量进行考察。多次给药试验服药方案参考临床用药的常规服药剂量和疗程制定。
3.2 药动学特征
3.2.1 主要药动学参数的性别差异 采用SPSS17.0版统计软件对受试者单次空腹口服100,200和300 mg盐酸头孢卡品酯片以及多次口服100 mg盐酸头孢卡品酯片后的药动学参数进行性别间差异的独立样本t检验,对tmax进行Mann-Whitney非参数检验。结果显示仅当受试者单次空腹口服盐酸头孢卡品酯片300 mg后,tmax、t1/2和MRT0-t性别间差异有统计学意义(P<0.5),其他单次给药组的药动学参数性别间差异无统计学意义。说明当剂量较高时,不同性别受试者对盐酸头孢卡品酯片的吸收和代谢速度不同,但不影响吸收程度。多次给药组的药动学参数性别间差异无统计学意义。
3.2.2 主要药动学参数与剂量相关性 用SPSS 17.0版统计软件分别对受试者单次空腹口服盐酸头孢卡品酯片100,200和300 mg后的lnCmax-lndose、lnAUC0-12hlndose和ln AUC0-∞-lndose进行相关分析,结果显示lnCmax-lndose、lnAUC0-12h-lndose和lnAUC0-∞-lndose的Pearson相关系数r分别为0.702 1(P<0.01),0.742 7 (P<0.01),0.743 6(P<0.01),说明Cmax、AUC0-12h、AUC0-∞与剂量存在线性相关关系,且相关程度较强。对t1/2进行Kruskal-Wallis非参数检验,结果显示3个剂量组间t1/2差异无统计学意义,说明在剂量为100~300 mg范围内,盐酸头孢卡品酯片在人体内的药动学行为呈线性药动学特征。
3.2.3 单/多次给药对药动学参数的影响 用SPSS 17.0版统计软件分别对受试者多次口服盐酸头孢卡品酯片100 mg后的时间参数tmax和t1/2进行Wilcoxon非参数检验,结果显示多次服药达稳态的tmax与单次服药后的tmax差异无统计学意义,但t1/2差异有统计学意义(P<0.5),说明连续给药后头孢卡品的吸收速度没有改变,而代谢速度发生了改变。稳态情况下的蓄积比(R0)= 0.87±0.13,波动度(DF)=2.33±0.47,可见受试者空腹口服100 mg盐酸头孢卡品酯片,1日3次,每次100 mg,连续服药12次,达稳态情况下Cmax、AUC0-12h、AUC0-∞不存在蓄积现象,且吸收有降低趋势,但波动度较大。
本试验结果表明,盐酸头孢卡品酯片后在中国健康受试者中一般耐受性良好,不良反应发生率低,在剂量为100~300 mg范围内,盐酸头孢卡品酯片在人体内的药动学行为呈线性药动学特征。口服盐酸头孢卡品酯片1日3次,每次100 mg,不存在蓄积现象。
[1] 王慧玲,霍丽,王镇山,等.盐酸头孢卡品匹酯片治疗急性细菌性感染多中心双盲随即对照临床研究[J].中国临床药理学杂志,2012,28(1):3-5.
[2] 王蒙,周文佳,黄明,等.液相色谱-质谱串联法测定人血浆头孢卡品浓度[J].医药导报,2012,31(11):1423-1425.
[3] 李耘,吕媛,刘健,等.头孢卡品体外抗菌作用研究[J].中国抗生素杂志,2013,38(2):135-145.
[4] HONGFEI D,LI D,XIAOBING L,et al.Determination of cefcapene acid by LC-MS and their application to pharmacoki-netic study in healthy Chinese volunteers[J].J Pharm Anal, 2013,3(2):84-92.
DOI 10.3870/yydb.2014.03.007
Pharmacokinetics of Cefcapene Pivoxil Hydrochloride Tablets in Healthy Chinese Volunteers
ZHOU Wen-jia,ZHANG Quan-ying,HUANG Ming,HUA Wen-yan,WANG Meng,ZONG Shun-lin,YU Yun-li
(Laboratory of Clinical Pharmacology,the Second Affiliated Hospital of Soochow University,Suzhou 215004,
China)
Objective To assess the pharmacokinetics of single and multiple-dose of cefcapene pivoxil hydrochloride tablets in healthy Chinese subjects.MethodsThirty healthy subjects were divided into three groups(each group consisting of 5 males and 5 females)by arandomized blind design.Two groups were administered with 200 mg and 300 mg cefcapene pivoxil hydrochloride tablets,respectively for a single dose test of pharmacokinetics profile.The third group was enrolled for a multipledose study,in which patients received cefcapene pivoxil hydrochloride tablets at 100 mg three times daily for 4 days.Pharmacokinetics profile was assessed by determining concentrations of cefcapene acid with a validated HPLC-MS/MS method.The pharmacokinetic parameters were calculated by DAS 2.0 and analyzed by SPSS 17.0.ResultsAfter a single dose of oral administration,the main pharmacokinetic parameters for cefcapene acid at doses of 100,200 and 300 mg were as follow:tmaxas(1.42± 0.54),(1.80±0.59)and(2.10±0.81)h;t1/2 as(1.45±0.17),(1.60±0.22)and(1.44±0.18)h;MRT0-12has(2.75± 0.42),(2.99±0.33)and(3.31±0.57)h;Cmaxas(1 419±384),(2 128±366)and(2 438±655)μg·L-1;AUC0-12has (4 369±1 078),(7 477±1 616)and(9 091±3 735)μg·h·L-1;AUC0-∞as(4 389±1 080),(7 528±1 640)and(9 146± 3 749)μg·h·L-1;V/Fas(52.13±21.81),(63.60±14.78)and(76.06±23.29)L;CL/F as(24.27±7.06),(27.61± 5.42)and(36.49±10.31)L·h-1,respectively.The main pharmacokinetic parameters for cefcapene acid at 100 mg from the a multi-dose study were that:tmaxas(1.90±0.70)h,t1/2as(1.63±0.16)h,MRT0-12has(2.87±0.52)h,Cssmaxas(1 133± 200)μg·L-1,AUCssas(3 607±730)μg·h·L-1,AUC0-12has(3 731±775)μg·h·L-1,AUC0-∞as(3 757±785) μg·h·L-1,V/Fas(66.15±20.29)L,CL/F as(27.85±6.66)L·h-1,Cssminas(105.4±57.17)μg·L-1,Cavas (450.9±91.2)μg·L-1,DFas(2.33±0.47),andRoas(0.870±0.131).ConclusionCefcapene pivoxil hydrochloride exhibits linear pharmacokinetics in human at doses from 100 to 300 mg after single-dose oral administration.No drug accumulation is found after multiple dose of administration.
Cefcapene pivoxil,hydrochloride;Cefcapene acid;Pharmacokinetics;LC-MS/MS
R978.1;R969
A
1004-0781(2014)03-0299-05
2013-06-24
2013-08-01
*苏州药学会-常州四药临床药学科研基金,苏州市2011年度科技发展计划(应用基础研究-医疗卫生, SYSD2011139)
周文佳(1982-),女,江苏苏州人,主管药师,硕士,研究方向:体内药物分析及药动学。电话:0512-67783687, E-mail:zwjaja@163.com。
张全英(1962-),女,江苏苏州人,主任药师,学士,研究方向:药动学及医院药学。电话:0512-67783687, E-mail:sdfeyyq@163.com。
