白杨素诱导肝癌Hep3B细胞凋亡机制研究*
2014-05-13徐成坤阳波曹建国
徐成坤,阳波,曹建国
(1.南华大学附属第一医院药剂科,衡阳 421001;2.湖南师范大学医学院药理教研室,长沙 410000)
白杨素诱导肝癌Hep3B细胞凋亡机制研究*
徐成坤1,阳波1,曹建国2
(1.南华大学附属第一医院药剂科,衡阳 421001;2.湖南师范大学医学院药理教研室,长沙 410000)
目的 研究白杨素诱导人肝癌Hep 3B细胞凋亡是否涉及激活ROS/ASK1/JNK/Bim信号通路。方法流式细胞术检测细胞凋亡,siRNA转染敲除细胞凋亡信号调节激酶1(ASK1)及Bim基因,SP600125抑制Jun氨基末端激酶(JNK),N-乙酰-L型半胱氨酸(NAC)清除活性氧(ROS),Western blot检测蛋白表达。结果白杨素显著诱导Hep 3B细胞凋亡,同时上调细胞p-ASK1、p-JNK1/2及Bim水平。NAC或SP600125预处理以及ASK1或Bim特异性siRNA转染均能有效拮抗白杨素诱导的细胞凋亡。NAC预处理能抑制白杨素活化ASK1,NAC预孵育或ASK1特异性siRNA转染能抑制白杨素活化JNK,NAC预孵育、ASK1特异性siRNA转染或SP600125预处理均能拮抗白杨素上调Bim蛋白表达效应。结论白杨素可能通过刺激ROS的生成激活ASK1,导致JNK活化,进而上调Bim表达,并最终促进Hep 3B细胞凋亡。
白杨素;肝癌;细胞凋亡;细胞凋亡信号调节激酶1
白杨素(5,7-二羟基黄酮)是从紫葳科植物木蝴蝶中提取的一种对多种肿瘤细胞具有抑制作用的黄酮类化合物。杨小红等[1]研究发现,白杨素通过活性氧(reactive oxygen species,ROS)的产生和持续的c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)激活诱导人肝癌细胞凋亡。然而,白杨素诱导肝癌细胞凋亡的精确分子机制尚未完全阐明。细胞凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)是一种多功能丝氨酸/苏氨酸蛋白激酶,参与多种生物学过程,包括细胞分化和凋亡[2-3]。已有研究报道ASK1能被包括ROS在内的许多刺激信号活化[4]。然而,ASK1在白杨素诱导肝细胞癌细胞凋亡中的作用仍然不清楚。Bim是一种促凋亡分子,是Bcl-2家族中仅含BH3结构域的新成员,Bim通过与Bcl-2和Bcl-XL结合,从而解除二者抑制凋亡作用,或者通过与Bax和Bak结合,促进细胞凋亡。同时,Bim表达水平能被JNK激酶激活c-Jun正调节[5-6],笔者在本研究中探讨ROS/ASK1/JNK/Bim信号途径在白杨素诱导肝癌Hep 3B细胞凋亡中所起的作用,为进一步阐明白杨素抗肿瘤作用的分子机制提供理论和实验依据。
1 材料与方法
1.1 细胞培养及试剂 用添加10%小牛血清、2 mmol·L-1谷氨酰胺、100 mg·L-1青霉素和100 mg·L-1链霉素的达尔伯克改良伊格尔培养基(Dulbecco's modified eagle medium,DMEM)培养基培养人肝癌Hep 3B细胞系细胞(中国典型培养物保藏中心,中国武汉),并置于5%二氧化碳(CO2)、37℃增湿环境中孵育。白杨素购自美国Sigma化学公司。用二甲基亚砜(dimethyl sulfoxide,DMSO)作为溶剂溶解白杨素,培养体系中DMSO的最高终浓度为0.1%。DMEM培养基,小牛血清(calf serum,CS),青霉素/链霉素和OptiMEM,脂质体plusTM试剂购自美国Invitrogen公司。JNK1的磷酸化1/2(Thr183/Tyr185)和JNK1的特异性抗体分别购自美国New England Biolabs公司。磷酸化的ASK1,ASK1和Bim的特异性抗体,辣根过氧化物酶标记的抗小鼠和抗兔IgG抗体购自美国Santa Cruz生物技术公司。增强化学发光检测试剂购自美国PerkinElmer Life Sciences公司。十二烷基硫酸钠聚丙烯酰胺凝胶电泳的所有材料来自美国Bio-Rad公司。N-乙酰-L-半胱氨酸(N-acetyl cysteine, NAC)、碘化丙啶(propidium iodide,PI)、胃蛋白酶抑制剂、亮肽素、其他化学品,获自美国Sigma公司。
1.2 流式细胞术分析 细胞培养在6孔细胞培养板中。细胞融合后,用不同的siRNA转染细胞48 h或使用特异性抑制剂预处理1 h,白杨素(40 μmol·L-1)处理24 h。收集细胞,用磷酸盐缓冲液(phosphate buffered solution,PBS),氯化钠137 mmol·L-1,氯化钾2.7 mmol·L-1,磷酸氢二钠4.3 mmol·L-1和磷酸二氢钾1.5 mmol·L-1,pH7.4)洗涤细胞2次,并重新置于冰冷的70%乙醇中-20℃过夜。用含50 mmol·L-1磷酸氢二钠、25 mmol·L-1柠檬酸和0.1%Triton X-100的0.4 mL磷酸盐-柠檬酸缓冲液(pH7.8)洗涤细胞2次,并随之用含0.5%Triton X-100,10 mmol·L-1哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES),100 mmol·L-1氯化钠,2 mmol·L-1氯化镁,0.1 U·mL-1RNase A,and 25 μg·mL-1PI的1.5 mL PI染色缓冲液在流式细胞分析前避光染色30 min。使用流式细胞仪(美国Becton Dickinson公司)和Cellquest程序(美国Pharmingen BD Bioscience公司)进行DNA含量分析。
1.3 小干扰RNA转染 为了瞬时siRNA转染,细胞以1×106个·mL-1接种于6孔细胞培养板上并培养过夜。翌日,用包含每孔100 ng的ASK1和Bim特异性siRNA或非特异性对照小干扰RNA(siRNA,美国Santa Cruz生物技术公司)的脂质体plusTM试剂转染细胞。siRNA寡核苷酸的序列为非特异性对照siRNA(5′-GACGCGATCAGAGAGTAAT-3′),ASK1特异性siRNA(5′-GGTGGCACAAGCAAGTTCT-3′)和Bim特异性siRNA(5′-GATCCGTTCTGAGTGTGACCGAGA-3′)。用每种siRNA转染细胞并孵育48 h。通过抗ASK1和Bim抗体的免疫印迹分析确定对ASK1和Bim蛋白表达的干扰效果。
1.4 蛋白质免疫印迹分析 蛋白质免疫印迹按照YANG等[1]报道的方法完成。抗JNK1、磷酸化JNK1/2、磷酸化ASK1、ASK1、Bim和β-actin抗体作为一抗。使用电化学发光(electrochemiluminescence,ECL)高级蛋白质印迹分析系统(美国Amersham Pharmacia Biotech公司)检测信号。
1.5 统计学方法 实验数据录入SPSS15.0版for windows evaluation软件,建立数据库,各组实验数据用均数±标准差(±s)表示,用One Way ANOVA方式行方差分析。对照组均数与实验组均数间的比较用LSD法,P<0.05为差异有统计学意义。检验水准α=0.05。
2 结果
2.1 白杨素诱导Hep 3B细胞凋亡涉及激活ASK1流式细胞术分析结果显示,siRNA敲除ASK1可有效减弱40 μmol·L-1白杨素诱导Hep 3B细胞凋亡作用(图1A)。免疫印迹检测ASK1磷酸化蛋白水平,发现40 μmol·L-1白杨素处理的Hep 3B细胞中ASK1磷酸化蛋白水平增加(图1B)。提示ASK1活化可能参与了白杨素诱导Hep 3B细胞凋亡。
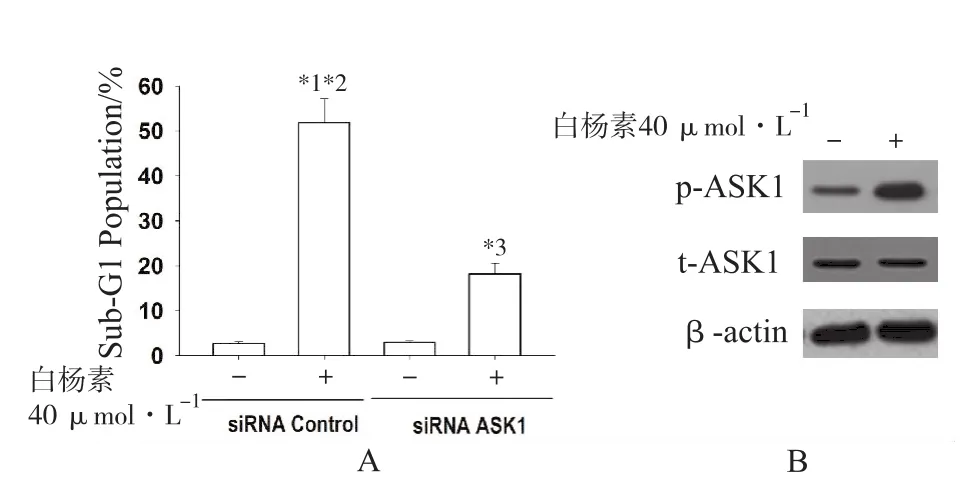
图1 白杨素诱导肝癌Hep 3B细胞凋亡涉及上调ASK1 (n=3)A.ASK1特异性小干扰RNA抑制白杨素诱导Hep 3B细胞凋亡率(Sub-G1 population)增高效应。与对照组比较,*1P<0.01,*3P<0.05;与白杨素+siRNA ASK1干预组比较,*2P<0.05;B.Western blot分析白杨素对磷酸化ASK1(p-ASK1)、总ASK1(t-ASK1)蛋白表达(β-actin为内参)Fig.1 Chrysin-induced apoptosis of hepatocellular carcinoma Hep 3B cells involving upregulation of ASK1(n=3)A.Inhibition of ASK1 specific small interfering RNA on chrysin-induced apoptosis rate(Sub-G1 population)of Hep 3B cells. Compared with the control group,*1P<0.01,*3P<0.05;compared with chrysin plus ASK1 iRNA intervention group,*2P<0.05 0.05;B.Western blot analysis on the effect of chrysin on the expression of phosphorylation ASK1(p-ASK1),total ASK1(t-ASK1)protein(β-actin as reference)
2.2 白杨素活化ASK1涉及ROS形成 流式细胞计数分析显示,抗氧化剂NAC预处理Hep 3B细胞可显著抑制白杨素诱导细胞凋亡作用(图2A)。此外,免疫印迹分析表明,10 mmol·L-1NAC预处理抑制白杨素增加ASK1磷酸化水平作用(图2B)。提示白杨素诱导Hep 3B细胞凋亡可能通过产生ROS,继而活化ASK1所介导。
2.3 白杨素诱导Hep 3B细胞JNK活化涉及ROS和ASK1 免疫印迹分析表明,白杨素可增高JNK1/2蛋白磷酸化水平,而对其总蛋白水平无影响(图3A),再次证实白杨素通过活化JNK方式介导Hep 3B细胞凋亡[1]。而NAC预处理可拮抗白杨素激活JNK(图3A)。同样,用ASK1特异性siRNA预处理也可拮抗白杨素激活JNK效应(图3B)。因此,这些发现提示,白杨素诱导Hep 3B细胞JNK1/2活化需要ROS-ASK1级联介导。

图2 白杨素激活Hep 3B细胞ASK1涉及ROS形成(±s,n=3)A.NAC抑制白杨素诱导Hep 3B细胞凋亡率(Sub-G1 population)增高作用。与对照组比较,*1P<0.01,*3P<0.05;与Chrysin+NAC组比较,*2P<0.05;B.Western blot分析NAC对chrysin活化ASK1的影响(β-actin为内参)Fig.2 Chrysin-induced ASK1 activation in Hep 3B cells involving ROS formation(±s,n=3)A.Inhibition of NAC on chrysin-induced apoptosis rate(Sub-G1 population)of Hep 3B cells.Compared with the control group,*1P<0.01,*3P<0.05;compared with chrysin plus NAC group,*2P<0.05;B.Western blot analysis on the effect of NAC on ASK1 activation by chrysin(β-actin as reference)
2.4 白杨素诱导Hep 3B细胞凋亡涉及上调Bim 流式细胞术分析显示,siRNA敲除Bim显著抑制白杨素诱导细胞凋亡作用(图4A)。免疫印迹分析表明,白杨素上调Bim蛋白表达,NAC、ASK1特异性siRNA及JNK抑制剂SP600125具有拮抗白杨素上调Bim蛋白表达作用(图4B)。提示白杨素诱导Hep 3B细胞Bim蛋白表达涉及ROS-ASK1-JNK级联。
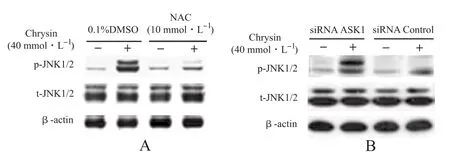
图3 白杨素激活Hep 3B细胞JNK涉及ROS形成和激活ASK1A.Western blot分析NAC抑制白杨素活化JNK1/2作用; B.Western blot分析ASK1特异性小干扰RNA(si RNA)对白杨素活化JNK1/2作用的影响Fig.3 Chrysin-induced JNK activation in Hep 3B cells involving ROS formation and ASK1 activationA.Western blot analysis on the inhibition of NAC on JNK1/2 activation by chrysin;B.Western blot analysis on the effect of specific small interfering RNA of ASK1 on JNK1/2 activation by chrysin

图4 白杨素诱导Hep 3B细胞凋亡涉及上调Bim(n=3)A.Bim特异性小干扰RNA(si RNA)拮抗白杨素诱导Hep 3B细胞凋亡率(Sub-G1 population)增高作用,与对照组比较,*1P<0.01,*3P<0.05;与Chrysin+siRNA Bim组比较,*2P<0.05;B.Western blot分析NAC、siRNA ASK1、JNK特异性阻断剂SP600125对chrysin诱导Bim蛋白表达的影响Fig.4 Chrysin-induced apoptosis of Hep 3B cells involving upregulation of Bim(n=3)A.Inhibition of specific small interfering RNA of Bim(SiRNA)on chrysin-induced apoptosis rate(Sub-G1 population)of Hep 3B cells.Compared with the control group,*1P<0.01,*3P<0.05;compared with chrysin plus Bim iRNA group,*2P<0.05; B.Western blot analysis on the effect of NAC,ASK1 siRNA and SP600125,a specific blocker of JNK on chrysin-induced the expression of Bim protein
3 讨论
本研究结果显示,白杨素通过激活ROS-ASK1-JNK信号级联上调Bim蛋白表达,诱导Hep 3B细胞凋亡。
活化的ASK1通过刺激下游信号事件,包括MKK4/7和激活JNK,在调节各种生物学过程包括细胞分化和凋亡中扮演重要角色[7]。JNK被认为是ASK1激活后发挥作用的靶基因[8]。然而,ASK1-JNK信号通路是否参与白杨素诱导肝癌细胞凋亡还没有阐明。在本实验中笔者发现,白杨素处理Hep 3B细胞导致ASK1、JNK依次激活,而且ASK1特异性siRNA和JNK抑制剂(SP600125)有效地拮抗白杨素诱导细胞凋亡。ASK1特异性siRNA抑制白杨素诱导JNK1/2活化。此外,白杨素诱导Bim蛋白表达的作用亦被ASK1特异性siRNA和JNK抑制剂所抑制。这些结果显示白杨素可能通过活化ASK1激活JNK,而JNK激酶活化后激活c-Jun上调Bim蛋白表达,并最终引起Hep 3B细胞凋亡。
许多研究显示,ROS可能通过氧化TRX和GRX活化ASK1[2-3]。最近的报道显示,ASK1通过减少967丝氨酸磷酸化同时于抑制蛋白解离增加来响应氧化应激如过氧化氢(H2O2),导致细胞凋亡功能增强[9]。在本实验中,笔者发现NAC抑制白杨素诱导ASK1活化、JNK活化、Bim蛋白表达和细胞凋亡。这些发现显示ROS可能在白杨素诱导ASK1活化和后续的信号事件中起关键作用。
Bcl-2家族蛋白通过抗凋亡和促凋亡因子调节线粒体触发凋亡途径,决定细胞的生或死。Bim作为Bcl-2家族的促凋亡成员,通过破坏线粒体完整性导致细胞凋亡。有研究表明,Bim基因表达能响应选择性的应激信号[10]。在本研究中,笔者发现白杨素诱导Bim表达并且Bim特异性siRNA拮抗白杨素诱导Hep 3B细胞凋亡,这些结果提示Bim表达与白杨素诱导Hep 3B细胞凋亡可能呈因果关系。此外,抗氧化剂NAC、JNK抑制剂(SP600125)和ASK1特异性siRNA抑制白杨素诱导Bim表达。因此,笔者认为白杨素通过激活ROS-ASK1-JNK信号级联,上调Bim表达,并最终诱导Hep 3B细胞凋亡。最近的报道显示,除了Bim外,其他Bcl-2家族成员也参与白杨素诱导癌细胞凋亡过程[11]。这些发现,至少部分说明,为什么阻断ASK1信号级联没能完全消除白杨素诱导Hep 3B细胞凋亡效应。
总之,本实验结果首次证明白杨素诱导人肝癌Hep3B细胞凋亡的分子机制涉及激活ROS-ASK1-JNK信号级联促进Bim蛋白表达。
[1] YANG X H,ZHENG X,CAO J G,et al.8-Bromo-7-methoxychrysin-induced apoptosis of hepatocellular carcinoma cells involves ROS and JNK[J].World J Gastroenterol, 2010,16(27):3385-3393.
[2] AL-GAYYAR M M,ABDELSAID M A,MATRAGOON S,et al.Thioredoxin interacting protein is a novel mediator of retinal inflammation and neurotoxicity[J].Br J Pharmacol, 2011,164(1):170-180.
[3] NAKAGAWA H,HIRATA Y,TAKEDA K,et al.Apoptosis signal-regulating kinase 1 inhibits hepatocarcinogenesis by controlling the tumor-suppressing function of stress-activated mitogen-activated protein kinase[J].Hepatology,2011, 54(1):185-195.
[4] LIU H,XU R,FENG L,et al.A novel chromone derivative with anti-inflammatory property via inhibition of ROS-dependent activation of TRAF6-ASK1-p38 pathway[J].PLoS One,2012,7(8):e37168.
[5] KUO C T,CHEN B C,YU C C,et al.Apoptosis signal-regulating kinase 1 mediates denbinobin-induced apoptosis in human lung adenocarcinoma cells[J].J Biomed Sci,2009, 16(10):43.
[6] DU Z X,YAN Y,ZHANG H Y,et al.Suppression of MG132-mediated cell death by peroxiredoxin 1 through influence on ASK1 activation in human thyroid cancer cells [J].Endocr Relat Cancer,2010,17(3):553-560.
[7] SAYAMA K,HANAKAWA Y,SHIRAKATA Y,et al.Apoptosis signal-regulating kinase 1(ASK1)is an intracellular inducer of keratinocyte differentiation[J].J Biol Chem, 2001,276(2):999-1004.
[8] REN L,YANG H Y,CHOI H I,et al.The role of peroxiredoxin V in(-)-epigallocatechin 3-gallate-induced multiple myeloma cell death[J].Oncol Res,2011,19(8-9):391-398.
[9] COCKRELL L M,PUCKETT M C,GOLDMAN E H,et al. Dual engagement of 14-3-3 proteins controls signal relay from ASK2 to the ASK1 signalosome[J].Oncogene,2010, 29(6):822-830.
[10] JIN H O,PARK I C,AN S,et al.Up-regulation of Bak and Bim via JNK downstream pathway in the response to nitric oxide in human glioblastoma cells[J].J Cell Physiol,2006, 206(2):477-486.
[11] KUO C T,HSU M J,CHEN B C,et al..Denbinobin induces apoptosis in human lung adenocarcinoma cells via Akt inactivation,Bad activation,and mitochondrial dysfunction [J].Toxicol Lett,2008,177(1):48-58.
DOI 10.3870/yydb.2014.03.006
Investigation of Mechanism Underlying Chrysin-induced Apoptosis in Hepatocellular Carcinoma Hep3B Cells
XU Cheng-Kun1,YANG bo1,CAO Jian Guo2
(1.Pharmaceutical Preparation Section,the First Affiliated Hospital,the University of South China,Hengyang 421001,China;2.Hunan Normal University School of Medicine Pharmacology Teaching and Research Section,Changsha 410000,China)
Objective To investigate whether the apoptosis induced by chrysin in hepatocellular carcinoma Hep 3B is involved in activation of ROS/ASK1/JNK/Bim signal pathway.MethodsApoptosis was examined using flow cytometry. Apoptosis signal-regulating kinase 1(ASK1)and Bim genes were knocked out by small interfering RNA(siRNA)transfection. Reactive oxygen species(ROS)and c-Jun N-terminal kinase(JNK)activity were suppressed by their specific inhibitorsN-acetyl-L-cysteine(NAC)and SP600125,respectively.The protein expression was detected by western blot analysis.ResultsChrysin significantly induced apoptotic cell death and was able to up-regulate the levels of p-ASK1,p-JNK1/2 and Bim in Hep 3B cells.However,the apoptosis induced by chrysin would be effectively suppressed by pretreatment with NAC or SP600125 and transfected with ASK1-specific siRNA or Bim-specific siRNA.Accordingly,pretreatment with NAC could suppress chrysinmediated ASK1 activation;Pretreatment with NAC or transfected with ASK1-specific siRNA could suppress JNK activation;and pretreatment with NAC or SP600125 and transfected with ASK1-specific siRNA could suppress chrysin-induced Bim expression.ConclusionChrysin might activate ASK1 through ROS production to cause JNK activation,which in turn induces Bim expression,and ultimately results in Hep 3B cell apoptosis.
Chrysin;Hepatocellular carcinoma;Apoptosis;Apoptosis signal-regulating kinasel
R286;R965
A
1004-0781(2014)03-0295-04
2013-08-05
2013-09-10
*国家自然科学基金资助项目(NO.09A054)
徐成坤(1963-),男,湖南邵阳人,副主任药师,主要从事医院药学管理与临床药学工作。电话:0734-8578926,E-mail:ckx1881@163.com。
