高效液相色谱法测定叶酸片的含量与有关物质
2014-05-13吴宏富黄卫平刘放
吴宏富,黄卫平,刘放
(1.浙江省庆元县中医院药剂科,庆元 323800;2.浙江医学高等专科学校,杭州 310053;3.浙江省医学科学院药物研究所,杭州 310013)
高效液相色谱法测定叶酸片的含量与有关物质
吴宏富1,黄卫平2,刘放3
(1.浙江省庆元县中医院药剂科,庆元 323800;2.浙江医学高等专科学校,杭州 310053;3.浙江省医学科学院药物研究所,杭州 310013)
目的 建立测定叶酸片含量及有关物质的高效液相色谱(HPLC)法。方法采用Hypersil C18(4.6 mm× 250 mm,5 μm)色谱柱,流动相磷酸盐缓冲液(磷酸二氢钾6.8 g与0.1 mol·L-1氢氧化钾溶液70 mL,加水稀释至800 mL,调节pH至6.3,加甲醇80 mL,用水稀释成1 000 mL为流动相),检测波长254 nm。结果叶酸在19.80~277.24 μg·mL-1浓度范围内,峰面积与浓度呈良好线性关系(r=0.999 9,n=7),平均回收率98.65%~98.95%,RSD= 0.20%~0.60%(n=9)。叶酸及其有关物质得到基线分离,方法最低检测限0.6 ng,控制总杂质量不得超过2.0%。结论该方法测定叶酸片的含量及有关物质,方法简便、快速、结果准确,专属性好,适用于叶酸片及其制剂的质量控制。
叶酸;有关物质;质量控制;色谱法,高效液相,反相
叶酸(folic acid)是一种抗贫血药物,亦称维生素M或维生素BC,与人体重要的生化过程密切相关,直接影响核酸的合成及氨基酸代谢,对细胞分裂、增殖和组织生长具有极其重要的作用,妇女怀孕早期适量增补叶酸可以降低神经管畸形的发生[1]。叶酸已成为一种集预防、治疗和保健于一身的多功能药物而越来越受到重视。有关叶酸分析方法的报道有紫外分光光度法[2]、一阶导数光谱法[3]、流动注射化学发光法[4]以及高效液相色谱法等,其中以高效液相色谱法最常用。为了控制叶酸制剂的质量,笔者者参考有关文献[5-11],建立了高效液相色谱法测定叶酸片的含量和有关物质,现报道如下。
1 仪器与试药
1.1 仪器 岛津LC-10ATvp高效液相色谱仪;SPD-10A紫外检测器,N-2000双通道色谱工作站(浙江大学智能信息工程研究所,浙江大学智能信息工程有限公司);TU-1800紫外-可见分光光度计(北京普析通用仪器有限责任公司),Sartorius BS124S电子天平(北京赛多利斯仪器系统有限公司),YB-2型澄明度检测仪(天津大学精密仪器厂),SB-2200超声波清洗器(上海必能信超声有限公司),PHS-9V型酸度计(杭州华光无线电厂),101-1型电热鼓风干燥箱(上海锦屏仪器仪表有限公司通州分公司)。
1.2 试药 叶酸对照品(中国食品药品检定研究院,批号:100074-200912,HPLC法测定含量为90.6%,UV法测得含量为91.7%)。叶酸片(北京北大药业有限公司,商品名:斯利安,规格:0.4 mg,批号:S080203, S090413),叶酸片(浙江省医学科学院药物研究所,批号:E00910,E01010,E01110,规格:0.4 mg),甲醇(上海陆都实业有限公司,色谱纯),磷酸二氢钾(上海化学试剂二厂,分析纯),氢氧化钾(浙江杭州萧山化学试剂厂,分析纯),磷酸(建德化工厂,分析纯),水为双蒸馏水(自制)。
2 方法与结果
2.1 叶酸紫外吸收光谱 取叶酸对照品约10 mg,置50 mL棕色量瓶,加0.5%氨溶液30 mL,溶解后用水稀释至刻度,摇匀,精密量取1 mL置20 mL棕色量瓶,用水稀释至刻度,摇匀,制成每毫升约含叶酸10 μg的溶液,在波长200~500 nm范围内进行全扫描,结果叶酸在254 nm波长处有最大吸收(图1)。
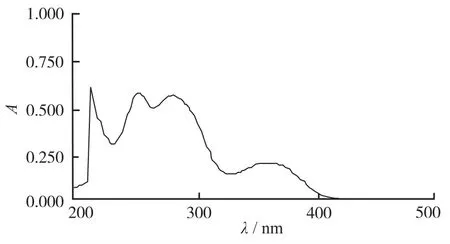
图1 叶酸紫外吸收光谱
2.2 色谱条件 色谱柱:Hypersil C18柱(4.6 mm× 250 mm,5 μm),流动相:磷酸盐缓冲液(pH6.3)(取磷酸二氢钾6.8 g与0.1 mol·L-1氢氧化钾溶液70 mL,加水稀释至800 mL溶解,调节pH至6.3,加甲醇80mL,用水稀释成1000mL),流速: 1.0 mL·min-1,检测波长:254 nm,柱温:室温,进样量:20 μL。灵敏度:0.05 AUFS,理论板数以叶酸峰计不得低于2 000。
2.3 含量测定
2.3.1 标准曲线的绘制 取叶酸对照品约20 mg精密称定至50 mL棕色量瓶,加入5%氨水30 mL助溶,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀,即得0.400 mg·mL-1对照品溶液;精密吸取0.5,1.0,2.0,4.0,5.0,6.0和7.0 mL,分别置于7只10 mL棕色量瓶,用水稀释至刻度,摇匀。精密量取10 μL注入液相色谱仪,记录色谱图和峰面积,以叶酸浓度(C,μg·mL-1)对相应峰面积(A)进行线性回归,回归方程为:A=1 986.78C+1 084.47,r=0.999 9(n=7),结果叶酸浓度在19.80~277.24 μg·mL-1范围内线性关系良好。
2.3.2 加样回收实验 分别取叶酸对照品约16,20, 24 mg精密称定置于100 mL棕色量瓶,各3份,按处方比例加入混合辅料,加0.5%氨溶液约60 mL,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀,滤过,取续滤液作为样品供试品溶液。另配制含叶酸200 μg·mL-1对照品溶液,精密量取供试品溶液与对照品溶液各10 μL注入液相色谱仪,记录色谱图和峰面积,按外标法以峰面积计算叶酸加样回收率。结果见表1。
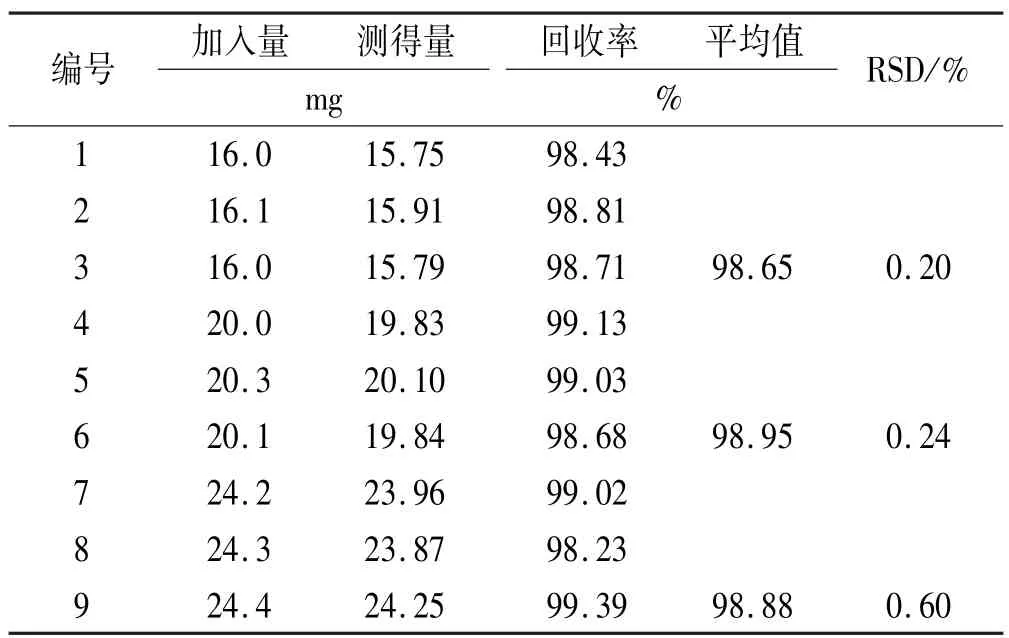
表1 叶酸回收实验结果
2.3.3 重复性实验 取本品50片,精密称定,研细,取适量(相当于叶酸5 mg),精密称定置25 mL棕色量瓶(平行操作6份),加0.5%氨溶液约15 mL,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液,精密量取10 μL注入液相色谱仪,记录色谱图;另取上述含叶酸200 μg·mL-1对照品溶液,同法测定。按外标法以峰面积计算,结果叶酸平均含量为99.38%,RSD= 0.57%(n=6)。
2.3.4 供试品溶液稳定性 取“2.3.3”项供试品溶液,分别于0,1,2,4,8 h,精密量取10 μL注入液相色谱仪,记录色谱图和峰面积,结果样品供试液在8 h内所测得的图谱峰面积的RSD=0.29%(n=5),表明供试品溶液在8 h内稳定性良好。
2.3.5 样品的含量测定 取叶酸2批,按“2.3.3”项操作,制备供试品溶液和对照品溶液,依法测定,结果见表2。
2.4 样品有关物质检查
2.4.1 方法专属性实验 取叶酸片50片,精密称定,研细,取适量(相当于叶酸20 mg),精密称定置50 mL棕色量瓶,加0.5%氨溶液约30 mL,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀,滤过,取续滤液(含叶酸约为400 μg·mL-1)备用。
2.4.1.1 未破坏供试品溶液的制备 取上述续滤液5 mL,置10 mL棕色量瓶,用水稀释至刻度,摇匀,作为供试品溶液(含叶酸约为200 μg·mL-1)。
2.4.1.2 强酸破坏供试品溶液的制备 取上述续滤液5 mL,置10 mL棕色量瓶,加1 mol·L-1盐酸1 mL,放置4 h,再加1 mol·L-1氢氧化钠1 mL中和,用水稀释至刻度,摇匀,作为供试品溶液(含叶酸约为200 μg·mL-1)。
2.4.1.3 强碱破坏供试品溶液的制备 取上述续滤液5 mL,置10 mL棕色量瓶,加1 mol·L-1氢氧化钠溶液1 mL,放置4 h,再加1 mol·L-1盐酸1 mL中和,用水稀释至刻度,摇匀,作为供试品溶液(含叶酸约为200 μg·mL-1)。
2.4.1.4 氧化破坏供试品溶液的制备 取上述续滤液5 mL,置10 mL棕色量瓶,加30%过氧化氢,放置1 h,用水稀释至刻度,摇匀,作为供试品溶液(含叶酸约为200 μg·mL-1)。
2.4.1.5 高温破坏供试品溶液的制备 取叶酸片20片,精密称定,置烘箱中于90℃中放置12 h,取出放冷后,研细,取适量(相当于叶酸5 mg),精密称定置25 mL棕色量瓶,加0.5%氨溶液约15 mL,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液(含叶酸约为200 μg·mL-1)。
2.4.1.6 强光破坏供试品溶液的制备 取叶酸片20片,精密称定,置澄明度检测仪中,于照度(4 500±500)Lx强光下照射24 h,取出后,研细,取适量(相当于叶酸5 mg),精密称定置25 mL棕色量瓶,加0.5%氨溶液约15 mL,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液(含叶酸约为200 μg·mL-1)。
2.4.1.7 混合辅料供试品溶液的制备 取混合辅料适量,置25 mL棕色量瓶,加0.5%氨溶液约15 mL,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀,滤过,作为供试品溶液。
精密量取上述供试品溶液10 μL,注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。实验结果表明供试品经上述剧烈条件破坏后产生的杂质峰、降解产物峰与叶酸峰均能达到较好的分离,分离度(R)均>1.5;混合辅料在叶酸主峰位置及附近均不出峰,不干扰分析测定。
2.4.2 定量限与检测限 取叶酸对照品约5 mg精密称定,置于25 mL棕色量瓶,加0.5%氨溶液约15 mL,置热水浴中加热20 min,时时振摇使叶酸溶解,放冷,用水稀释至刻度,摇匀。制成浓度为200 μg·mL-1对照品溶液;精密量取1 mL,置10 mL棕色量瓶,用水稀释至刻度,摇匀。制成浓度为20 μg·mL-1的对照品溶液;依次类推制成浓度为0.2和0.06 μg·mL-1的对照品溶液;量取不同体积分别进样,当信噪比(S/N)≥10和S/N≥3时,叶酸定量限为2 ng,检测限为0.6 ng。
2.4.3 样品有关物质的测定 采用自身对照法。取“2.3.5”项供试品溶液作为供试品溶液;精密量取供试品溶液1 mL,置50 mL棕色量瓶,用水稀释至刻度,摇匀,作为对照溶液。精密量取对照溶液10 μL注入液相色谱仪,调节检测灵敏度,使对照溶液的主峰高为满量程的20%;再精密量取供试品溶液和对照溶液各10 μL,分别注入液相色谱仪,记录色谱图至主峰保留时间的2倍。供试品溶液色谱图中如有杂质峰,各杂质峰面积之和不得大于对照溶液的主峰面积(2. 0%),结果见表2。
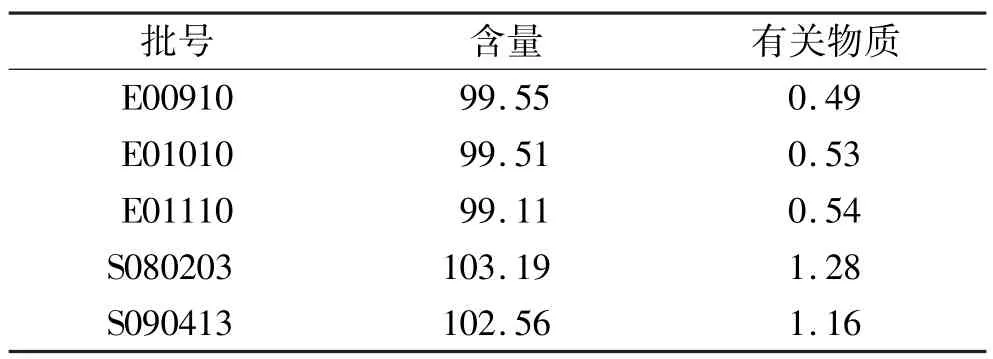
表2 叶酸片含量和有关物质测定结果 %,n=3
3 讨论
3.1 波长的选择 根据“2.1”项实验结果,叶酸在波长254 nm处有最大吸收,与文献[5-7]报道相符,辅料在254 nm波长处没有吸收,故实验采用254 nm作为检测波长。
3.2 流动相的选择 采用高效液相色谱法测定叶酸类药物含量的报道较多[5-11],所用流动相有磷酸盐缓冲液(pH6.3)(取磷酸二氢钾6.8 g与0.1 mol·L-1氢氧化钾溶液70 mL,加水稀释至800 mL溶解,调节pH至6.3,加甲醇80 mL,用水稀释成1 000 mL)[5-6],以磷酸二氢钾6.8 g与0.1 mol·L-1氢氧化钾水溶液70 mL,稀释约850 mL,用氢氧化钾稀溶液调节pH至6.3±0.1,加甲醇130 mL,水稀释成1 000 mL的溶液[7],甲醇-0.05 mol·L-1磷酸二氢钾缓冲液(11∶89, pH5.4)[8],甲醇∶水(含2%醋酸、0.1%辛烷磺酸钠、0.2%乙二胺,25∶75[9],甲醇∶水=30∶70[10],甲醇-水-冰醋酸(40∶60∶0.1)[11]等;参照叶酸片质量标准(《中华人民共和国药典》2010年版二部),本实验采用以磷酸盐缓冲液(pH6.3)(取磷酸二氢钾6.8 g与0.1 mol·L-1氢氧化钾溶液70 mL,加水稀释至800 mL溶解,调节pH至6.3,加甲醇80 mL,用水稀释成1 000 mL)流动相。
3.3 供试品溶液稳定性 叶酸在水和酸性条件下具有热不稳定性和光不稳定性,而在稀碱条件下易溶且稳定性好,因此在实验中用0.5%氨溶液溶解样品,且操作过程需要避光。
3.4 方法专属性 方法专属性实验显示,本品经酸、碱、氧化、高温、光等破坏实验,产生的杂质峰和降解产物峰均能与主峰达到基线分离,说明该色谱条件可用于叶酸片的有关物质和降解产物的检查。
3.5 方法优点 目前,《中华人民共和国药典》2010年版[5]叶酸及其制剂叶酸片质量标准项下尚无有关物质测定方法。笔者在本实验中经过系列方法学研究,采用高效液相色谱法-紫外检测器测定叶酸片的含量和有关物质,方法简便易行,准确度高,专属性好,易于普及,可作为叶酸及其制剂的质量控制方法。
[1] 李竹,BREEY R J.中国妇女妊娠前后单纯服用叶酸对神经管畸形的预防效果[J].中华医学杂志,2000,80 (7):493-496.
[2] 叶立,田义梅.紫外分光光度法测定叶酸片的含量[J].天津药学,2000,12(3):63-64.
[3] 林达梅,卢剑辉,高敏.一阶导数光谱法测定叶酸片的含量[J].海峡药学,2001,13(3):62-63.
[4] 孙春燕,赵慧春,欧阳津.流动注射化学发光法测定叶酸[J].分析实验室,2000,19(3):60-62.
[5] 国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:109-110,137-138.
[6] 林琳,史慷梅.高效液相法测定叶酸片含量[J].药物分析杂志,1989,9(2):96-97.
[7] 李新会,胡建国,卢康宁.高效液相色谱测定叶酸[J].防化研究,2005,(2):9-11.
[8] 苏玉永,王虎,郑思维.高效液相色谱法测定复方维生素胶囊中维生素B6与叶酸的含量[J].中国医院药学杂志,2005,25(4):379-380.
[9] 邵生文,王艳.高效液相色谱法测定复合维生素胶囊中叶酸含量[J].中国民康医学,2007,19(7):591-592.
[10] 黄宏南,陈宏靖,黄健文.高效液相色谱荧光快速测定保腱食品中的叶酸[J].中国卫生检验杂志,2002,12(1): 70.
[11] 高桂花,盛筱,李雪冰.高效液相色谱法测定叶酸片中叶酸含量[J].济宁医学院学报,2010,33(4):238-240.
DOI 10.3870/yydb.2014.03.034
R977.2;R927.1
A
1004-0781(2014)03-0389-04
2013-07-06
2013-08-20
吴宏富(1972-),男,浙江庆元人,副主任药师,主要从事医院药学工作。E-mail:qywhf@yesh.net。
