大鼠脂肪干细胞分离培养及细胞表型的研究
2014-05-05吕春燕陈高莉陈昌金杨雪梅
吕春燕,陈高莉,杨 玲,陈昌金,袁 慧,杨雪梅
(1.成都市第五人民医院病理科,四川 成都 611130;
2.成都中医药大学附属医院检验科,四川 成都 610072;3.成都中医药大学附属医院中心实验室,四川 成都 610072)
大鼠脂肪干细胞分离培养及细胞表型的研究
吕春燕1,陈高莉2,杨 玲2,陈昌金3,袁 慧3,杨雪梅3
(1.成都市第五人民医院病理科,四川 成都 611130;
2.成都中医药大学附属医院检验科,四川 成都 610072;3.成都中医药大学附属医院中心实验室,四川 成都 610072)
目的分离、培养和冻存大鼠脂肪干细胞,并对其相关的细胞表型进行研究,为利用脂肪干细胞治疗梗阻性肾病肾纤维化等实验提供依据。方法取大鼠3只,经消毒麻醉,采集其腹股沟处脂肪组织分离培养其中的脂肪干细胞,用相差倒置显微镜观察细胞生长方式及形态变化。取第三代细胞用流式细胞仪作细胞免疫表型的鉴定。冻存复苏后再次检测干细胞生长情况及表型。结果大鼠脂肪组织中含有大量间充质干细胞,原代培养的ASCs呈小圆形或星形,经传代后的脂肪干细胞形态比较均一,呈长梭形,个别略呈多角形、漩涡样生长。其细胞表型为CD29、CD44高表达,CD73、CD105中等程度表达,CD34极低表达。脂肪干细胞经低温冻存3个月,复苏后,生长活力和存活率与冻存前未见明显区别,CD44和CD29检测与冻存前表达率也一致。结论建立了一种脂肪干细胞的有效分离、培养及保存方法,并对其表面标志物进行鉴定,为利用脂肪干细胞进行进一步的实验研究提供了依据。
脂肪干细胞;细胞培养;表面标志物;鉴定;冻存
脂肪干细胞(Adipose derived mesenchymal stem cells,ADMSCs)[1],具有来源丰富、创伤小、易获取、增殖快,可以塑形及免疫原性低等优点,受到越来越多的重视,因此,脂肪干细胞的分离、培养及保存逐渐成为一项重要技术。本文对大鼠ADMSCs进行分离培养,并对其表面标志物进行检测及冻存复苏前后标志物的变化进行研究,为今后进一步研究提供依据。
1 材料与方法
1.1 实验动物、主要试剂及仪器 清洁级近交系SD雄性大鼠3只,4周龄,体重100~150 g。由四川大学华西医学实验动物中心提供。主要的试剂见表1。仪器有相差倒置显微镜(Olympus公司,日本);荧光显微镜(Bio-Rad公司,美国);流式细胞分析仪(Thermo公司,美国)。


表1 实验使用的主要试剂情况表
1.2 ADMSCs的分离与培养 取SD大鼠,25%乌拉坦(0.25 g/kg)腹腔麻醉后颈椎脱臼法处死,置于75%的乙醇中浸泡10 min;无菌条件下取出腹股沟皮下脂肪,PBS冲洗3次后,用眼科剪剪碎;加入2~3倍体积的1 g/LⅠ型胶原酶,用移液管移至试管中,置于37℃恒温箱中30 min,每隔5~10 min振荡1次;30 min后,加入等量含10%FBS的DMEM-F12培养基,常温下以离心加速度800 g离心5 min;将上清液轻轻吸出,将细胞沉淀用DMEM培养液(含10%FBS)重悬并稀释至5倍,用70 μm滤网过滤,以便除去其中未消化的组织。细胞计数板计数,调整细胞浓度为1×105个/ml。在10 cm×10 cm的培养皿中接种,将培养皿培养在37℃、5%CO2培养箱中。第一次换液在24~48 h进行,此后每2~3 d换液,待细胞生长融合达80%~90%时(5~7 d),进行消化传代(消化溶液为0.02%EDTA和0.25%胰蛋白酶按2:1混合而成)。用相差倒置显微镜观察细胞形态变化。
1.3 流式细胞仪检测 收集第4代细胞,用PBS液洗涤脂肪干细胞3次后,分成6组。每组细胞浓度为2×106个/ml。分别加入相应饱和浓度的单克隆抗体。以加入相应体积的PBS液作为空白对照组。具体见表2。用流式细胞仪作细胞表型的检测。

表2 流式细胞仪检测相应单克隆抗体
1.4 ADMSCs的冻存与复苏 第三代脂肪干细胞经消化后,放入离心机中,以1 000 r/min离心5 min,轻轻吸出上清液。加入按含DMSO:胎牛血清:基础培养液=1:3:6配制的冻存液,以1×105/ml左右调整细胞密度,并以冻存管保存。然后以下列顺序进行保存:4℃冰箱1 h→-20℃冰箱1 h→-80℃冰箱过夜→液氮罐中保存。3个月后,取冻存的第3代ASCs,常温快速融化,将其复苏。以离心管装细胞悬液,1 000 r/min离心5 min,轻轻吸出上清液。再以15 ml培养液吹打重悬细胞沉淀,再以上述方式离心并吸出上清液。加适当培养基在37℃培养箱中培养。24 h后观察复苏后细胞的形态及生长情况,并进行存活率测定(即用0.4%台盼蓝染液测定细胞拒染百分比)。CD44、CD29表达情况的检测如前述。
2 结 果
2.1 细胞形态学观察 初次接种细胞时,培养物中常可见少量红细胞,但这些红细胞数量随着培养时间的延长和换液次数的增多而逐渐清除。原代培养约24 h,少量细胞开始贴壁,并伸展,多数贴壁细胞形态不规则,呈小圆形或小多角形。有细小的突起伸出,核居中,可有1~2个核仁。48 h后可见较多贴壁细胞,未贴壁细胞经换液除去后,可见大部分贴壁细胞呈长梭形,较为扁平,仍可见个别折光率较高的小圆形或卵圆形细胞(图1);5~7 d后,融合细胞呈单层排列,可覆盖85%以上,并向着一定方向生长,但其中仍混有个别卵圆形及圆形细胞(图2)。消化传代后,细胞生长速度较原代明显增快,2~3 d即可覆盖约85%以上(传代后细胞形态见图3)。

图1 接种后48 h,脂肪干细胞形态(倒置相差显微镜,×10);图2接种6 d后,脂肪干细胞形态(倒置相差显微镜,×20);图3消化传代后细胞形态(倒置相差显微镜,×40)
2.2 流式细胞仪检测结果 CD44、CD29呈高表达(图4、图5),CD105、CD73中等程度表达(图6、图7),CD34呈极低表达(图8)。
2.3 脂肪干细胞的冻存与复苏 经上述方法冻存复苏后的第3代脂肪干细胞细胞细胞形态和生长状态良好(图9),与冻存前无明显区别。0.4%台盼蓝染液测定细胞拒染百分比(即存活率测定)为80%。CD44阳性率为95.8%,与冻存前流式细胞仪结果对比如表3,统计学处理显示,差异有统计学意义。CD29阳性率为99.5%,与冻存前流式细胞仪检测结果比较见表4,统计学处理显示,差异有统计学意义。培养3 d后传代,其增殖能力与冻存前相比,无明显改变。实验结果采用两样本率等效χ2检验,实验结果经SPSS18.0处理,χ2=54.913,P<0.01,差异有统计学意义,可认为冻存前检测结果与冻存后检验结果等效,即一致。实验结果采用两样本率等效χ2检验,实验结果经SPSS18.0处理,χ2=11.577,P<0.01,差异有统计学意义,可认为冻存前检测结果与冻存后检验结果等效,即一致。
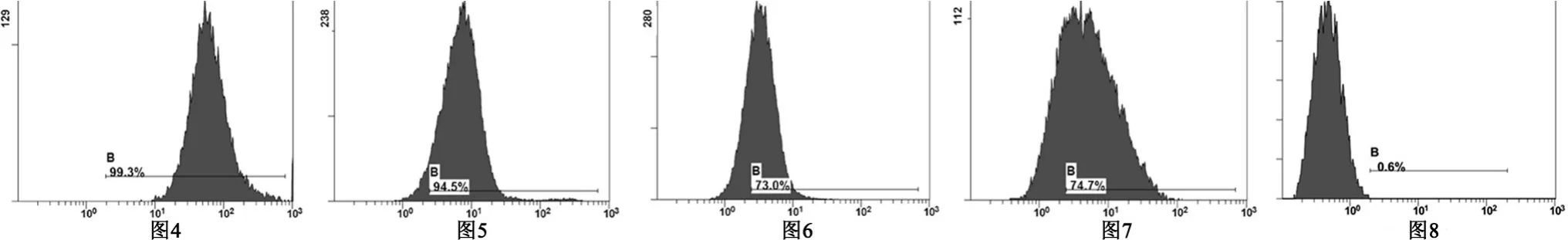
CD29表达率为99.3% CD44阳性表达率为94.5% CD105阳性表达率为73% CD73阳性表达率为74.7% CD34阳性表达率为1.1%
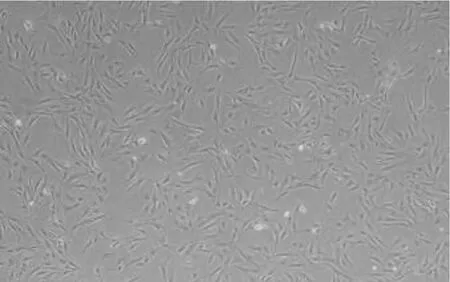
图9 经冻存复苏后细胞生长状态良好,3 d后即可传代

表3 冻存前后CD44表达情况对比表

表4 冻存前后CD29表达情况对比表
3 讨论
目前,移植具有良好功能的细胞的细胞移植是治疗终末期器官功能损害的研究热点之一。具有可向多个胚层细胞分化的潜能及良好的自身复制功能的干细胞,已逐渐称为细胞移植最理想的种子细胞[1-3]。
自从2001年Zuk等[4]首次通过吸脂术抽取脂肪组织悬液培养出多能干细胞,ADSCs因其取材方便,对供体创伤小,一次取材获取的细胞数量大,免疫原性低等优点成为近年来干细胞的研究热点[5-6]。本实验对脂肪干细胞进行分离、培养和保存,并对其冻存前后的细胞标识进行研究,为今后的研究提供研究基础。
目前的研究发现[7-11],脂肪干细胞主要表面标志有:CD29(+)、CD44(+)、CD59(+)、CD105(+)、CD166(+)、CD14(-)、CD34(-)、CD38(-)、CD45(-)、CD117(-)等,我们的研究也作了一定探讨,研究结果显示:CD44、CD29高表达,CD105、CD73中等程度表达与文献报道一致,说明脂肪干细胞分离培养成功。本实验选取大鼠腹股沟脂肪组织,从中分离出干细胞,由于脂肪组织中含有结缔组织及血管组织,内皮标记CD34阳性表达率为0.6%,可能提示细胞成分不纯,但极低表达,可根据后续试验需要进行处理,必要时再次纯化,以得到较多所需细胞。
本实验初次接种细胞时,有少量红细胞混在正常培养细胞中,由于红细胞具有不贴附于塑料培养皿生长的特性,2~3次换液后,随着培养时间的延长,红细胞基本被清除,不需要特殊处理,即可获得较好的效果,减少了杂质的带入,与文献报道一致[12]。
本实验对初次分离培养的脂肪干细胞和冻存3个月后复苏的脂肪干细胞进行了对比研究,结果显示第3代脂肪干细胞冻存3个月后复苏,复苏前后的细胞形态和生长状态无明显改变。存活率测定(0.4%台盼蓝染液测定细胞拒染百分比)结果为80%。CD44流式细胞仪检测阳性率95.8%,而冻存前流式细胞仪检测阳性率为94.5%,实验结果采用两样本率等效χ2检验,实验结果经SPSS18.0处理,χ2=54.913,P<0.01,差异有统计学意义,可认为冻存前检测结果与冻存后检验结果一致,即冻存前后CD44阳性表达率无差别。CD29流式细胞仪检测阳性率为99.5%,而冻存前流式细胞仪检测阳性率为99.3%。实验结果采用两样本率等效χ2检验,实验结果经SPSS18.0处理,χ2=11.577,P<0.01,差异有统计学意义,可认为冻存前检测结果与冻存后检验结果一致,即冻存前后CD29阳性表达率无差别。培养3 d后传代,其增殖能力与冻存前相比,无明显改变。总之,经适当冻存的脂肪干细胞生长能力、增殖能力与冻存前一致,这与文献研究一致[12-14]。CD44、CD29表面标识表达阳性率也无差别。因此,经适当冻存的脂肪干细胞可以用于进一步的实验研究。
总之,本实验证实在大鼠腹股沟脂肪组织中含有大量可为细胞移植所用的种子细胞,确立一种经济简便的实验室分离培养及保存ADMSCs的方法,为以后ADMSCs的大量扩增及进一步研究奠定了实验基础。
[1]项 飞, 鑫,黄 悦,等.大鼠急性心肌梗死的组织病理学变化及干细胞治疗[J].江苏医药,2008,34(5):481-483.
[2]张 雯,陈香宇,何巧玉,等.经不同方式移植骨髓间充质干细胞治疗肝纤维化的疗效[J].实用医学杂志,2013,29(6):889-891.
[3]胡振顺,杨新明,王耀一,等.以带蒂筋膜瓣为膜引导骨再生屏障膜包裹接种自体骨髓间充质干细胞的非细胞型组织工程促进骨缺损修复的研究[J].2012,28(4):555-557.
[4]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell based therapies[J].Tissue Eng, 2001,7:211-228.
[5]邹雅琴,张培华.体外扩增和纯化脂肪干细胞应用于自体脂肪移植的研究进展[J].医学综述,2012,18(22):3754-3756.
[6]李 义.脂肪干细胞的在整形美容外科的应用[J].医学美学美容:中旬刊,2013,22(4):65-66.
[7]周紫微,赵 宇.脂肪干细胞研究进展与应用前景[J].安徽医科大学学报,2013,48(7):846-849.
[8]王兆杰.软骨组织工程中脂肪来源的多能干细胞的研究进展[J].西部医学,2009,21(8):1257-1259.
[9]吴海涛.脂肪干细胞研究进展[J].卫生职业教育,2012,30(24): 157-159.
[10]金 杰,虞渝生.脂肪细胞研究进展[J].浙江医学,2009,30(1): 101-103.
[11]雷蕙嘉,孙建军,彭本刚,等.大鼠脂肪干细胞的分离培养及鉴定的初步研究[J].中国实验诊断学,2011,15(8):1245-1248.
[12]张 亚,王晓东,冯 林,等.大鼠脂肪组织来源的干细胞向软骨细胞诱导[J].江苏医药,2007,33(12):1239-1241.
[13]樊 艳,张卫泽,陈永清,等.成人脂肪间充质干细胞冻存前后的生物学特性[J].中国组织工程研究与临床康复,2008,12(25):4882-4886.
[14]刘广鹏,李宇琳,孙 剑,等.低温冻存对人脂肪来源干细胞成骨能力影响的实验研究[J].干细胞与组织工程,2010,24(10):1224-1227.
Isolation,cultivation,identify and cryopreservation of mesenchymal stem cells from rat adipose tissue in vitro.
LV Chun-yan1,CHEN Gao-li2,YANG Ling2,CHEN Chang-jin3,YUAN Hui3,YANG Xue-mei3.
1.Department of Pathology,the Fifth People's Hospital of Chengdu,Chengdu 611130,Sichuan,CHINA;2.Department of Laboratory, Affiliated Hospital to Chengdu University of Traditional Chinese Medicine,Chengdu 610072,Sichuan,CHINA;3.Central Laboratory,Affiliated Hospital to Chengdu University of Traditional Chinese Medicine,Chengdu 610072,Sichuan,CHINA
ObjectiveTo search a method for isolation,cultivation,identification and cryopreservation of mesenchymal stem cells from rat adipose tissue in vitro.Method Three rats was anaesthetized and disinfected conventionally,their inguinal adipose tissue were taken and sheared to paste.The fragments were digested by collagenase typeⅠ,suspended by DMEM,and planted in culture dish.Then the cells were cultured in incubator culture.Their first medium change happen after 24~48 hours,then the change occur 2~3 days once again,after 5~7 days and 80%cell fusion,cells were digested by Trypsin and passaged by EDTA.Cell microscopy was used to morphological observation and the third generation was used to identify by flow cytometric cell cycle.ResultsRats fat had a large amount of adipose-derived mesenchymal stem cells(ADMSCs).The shape of primary culturedASCs was a star or much horn;after passage of the ASCs relatively uniform shape,fusiform shape,spiral growth.The ASCs surface markers are identified by flow cytometry and showed positive expression of CD44,CD106.Cryopreserved ASCs remains a good activity, high survival rate.Conclusion A simple and convenient method was successfully established to isolate,culture and store the adipose tissue derived mesenchymal stem cells,which provides the foundation for the future use of ADMSCs in the further research.
Adipose-derived stem cells;Cell culture;Surface marker;Identification;Cryopreservation
R-332
A
1003—6350(2014)09—1256—04
2013-11-13)