去铁胺对促进扩张后皮瓣微循环重建的实验研究
2014-05-05王春梅杨思奋代大毛
徐 伟,王春梅,杨思奋,代大毛
(东莞市康华医院整形美容中心,广东 东莞 523000)
去铁胺对促进扩张后皮瓣微循环重建的实验研究
徐 伟,王春梅,杨思奋,代大毛
(东莞市康华医院整形美容中心,广东 东莞 523000)
目的探讨去铁胺(Defemxamine,DFX)对扩张后皮瓣微循环重建的影响。方法将新西兰大耳白兔24只分成实验组和对照组,兔额部皮下植入圆柱形扩张器,制备蒂部位于耳根的矩形皮瓣,实验组分别于模型制备后即刻、第3天、第5天将DFX注射于皮瓣末端,对照组皮下注射等量的生理盐水,第7天分别进行皮瓣平均微血管数目及内径、皮瓣组织中超氧化物歧化酶(MDA)、丙二醛(SOD)含量及血管内皮生长因子(VEGF)mRNA检测。结果实验组皮瓣SOD含量、VEGF mRNA表达高于对照组(P<0.05),平均微血管数目多于对照组(P<0.05),平均微血管内径及MDA含量小于对照组(P<0.05)。结论在扩张皮瓣的局部注射DFX,可以降低自由基水平,加快新生血管形成并促进皮瓣微循环重建。
去铁胺;扩张皮瓣;丙二醛;超氧化物歧化酶;血管内皮生长因子
皮瓣移植在组织缺损修复和功能重建上发挥着不可替代的作用,适度的扩张后可以增强皮瓣的活力,但临床上也常发生扩张术后Ⅱ期手术形成皮瓣(简称扩张皮瓣)时出现微循环重建障碍甚至坏死,影响治疗效果,供血不足和缺血再灌流损是其中的两个重要原因。去铁胺(DFX)是一种铁螫合剂,近年被发现具有清除氧自由基和激活缺氧反应基因等作用[1-2],我们实验通过将DFX皮瓣局部注射,观察其对于扩张皮瓣微循环重建的影响。
1 材料与方法
1.1 动物模型制备及分组 新西兰大白兔24只,雌雄不限,体重2.5~3.0 kg(南方医科大学动物中心提供),氯胺酮(0.6 ml/kg体重)麻醉后取俯卧位,额部皮下潜行分离一腔,置入30 ml圆柱形皮肤软组织扩张器,壶阀置于双耳根间的皮下。术后第2天起,隔日向扩张器内注入生理盐水5 ml,第14天取出扩张器,制备蒂部位于耳根,大小约为3 cm×5 cm的矩形皮瓣后原位缝回。模型制备后,将大白兔随机分为两组,每组12只,实验组:分别于模型制备后即刻、第3天、第5天将DFX 100 mg/kg(根据前期的实验确定为有效剂量)注射于距皮瓣末端1 cm和3 cm处达皮下层,对照组皮下注射等量的生理盐水。
1.2 皮瓣相关指标的检测
1.2.1 平均微血管数目及内径 矩形皮瓣形成后第7天于皮瓣远端组织2.0 cm处取约0.5 cm×1.0 cm大小的全层组织,对半均分,一半用于测定MDA、SOD。将组织10%甲醛固定,常规石蜡包埋,HE染色,在10×40高倍镜下随机选取5个视野,通过医学图文数字系统软件计数微血管数目,所计数血管中必须有红细胞,并同时测量管径大小,各组计算平均数。
1.2.2 测定皮瓣组织中MDA、SOD的含量 将取出的另一半皮瓣组织称重,加9倍重的冰生理盐水,用超声匀浆机制成10%匀浆液。各取匀浆液0.1 ml, SOD活性(黄嘌呤氧化酶法)及丙二醛含量(硫代巴比妥酸比色法)测定均按试剂盒方法测定。MDA单位以nmol/10 mg湿重表示,SOD活性换算成nmol/mg湿重表示。
1.2.3 血管内皮生长因子(VEGF)mRNA检测 各取10%组织匀浆液0.1 ml,Trizol提取总RNA,并逆转录为cDNA用于PCR扩增。VEGF引物序列:上游引物:5'-CAC TGG ACC CTG GCT TTA CT-3',下游5'-TGC TGG CTT TGG TGA GGT T-3',扩增产物320 bp;内参GAPDH引物:上游:5'-TTA CTT GGA GGC CAT GTG GGC C-3',下游:5'-ACT GCC ACC CAG AAG ACT GTG GAT GG-3',扩增产物463 bp,PCR产物于1%琼脂糖凝胶电泳,电泳结束后,以凝胶成像分析仪分析各条带灰度值。各个反应体系以GAPDH为内参照,计算灰度比值作为VEGF mRNA的表达值。
1.3 统计学方法 采用SPSS13.0软件包进行统计学处理。计量资料以均数±标准差()表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组平均皮瓣成活率、微血管数目、微血管内径比较 实验组皮瓣平均成活率显著高于对照组(P<0.05),平均微血管数目多于对照组(P<0.05),平均微血管内径小于对照组(P<0.05),实验组微血管丰富,多为管径较小新生血管;对照组微血管较少,多为管径较大固有血管。见图1、表1。
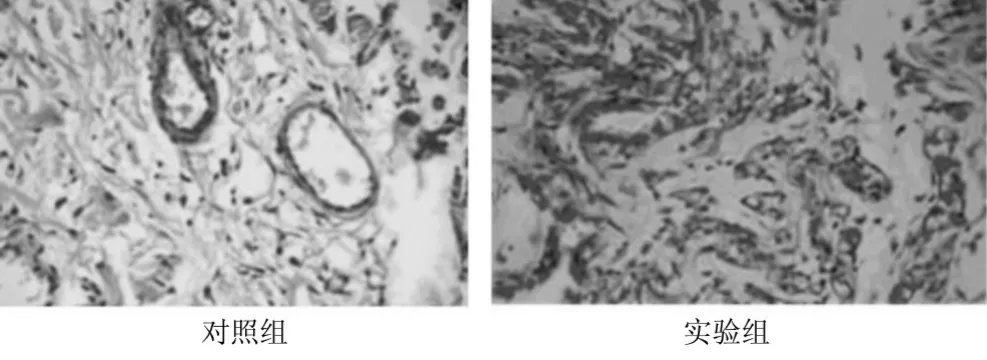
图1 术后7 d皮瓣组织学观察(×400倍)
表1 两组微血管数目、微血管内径、MDA和SOD含量VEGF-mRNA表达的比较(n=12,)

表1 两组微血管数目、微血管内径、MDA和SOD含量VEGF-mRNA表达的比较(n=12,)
组别实验组对照组t值P值平均微血管数目(个) 30.81±2.53 10.40±1.72 4.270 0.005平均微血管内径(mm) 22.58±4.36 113.20±19.87 1.084 0.000 MDA含量(nmol/10 mg) 3.83±0.47 6.13±0.83 0.393 0.001 SOD含量(nmol/mg) 311±65.87 224±27.12 1.097 0.003 VEGF-mRNA表达1.15±0.16 0.51±0.12 0.425 0.000
2.2 各组皮瓣组织中MDA、SOD的含量 术后7 d,实验组MDA含量低于对照组(P<0.05),SOD含量明显高于对照组(P<0.05),见表1。
2.3 各组皮瓣组织中VEGF mRNA的表达 电泳后各泳道均可见特异性条带,与DNA标记进行比较,产物大小与预期一致,实验组VEGF mRNA表达明显高于对照组(P<0.05),见图2。

图2 术后7 d皮瓣VEGF mRNA表达
3 讨 论
近年来的研究证实,氧自由基是皮瓣缺血/再灌损伤中的主要介质[3]。在缺血缺氧的过程中,首先产生的氧自由基为过氧化氢和超氧阴离子,这些氧自由基在水溶液中的毒性不太大,对组织损伤轻。然而,在有铁离子存在时,上述氧自由基可转化成为羟自由基和其他反应性铁一氧复合物等毒性较大的氧自由基,容易导致细胞膜的脂质过氧化反应,产生脂质过氧化物,如丙二醛(MDA)、酮基、氢过氧基以及新的氧自由基等,且损伤程度与局部铁离子浓度成正比。氧自由基不但通过对生物膜中多不饱和脂肪酸的过氧化作用引起细胞损伤,而且还能通过脂质过氧化分解代谢产物MDA,促使蛋白质交联聚合反应引起细胞代谢和功能障碍,甚至细胞死亡[4]。在本实验中,通过测定MDA含量来反映过氧化脂质,间接地反映氧自由基的产生情况。SOD是存在于体内的一种重要的氧自由基清除剂,SOD活性可反映机体清除氧自由基的能力。我们观察到,应用DFX后,皮瓣组织MDA含量明显降低,SOD升高,说明DFX能降低组织中自由基水平,增强抗氧化能力,从而有利于皮瓣远端缺血细胞,特别是存活与坏死交界区域的“临界”向存活的方向转化。这可能是因为DFX对游离铁离子的螯合作用有利于减少由铁离子参与的自由基产生,减轻了自由基对缺氧细胞的进一步损害[1]。
扩张皮瓣微循环重建与新生血管形成有关,而新生血管形成与VEGF有密切联系。实验证明,内源性VEGF对皮瓣的成活起重要作用[5]。VEGF是目前发现的最重要的血管生长因子之一,是内皮细胞特异的强效有丝分裂原,与内皮细胞上相应的受体结合,引起新的内皮细胞增殖、分化并形成管腔样结构;同时促内皮细胞产生并调节纤维蛋白溶酶原的激活因子和抑制因子,在血管生成中对基底膜细胞基质的降解具有重要作用;此外还可以增加血管通透性,使内皮细胞接受刺激因子的作用增加,同时血浆外渗,形成血管生成的临时基质,有利于血管生成,被认为是血管生成的先决条件[6]。我们发现,实验组新生血管增生显著并与VEGF表达上调一致,提示DFX通过诱导VEGF的表达而促进新生血管形成,这与Langlois等[7]的研究结果一致。诱导缺氧因子(HIF-1)是缺氧反应信号通路的调控因子,由HIF-lα和HIF-1β两个亚基组成。HIF-lα既是HIF-1调节亚基又是活性亚基,缺氧能促进HIF-lα表达上调,上调的HIF-lα和HIF-1β结合成HIF-1,HIF-1通过作用于靶基因的缺氧反应元件调控VEGF等靶基因的表达,在缺氧缺血性组织损伤后的血管生成方面发挥重要作用。DFX在缺氧条件下能,诱导HIF-1基因表达,增加HIF-1与DNA结合活性,促进HIF-1α表达,从而上调VEGF的表达,促进新生血管的形成[8-9]。
DFX用于临床多年,是一种比较安全有效的药物,但作用于皮瓣的研究较少,本实验发现在扩张皮瓣局部注射DFX,可以降低自由基水平,加快新生血管形成促进皮瓣微循环重建,从而增加皮瓣存活率,但其最佳作用时间、剂量及分子机制上还有待进一步研究。
[1]Moridani MY,Pourahmad J,Bui H,et al.Dietary flavonoid iron complexes as cytoprotective superoxide radical scavengers[J]. Free Radic Biol Med,2003,34(2):243-253.
[2]Hamrick SE,McQuillen PS,Jiang X.A role for hypoxia-inducible factor-1 alpha in desferoxamine neuroprotection[J].Neurosci Lett, 2005,379(2):96-100.
[3]Prada FS,Arrunategui G,Alves MC,et al.Effect of allopurinol,superoxide-dismutase,and hyperbaric oxygen on flap survival[J].Micro Surgery,2002,22(8):352-360.
[4]陈 暖,周 玫.自由基医学[M].北京:人民卫生出版社,1993: 13-54,142-145.
[5]韩雪峰,李健宁,杨大平,等.跨区供血皮瓣成活过程中血管构筑及内源性VEGF变化的实验研究[J].中国美容医学,2008,17(2):232-234.
[6]Huang N,Khan A,Ashrafpour H,et al.Efficacy and mechanism of adenovirus-mediated VEGF-165 gene therapy for augmentation of skin flap viability[J].Am J Physiol Heart Circ Physiol,2006,291 (1):127-137.
[7]Langlois A,Bietiger W,Mandes K,et al.Overexpression of vascular endothelial growth factor in vitro using deferoxamine:a new drug to increase islet vascularization during transplantation[J]. Transplant Proc,2008,40(2):473-476.
[8]Hamrick SE,McQuillen PS,Jiang X.A role for hypoxia-inducible factor-1 alpha in desferoxam-ine neuroprotection[J].Neurosci Lett,2005,379(2):96-100.
[9]Prass K,Ruscher K,Karsch M,et al.Desferrioxamine induces delayed tolerance against cerebral ischemia in vivo and in vitro[J].J Cereb Blood Flow Metab,2002,22(5):520-525.
Experimental study on promoting reconstruction of microcirculation of expanded skin flap with defemxamine.
XU Wei,WANG Chun-mei,YANG Si-fen,DAI Da-mao.
Center of Plastic and Cosmetic Kanghua Hospital of Dongguan, Dongguan 523000,Guangdong,CHINA
Objective To investigate the effects of Deferoxamine(DFX)on the reconstruction of microcirculation of expanded skin flap.MethodsA total of 24 rabbits were divided r andomly into experimental groups and control group.The cylindrical expander was implanted into frontal subcutaneous of the rabbits and rectangular pedicle skin flap was prepared.In the experimental group,the end of the flap was injected with DFX(100 mg/kg)immediately,3rdand 5thdays respectively after the model of preparation;The same dose of normal saline was injected in the control group.On day 7,the mircrovessels was evaluated under the microscope,activity of superoxide dismutase(SOD),content of malondialdehyde(MDA)and VEGF mRNA expression were measured.Result Compared with the control group,SOD activity and Vascular endothelial cell growth factor(VEGF)mRNA expression rised,microvascular density increased(P<0.05),MDA content and microvascular diamete decreased in the experimental groups(P<0.05). Conclusion DFX can reduce oxygen free radicals level and accelerate angiogenesis to promote reconstruction of microcirculation of expanded skin flap.
Defemxamine;Expanded skin flap;Malondialdehyde;Superoxide dismutase;Vascular endothelial cell growth factor
R-332
A
1003—6350(2014)09—1259—03
10.3969/j.issn.1003-6350.2014.09.0489
2014-02-20)
东莞市科技局科研立项(编号:20121051059233)
徐 伟。E-mail:xuwei10086@163.com