电针对兔膝骨关节炎家兔模型软骨细胞凋亡的影响*
2014-05-05彭支莲韦桂勇袁海洲
彭支莲 黄 剑 韦桂勇 肖 龙 袁海洲
(1.重庆市九龙坡区中医院,重庆 400080;2.重庆医科大学中医药学院,重庆 400016)
电针对兔膝骨关节炎家兔模型软骨细胞凋亡的影响*
彭支莲1黄 剑2△韦桂勇2肖 龙2袁海洲2
(1.重庆市九龙坡区中医院,重庆 400080;2.重庆医科大学中医药学院,重庆 400016)
目的观察电针对兔膝骨关节炎家兔模型软骨细胞凋亡的影响。方法40只新西兰大白兔随机分成空白对照组、模型组、电针组和西药组。除空白对照组外,各组动物采用左后肢膝关节伸直位石膏固定7周建立膝骨关节炎动物模型。造模成功后,电针组取左后肢梁丘、血海、阳陵泉、足三里和内外膝眼6个穴位,用毫针斜刺或直刺得气后,进行电针操作,连续治疗3周;西药组灌服氨基葡萄糖胶囊,治疗3周。处理前后,对各组家兔膝关节滑膜和软骨标本,进行HE染色、免疫组化法染色观察膝关节滑膜和软骨的病理变化;采用TUNEL法检测软骨细胞凋亡并计算凋亡指数(AI)。结果经治疗后,电针组和西药组关节软骨细胞凋亡、凋亡指数与模型组比较明显降低(P<0.05)。结论电针能改善膝骨关节炎家兔模型软骨细胞的过度凋亡,降低膝骨关节炎软骨细胞的凋亡率。
电针 膝骨关节炎 软骨细胞 凋亡
膝关节骨性关节炎(KOA)是由于关节滑膜退变,软骨破坏引起,以膝关节疼痛、僵硬和活动受限为特征,为临床常见病。随着年龄的增长和人口老龄化的趋势,KOA的发病逐年增高,对本病的研究和治疗近年来引起临床医师的重视。针灸(针刺、温针、电针等)治疗KOA早期、中期膝骨关节炎有较好疗效,但缺乏临床数据资料,尤其缺少对针灸治疗KOA的机理研究资料。现报告如下。
1 材料与方法
1.1 实验动物及分组 新西兰雄性大白兔40只,体质量2.0~2.5 kg,由重庆医科大学实验动物中心提供,实验动物生产许可证号为:SYXK(渝)2012-0001。随机将动物分为空白对照组、模型组、电针组和西药组,每组10只。
1.2 实验仪器及试剂 BX40型光学显微镜,BX51型倒置显微镜(日本OLYMPUS公司)。电针仪(SDZ-Ⅱ型华佗牌6805-β)。TUNEL试剂盒,购于美国Roche公司。
1.3 建立动物模型 实验动物同等条件下稳定饲养7 d后,将40只新西兰大白兔随机选取30只兔子按照膝关节石膏制动法造模[1]。造模成功,拆去石膏外固定。
1.4 电针方法 造模成功后,参照《实验针灸学》[2]和《实验动物针灸手册》[3],将电针组动物选取梁丘、血海、阳陵泉、足三里和内外膝眼6个穴位。常规酒精消毒后,用1寸毫针直刺或斜刺5~15 mm,待针下出现得气感后,选取4个两组穴位接电针治疗仪,疏密波,频率2~100 Hz,以局部皮肤肌肉轻微颤动为度,每次留针25 min,每日1次,连续治疗3周。西药组灌服氨基葡萄糖胶囊,每日 90 mg/kg,共3周[4];空白对照组和模型组正常饲养,不做干预。
1.5 标本采集 造模7周后,从空白对照组和造模组动物中随机分别取出1只和3只兔处死,解剖兔膝关节取出滑膜和软骨标本,作病理检测,观察动物造模情况。治疗结束后,处死各组动物,采集兔膝关节滑膜,胫骨平台内侧关节面的完整软骨及软骨下骨组织标本,用10%的甲醛溶液固定,常规切片,HE染色作病理检测,其余软骨切片作软骨细胞凋亡检测。
1.6 软骨细胞凋亡测定 治疗结束后处死各组动物,解剖左侧膝关节,用锐刀片切1 cm×1 cm取股骨内髁全层软骨标本,置于10%多聚甲醛固定48 h后,常规切片,厚度为5 μm,置于40℃水浴展片,捞片后于60℃烘箱中烘片2 h以使切片紧密黏附,按照试剂盒说明,采用原位末端标记法(TUNEL)测定软骨细胞凋亡。阳性判定:细胞核为棕黄色颗粒.每张切片随机选取5个视野,计数阳性细胞和总细胞数,细胞凋亡指数(AI)=TUNEL标记阳性细胞数/软骨细胞数×100%。
1.7 统计学处理 应用SPSS16.0统计软件。计量资料以(±s)表示,组间差异采用方差分析(ANOVA),行F检验及Q检验。P<0.05为差异有统计学意义。
2 结果
2.1 HE染色光镜下观察兔膝关节滑膜与软骨病理变化 见图1~图5。7周后,从未造模和造模动物中随机分别取出1只和3只兔处死,解剖兔膝关节取出滑膜和软骨标本。采用HE染色,常规病理切片,观察发现未造模动物膝关节滑膜无增厚(图1),软骨细胞排列均匀,无增生,软骨边缘光滑,层次清楚(图2)。造模动物膝关节滑膜增厚(图3),软骨细胞排列不均,边缘破坏,粗造不平(图4)。治疗结束后,处死各组动物,采集膝关节软骨标本,HE染色,光镜下见空白对照组膝关节软骨细胞排列均匀,无增生,软骨边缘光滑,层次清楚,模型组动物膝关节表面细胞排列不均,边缘破坏明显,软骨细胞增生较少;电针组和西药组动物膝关节软骨表面较光滑,边缘破坏较轻,有大量软骨细胞增生(图 5)。
2.2 TUNEL法检测软骨细胞凋亡 见图6。切片显示,空白对照组软骨细胞很少见到TUNEL标记阳性细胞,各时间段均未检出兔膝关节软骨细胞的异常凋亡。造模7周后,造模动物关节软骨各层可见大量棕黄色TUNEL标记阳性细胞,软骨细胞均过度凋亡。治疗结束后,造模组动物TUNEL标记阳性细胞明显增加,软骨细胞过度凋亡;电针组动物软骨细胞凋亡较治疗前减少,TUNEL标记阳性细胞与模型组差异有统计学意义(P<0.05);西药组动物软骨细胞凋亡较处理前减少,与电针组差异无统计学意义(P>0.05)。

图1 (HE,×400)
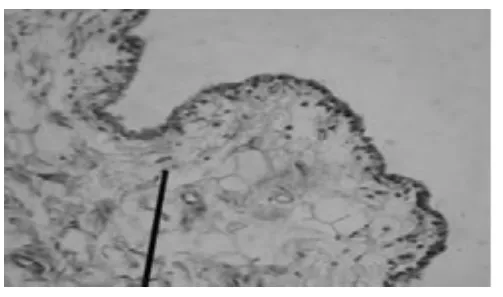
图2 (HE,×400)
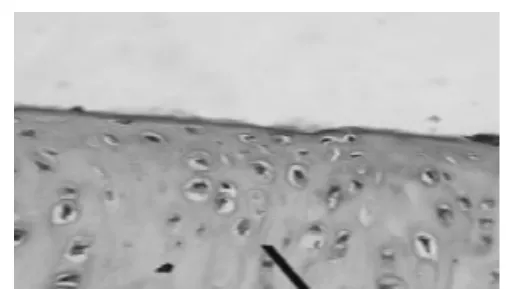
图3 (HE,×400)

图4 (HE,×400)
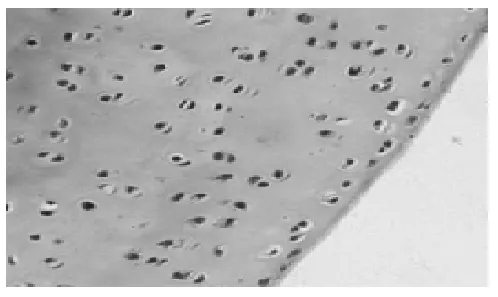
图5对照组 (HE,×400)
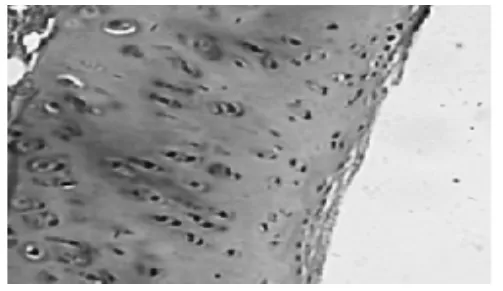
图5模型组(HE,×400)
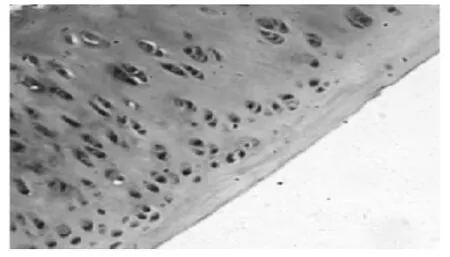
图5 电针组(HE,×400)
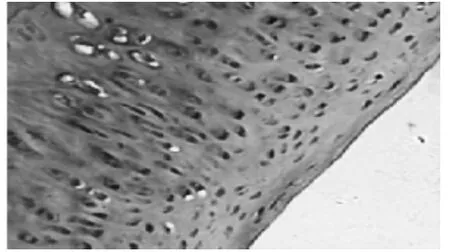
图5西药组(HE,×400)
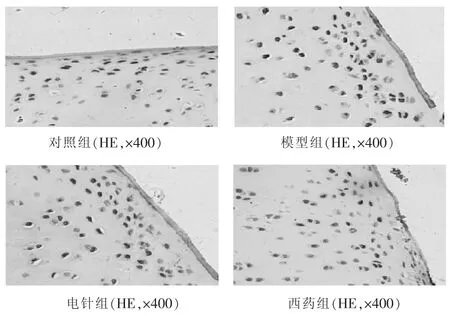
图6 空白对照组动物软骨细胞TUNEL标记阳性细胞较少,散在分布于浅中层。模型组软骨细胞TUNEL标记阳性细胞明显增多,浅中深层均有较多表达。
2.3 各组动物软骨细胞凋亡指数 见表1。治疗结束后,取各组动物软骨标本,采用原位末端标记法(TUNEL)测定软骨细胞凋亡。每张切片随机选取5个视野,计数阳性细胞和总细胞数,细胞凋亡指数(AI)= TUNEL标记阳性细胞数/软骨细胞数×100%。
3 讨论
表1 各组TUNEL法检测软骨细胞凋亡指数(%,±s)

表1 各组TUNEL法检测软骨细胞凋亡指数(%,±s)
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与治疗前比较,#P<0.05。
组 别 n 治疗前 治疗后对照组 10 3.12±0.342 3.06±0.356模型组 10 4.27±0.401* 4.69±0.528*电针组 10 4.27±0.401* 3.81±0.390△#西药组 10 4.27±0.401* 3.92+0.319△#
凋亡又称为程序性死亡,是指多细胞生物体有核细胞在基因控制下,遵循自身程序而发生的自然死亡过程,以清除无功能的细胞、受损害的细胞或衰老细胞,从而维持机体内外环境稳定。早期研究表明,骨关节炎(OA)患者关节软骨的软骨细胞数少于正常关节软骨的软骨细胞数,部分软骨细胞发生死亡,进一步研究表明 OA时软骨细胞死亡的主要方式是凋亡[5]。Blanco等人通过透射电镜,流式细胞仪技术及TUNEL法对正常人及OA患者关节软骨进行研究,证实了与正常人的软骨相比,OA患者软骨的软骨细胞凋亡明显增多(51%),且凋亡细胞主要位于软骨表层和中层[6]。凋亡的软骨细胞区域蛋白多糖降解明显,软骨细胞凋亡的数量与软骨基质的降解程度相关,提示凋亡细胞数目与OA严重程度是相关的[7]。这些研究表明软骨细胞凋亡在骨关节炎发病中有重要作用,为抑制软骨细胞凋亡作为治疗手段提供了依据。
骨关节炎属于中医学“痹证”、“痿证”范畴。膝骨关节炎多发于中老年人,中医学认为中老年人气血不足、阴阳失衡、脏腑亏虚,气虚血瘀、阳虚寒湿停聚膝关节,致筋脉拘急,关节屈伸不利,骨骼变形,形成骨痹。本病病位在肝、肾、筋、骨,病性为本虚标实,虚实夹杂;病机为肝肾亏虚,痰瘀阻络,筋骨失养。中医学认为膝骨关节炎的发病是肝、脾、肾亏虚,风、寒、湿及瘀血阻于局部,致经络痹阻不通而发疼痛,为本虚标实之证。针灸治疗膝骨关节炎的方法主要有针刺、温针及电针。取穴原则以局部和经络辨证取穴为主。临床上患者常因膝痛发作而就诊,故疾病多为邪盛标实,寒湿盛为主要矛盾,因此临床辨证为寒湿证者较多[8]。故临床取穴多以足太阴脾经和足阳明胃经腧穴为主,较少取足厥阴肝经和足少阴肾经等穴。筋会阳陵,膝为筋府,故阳陵泉善治膝病。血海属足太阴脾经穴,具有活血化瘀之效,与阳陵泉配伍有舒筋活血、通络止痛的作用,主治膝关节痛。阳明经为多气多血之经,有主润宗筋,主束骨而利关节的作用。足三里为足阳明经合穴,具有补益肝肾、濡润宗筋、温经散寒止痛之功,主治下肢痿弱不收,是治疗下肢痿痹的要穴。梁丘为足阳明经郄穴,具有舒筋活络的功效,与阳陵泉配伍主治膝关节痛、筋挛和膝关节屈伸不利。梁丘与足三里配伍加温针灸,可达温经通脉、散寒除湿、活血止痛、扶正祛邪、标本兼治之功。电针足三里穴可使血行风灭,筋脉得养,宗筋复健,关节流利。本实验中,兔骨关节炎模型给予电针干预后,该组动物软骨细胞的凋亡率下降,这可能是电针抑制软骨细胞凋亡的机制之一,有关电针抑制软骨细胞凋亡的确切机制,还有待进一步探讨。
[1]王和鸣,丁建中,周临东,等.骨伤科基础研究[M].北京:北京科学技术出版社,2005:369-372.
[2]李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:314.
[3]胡元亮.实验动物针灸手册[M].北京:中国农业出版社,2003:288.
[4]牟方政,李荣亨,张文亮,等.复元胶囊对衰老性骨关节炎模型兔血清氧自由基代谢及血液流变学的影响[J].中国老年学杂志,2010,30(12):3679-3682.
[5]江中潮,何洪阳,刘罡,等.骨生注射液对实验性骨性关节炎家兔血浆SOD和MDA的影响[J].中医正骨,2004,17(10):593-595.
[6]Heraud F,Heraud A,Harmand M,et al.Apoptosis in normal and osteoarthritic human articular[J].Ann Rheum Dis,2000,59(12):959-965.
[7]Blanco FJ,Guitian R,Vazquez-Martul E,et al.Osteoarthritis chondrocytes die by apaptosis.A possible pathway for osteoarthritis pathology[J].Arthritis Rheum,1998,41(2):284-289.
[8]Chen MH,Wang JL,Wong CY,et al.Relationship of chondrocyte apaptosis to matrix degradation and swelling potential of osteoarthritic cartilage[J].2005,104(4):264-272.
[9]杨锦华,刘向前.针灸治疗膝关节骨关节炎取穴研究近况[J].湖南中医杂志,2003,19(6):60-61.
Effects of Electroacupuncture(EA)on Chondrocyte Apoptosis in Rabbit Model with Knee Osteoarthritis
PEN Zhilian,HUANG Jian,WEI Guiyong,et al.TCM Hospital of Jiulongpo District,Chongqing 400080,China
Objective:To study the effects of electroacupuncture(EA)on chondrocyte apoptosis in rabbit model with Knee Osteoarthritis(KOA).Methods:A total of 40 New Zealand rabbits were randomly divided into control,model,EA and western medicine groups.KOA model was established by gypsum fixing method.EA was applied to left"Liangqiu"(ST 34),"Xuehai"(SP 10),"Yanglingquan"(GB-34),"Zusanli"(ST 36)and"Xiyan"(EX-LE 5)for 25 min,once daily and continuously for 3 weeks.Western medicine groups was fed with Glucosamine capsule 90 mg/(kg·d)for 3 weeks.The cartilage specimen was collected to detect chondrocyte apoptosis by TUNEL.Results:After treatment,levels of chondrocyte apoptosis in EA and western medicine groups decreased considerably compared with model group,and there was obvious(P<0.05).Conclusions:The electroacupuncture can effectively improve excessive chondrocyte apoptosis in rabbits with KOA and decrease the rate of chondrocyte apoptosis.
Electroacupuncture;Knee Osteoarthritis;Chondrocyte;Apoptosis
R245.9+7
A
1004-745X(2014)08-1428-03
10.3969/j.issn.1004-745X.2014.08.013
2014-03-17)
重庆市卫生局中医药科技项目;重庆市九龙坡区科委项目(2012-32)
△通信作者
