脐带间充质干细胞移植对慢性试验性肝损伤的治疗作用
2014-05-05赵钦军任红英池颖韩之波马凤霞陈芳卢士红韩忠朝
赵钦军 任红英 池颖 韩之波 马凤霞 陈芳 卢士红 韩忠朝
脐带间充质干细胞移植对慢性试验性肝损伤的治疗作用
赵钦军 任红英 池颖 韩之波 马凤霞 陈芳 卢士红 韩忠朝
目的观察脐带间充质干细胞(UC-MSC)对慢性实验性肝损伤的治疗作用并探讨其分子生物学机理。方法50只7周龄的NOD/SCID小鼠注射四氯化碳(CCL4)制备慢性肝损伤模型后,应用随机数字表的方法随机将实验小鼠随机分成2组:模型组(25只)和UC-MSC移植组(25只)。UC-MSC移植组通过尾静脉注射移植1×106UC-MSC,模型组注射同样体积的PBS。分别于移植后1、2、3和4周收集肝组织,应用免疫组织化学,RT-PCR 和Western blot的方法分析细胞移植前后肝组织的病理生理学特征的变化。采用t检验和方差分析进行统计学分析。结果UC-MSC移植治疗后肝组织表达人肝细胞特异性AFP,Alb,和内皮细胞特异性CD31,Flk-1。细胞移植4周后vWF标记的血管密度明显增加,同时伴有部分的肝功能改善,谷丙转氨酶(ALT)水平从(55.71±11.33) U/L减至(36.75±12.80) U/L(P< 0.05)。此外,本研究结果表明UC-MSC分泌几种重要的生长因子HGF,FGF-2,VEGF,和VEGF受体通过旁分泌的途径发挥肝组织修复的功能。结论在CCL4诱导的慢性肝损伤模型肝组织,人UC-MSC可以分化成肝细胞样细胞和内皮细胞样细胞,同时旁分泌多种细胞生长因子修复损伤的肝细胞,并伴有肝功能的改善。认为UCMSC移植或许成为将来肝脏损伤疾病一个重要的治疗选择。
脐带;间充质干细胞;肝损伤;肝细胞;细胞移植
目前,肝移植是唯一可以有效治疗终末期肝病的治疗方案,但是肝移植治疗终末期肝病存在器官供应严重短缺、费用昂贵,以及严重的免疫排斥等不足。但幸运的是基于干细胞再生医学的快速发展给终末期肝病患者带来了新的曙光。研究已经表明间充质干细胞(mesenchymal stem cell,MSC)能够体外分化为包括骨、软骨、脂肪、心肌、内皮和神经等的多种组织细胞[1-4]。此外,来源于骨髓组织(bone marrow,BM)[5-7],脂肪组织[8],胎盘[9],脐带[10]和脐带血[11]等多种组织MSC可以分化为肝细胞样细胞并且对终末期肝病有一定的治疗作用。但是,以前的研究表明从脐带血分离纯化MSC效率低,且很不稳定[12]。而脂肪组织和骨髓组织的MSC分离总是伴随着对供者的手术创伤,因为脐带间充质干细胞(umbilical cord mesenchymal stem cell,UC-MSC)的分离没有任何的机体创伤,没有伦理学障碍,且分离扩增效率非常高,因此,脐带已经成为了MSC临床前研究和临床应用最广泛最理想的组织来源。
CCL4等化学因素诱导的肝脏组织在肝细胞损伤的同时,伴有明显的肝窦内皮细胞的形态变化和功能的损伤,进而导致肝血窦通透性功能异常,肝窦毛细血管化和肝细胞缺氧[13-14]。肝脏血窦内皮细胞是一种独特的内皮细胞,包括结构和功能,不连续的肝血窦内皮细胞和血管与连续的内皮细胞的表型也是不同的,例如肝血窦内皮细胞不表达vWF,CD31并缺乏基底膜[15]。研究已经表明了MSC能够在缺血疾病如下肢缺血、缺血性心脏病和脑梗塞等模型中分化成表达CD31、vWF和Flk-1的内皮细胞并促进血管新生[16-17]。至今还没有骨髓,脂肪,脐带等组织来源的MSC能够在损伤的肝组织中分化为肝血窦内皮细胞的报道。更为有趣的是已有研究表明与BMSC相比UC-MSC更容易被诱导分化为内皮细胞进而有更强的血管新生的潜能[18]。本研究选择了UC-MSC作为目标细胞,通过观察UCMSC在肝损伤动物模型中分化为肝细胞和内皮细胞的潜能及相关生长因子的表达,探讨了UCMSC用于肝损伤疾病治疗的前景。
材料与方法
一、材料
1.动物与分组:应用随机数字表进行随机分组实验动物的分组。主要标准是7周龄雌性小鼠体重为17~19 g,雄性小鼠体重18~22 g的动物均可入组。
2、UC-MSC分离和培养:在征得产妇同意后,健康的足月剖腹产胎儿的脐带组织无菌运输到实验室,按照[19]描述的处理脐带组织并分离了UC-MSC。本研究也检测了UC-MSC(第5~10代)的细胞表型和体外向间质组织包括骨和脂肪组织细胞的分化潜能[19]。
二、方法
1.PCR反应:从培养的UC-MSC和小鼠的肝脏组织提取总RNA,进行mRNA的逆转录和cDNA的扩增,PCR扩增按照以下程序进行:94℃变性40 s,58℃退火40 s,72℃延伸40 s,共30个循环,并加最后一个72℃延伸7 min,应用 Gene-Amp PCR System 2700(Applied Biosystems)PCR仪扩增cDNA。几种生长因子和受体的引物相关信息见表1,β-actin基因被作为内参对照,其引物序列为:5'-AGCGGGAAATC GTGCGTGAC-3'和5'-ATTTGCGGTGGACGAT GGAGGG-3'(526 bp)。紧接着,PCR产物被在含有EB的1﹪或2﹪琼脂糖胶进行了电泳。
2.UC-MSC细胞移植:慢性肝损伤模型按照以前文献报道的方案制备[10]。CCL4处理小鼠4周后的第2天,移植1×106UC-MSC进行细胞移植治疗,或者相同体积的PBS作为阴性对照,细胞注射后继续给小鼠一周注射2次同样剂量的CCL4以维持持续的肝损伤压力。分别在细胞移植1,2,3和4周后处死小鼠,分离肝脏组织固定并保存。
3.实时定量PCR实验:小鼠和人共同的VEGF的引物序列如下:5'-CCGAA CCATGAACTTTCTGA-3'和 5'-CCATTC ATGGGACTTCTGCTC-3'(121 bp)。β-actin的引物是5'-CAGAGCAAGAGAGGCATCC-3'和5'-CTGGGGTGTTGAAGGTCTC-3'(217 bp)。应用的实时定量PCR仪为ABI 7500(Applied Biosystems),应用的检测系统是QuantiTect SYBR green PCR KIT 204143(Qiagen),PCR扩增过程按照供应商的使用说明进行如下:第一步95℃变性15 min,第二步94℃变性15 s,60℃退火30 s,72℃延伸34 s,共反应40个循环。肝脏组织分别来源于UC-MSC移植和对照组小鼠,每个标本至少重复3次反应。
4.组织免疫学检测:处死小鼠取出肝脏组织后,将肝脏组织固定在4﹪多聚甲醛中,石蜡包埋后切成4 μm的连续切片,部分组织切片进行了HE染色。经过封闭处理后,肝组织用下列第一抗体进行了孵育:抗人特异性兔源白蛋白(1:100;Dako)和AFP (1:100;NeoMarkers),抗人鼠特异性兔源VEGF (1:200)和羊源CD31和vWF(1:100)(均购自Santa Cruz Biotechnology)。紧接着应用一个生物素链接的第二抗体进行孵育后应用DAB法进行显色并进行苏木素复染后在显微镜下观察。肝组织血管密度检测通过计数vWF染色阳性的连续10张切片的均数。
5.冻存组织的免疫荧光分析:新鲜分离的肝脏组织包埋在OCT复合物中后冻存于液氮中保存。切成6 μm左右的冰冻肝脏组织切片后冷丙酮中固定10 min并应用10﹪羊血清孵育封闭30 min后,应用抗人CD31单克隆抗体和抗人CD31、Flk-1和VEGF多克隆抗体(均购自Santa Cruz Biotechnology,1:100稀释于含有1﹪BSA的PBS中)在4℃孵育16 h,阴性对照应用含有1﹪BSA的PBS代替第一抗体进行孵育,第二抗体孵育后应用共聚焦荧光显微镜观察(TCS SP2;Leica,Japan)。
6.Western blot分析:为了定量肝脏组织内皮细胞标志物的表达,本研究进行了Western blot分析。蛋白提取和Western blot分析参考文献进行(20),20 μg的组织裂解液应用10﹪SDS-PAGE电泳分离后,转移到PVDF膜上后应用5﹪BSA封闭,应用第一抗体抗CD31和vWF多克隆抗体和抗β-actin单克隆抗体(Santa Cruz Biotechnology)进行1:200稀释后4℃过夜孵育,再应用HRP链接的第二抗体(1:2500;Santa Cruz Biotechnology)孵育后,应用Pierce ECL kit(Amersham Bioscience,Piscataway,NJ,USA)显色,并应用图像分析软件(Quantity One;Bio-Rad)进行蛋白质条带的定量分析。
7.肝功能分析:定期收集血液标本,2400×g离心20 min后收集血清,应用自动生化分析仪检测谷丙转氨酶(ALT),谷草转氨酶(AST)以及总胆红素(TBil)含量。
三、统计学分析方法
采用SPSS13.0统计学软件进行分析,肝功能指标和血管密度计数的重复试验数据应用的形式表示,应用t检验和方差分析进行差异比较,以P< 0.05为差异有统计学意义。
结 果
一、人UC-MSC的生物学特点
人UC-MSC分离培养5 d后就有成纤维细胞样的单个的细胞克隆(图1),流式细胞仪分析(图2)表明了UC-MSC的表型特点和笔者以前报道的是一致的[19],此外,笔者证明了UC-MSC体外向骨细胞和脂肪细胞分化的潜能(图3)。
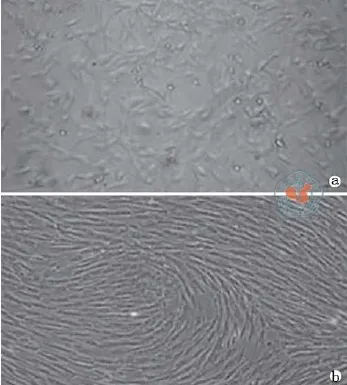
图1 尼康显微镜 ECLIPSE Ti观察UC-MSC的形态
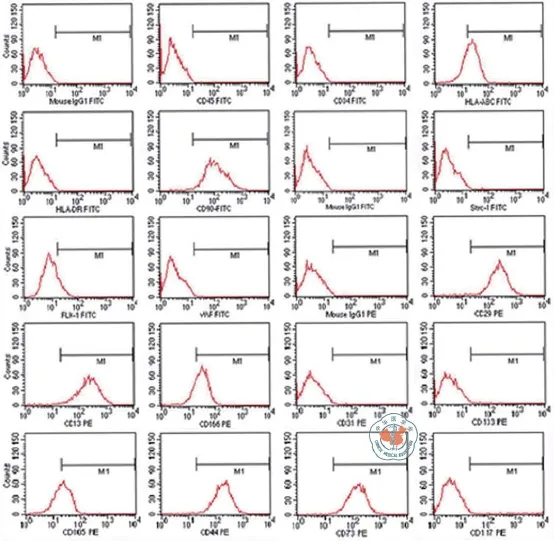
图2 流式细胞仪检测的UC-MSC的细胞表型特点
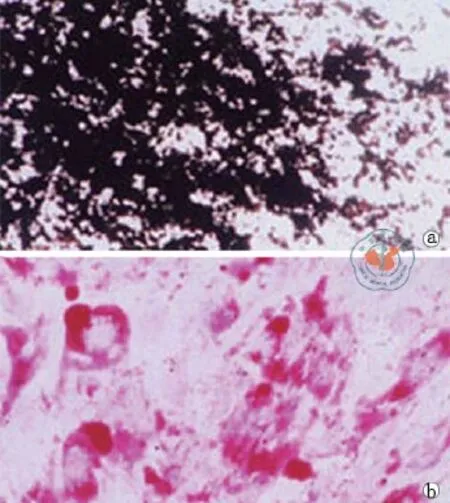
图3 尼康显微镜 ECLIPSE Ti观察骨细胞和脂肪细胞特异染色(×200)
二、UC-MSC体内分化成肝细胞样细胞
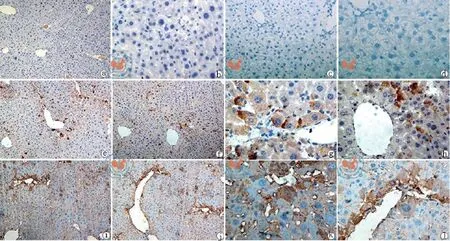
图4 尼康显微镜ECLIPSE Ti观察UC-MSC在CCL4诱导损伤的肝组织中分化为肝细胞样细胞(免疫组织化学法,a、c、e~h图×100,b、d、i~l图×200)
应用免疫组织化学的方法检测了肝脏组织hAFP和hAlb的蛋白表达,在未应用CCL4的正常小鼠的肝脏组织没有检测到hAlb和hAFP蛋白的表达(图4a、b),此外,应用CCL4处理但是没有进行干细胞移植的阴性对照组小鼠肝脏组织也没有检测到hAlb和hAFP蛋白的表达(图4c、d)。但是,在UC-MSC细胞移植治疗组小鼠的肝脏组织,在细胞移植治疗7 d后就可以在肝血窦或者血管周围检测到hAlb和hAFP蛋白阳性表达的细胞(图4 e~l),而且hAFP和hAlb蛋白的表达在细胞移植后21 d明显变强。同时应用人特异性引物的RT-PCR证实UC-MSC确实分化成了能够表达hAlb和hAFP细胞(图5),且DNA测序分析表明PCR扩增的DNA确实是人特异的Alb和AFP序列。
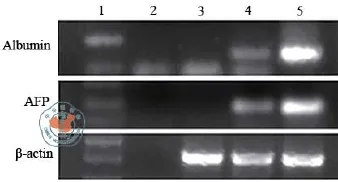
图5 UC-MSC移植小鼠肝脏组织和没有移植细胞的肝组织hAlb和hAFP 的mRNA表达
三、肝脏组织内皮细胞样细胞的检测
为了表明移植的UC-MSC体内可以分化为内皮细胞样细胞,笔者应用人特异性抗体检测了VEGF,CD31和Flk-1,结果表明正常小鼠有低的VEGF蛋白表达(图6a,d),UC-MSC移植后VEGF蛋白表达明显增加(图6b,e),此外,细胞移植治疗后也有CD31和Flk-1的表达(图4c,f)。此外也应用人特异性引物应用RT-PCR检测了KDR, fl t-1和CD31的表达(图6 h)。
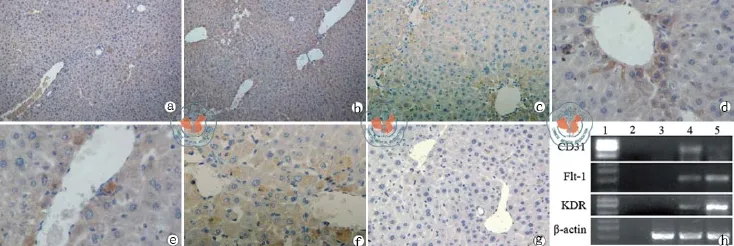
图6 尼康显微镜 ECLIPSE Ti观察肝组织 VEGF和CD31 的免疫组织化学分析
四、UC-MSC移植治疗对肝脏组织毛细血管化的影响
本研究应用CD31和vWF抗体(抗小鼠和人多克隆抗体)孵育显色后标记了肝脏小血管,并计数了CD31和vWF阳性表达的血管并计算血管密度。UC-MSC移植治疗后小鼠肝脏组织vWF标记的血管密度(图7)和CD31标记的血管密度(图8)在28,49 d后明显高于阴性对照组小鼠。增加的血管密度表明了新的肝脏血管化的形成或者肝脏毛细血管化的发生,但是没有移植的阴性对照组小鼠和细胞移植组在移植3周后没有明显的差异(图9),表明肝脏的毛细血管化是暂时的和轻度的。此外,应用了Western blots定量小鼠肝脏组织的CD31和vWF蛋白表达,CCL4处理的小鼠肝脏比正常小鼠有着更高的CD31和vWF表达,但是在UC-MSC细胞移植组和阴性对照组并没有显著的CD31和vWF表达的差异(图10)。
五、人UC-MSC细胞移植后肝脏组织人生长因子的表达

图7 莱卡激光共聚焦显微镜 TCS SP8观察UC-MSC移植治疗后小鼠肝脏组织vWF标记的血管密度(×200)

图8 尼康显微镜 ECLIPSE Ti观察UC-MSC移植治疗后小鼠肝脏组织CD31标记血管密度
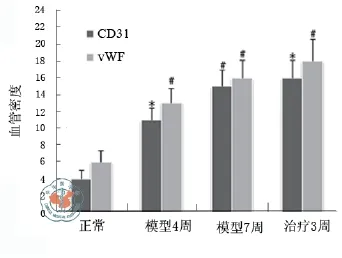
图9 损伤肝组织的毛细血管密度定量分析(血管数/0.4 mm2)
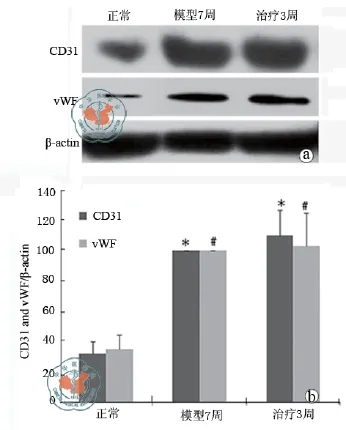
图10 肝组织CD31和vWF表达的Western blot分析
首先,实时定量PCR结果表明了人和小鼠VEGF mRNA的含量在人UC-MSC细胞移植小鼠肝脏有明显更高的表达(图11a)。此外,检测了人UC-MSC细胞移植后肝脏组织几种重要的生长因子的表达,RT-PCR分析表明了在人UC-MSC细胞移植治疗14 d后肝脏组织表达人VEGF,肝细胞生长因子(HGF),胰岛素样生长因子-I(IGF)-I和肝素结合的表皮细胞生长因子(HB-EGF)的mRNA(图11b)。
六、UC-MSC细胞移植治疗部分改善机体肝功能
为了证实UC-MSC细胞移植治疗对机体肝功能的影响,检测了血清中ALT,AST和TBil的表达水平,结果显示UC-MSC细胞移植治疗后机体ALT有明显的降低,但是AST和TBil的含量并没有明显的降低(表2)。

表2 UC-MSC移植治疗后对肝功能的影响
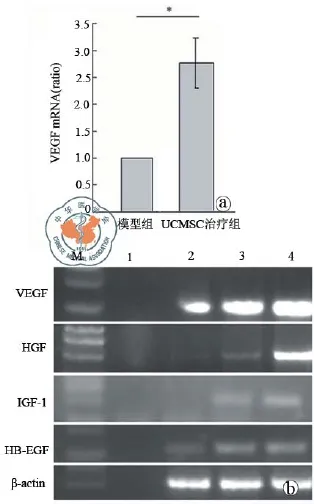
图11 UC-MSC旁分泌肝细胞和血管内皮细胞生长因子
讨 论
由于UC的获取和研究没有任何的伦理学障碍,另外UC-MSC非常容易分离和高效扩增,以及UC-MSC的分化潜能和广阔的临床应用前景,近年来科学家们已经对UC-MSC做了大量的研究,在以前的研究中,成功诱导UC-MSC体外分化成低免疫源性功能性的肝细胞样细胞[10]。今天的结果表明了UC-MSC与BMSC有相似的免疫表型特征以及体外骨细胞和脂肪细胞分化的潜能。为了观察UC-MSC体内分化成肝细胞样细胞的潜能,通过尾静脉注射方式移植UC-MSC到CCL4诱导制备的慢性肝损伤模型小鼠体内。
同时,应用RT-PCR和免疫组织化学的方法检测了肝细胞特异性标志物的表达,和本研究结果一致,研究已经证实了骨髓[21],脐带血[11]和脂肪[8]组织来源的MSC展示了体内分化为肝细胞的潜能。目前,还没有MSC在损伤的肝组织里分化成内皮细胞的证据,实时定量PCR结果表明在CCL4诱导的肝损伤组织有更高的VEGF表达,因此,可能是损伤的肝组织局部缺氧诱导了组织VEGF的高表达,移植UC-MSC后肝脏组织表达人源特异性的VEGF的受体KDR和Flt-1,进而作为MSC在损伤肝组织向内皮细胞诱导分化的微环境。另外,研究已经表明VEGF和它的受体在肝损伤恢复过程中促进肝血窦内皮细胞增生过程中扮演了重要的作用[21],资料表明了UC MSC细胞移植治疗肝损伤模型后肝脏组织肝血窦发生了局部的轻度的毛细血管化,除了VEGF,也表明了UC-MSC细胞移植治疗后损伤的肝组织中其它几种人源性生长因子的表达,如HGF,HB-EGF和IGF-1等,这些因子也促进了肝细胞的再生和移植细胞的植入过程[22]。因此,体内肝损伤模型中UC-MSC肝细胞样细胞和内皮细胞的分化过程可能是由这些旁分泌的生长因子介导的,多种作用的结果导致肝功能的部分改善和组织学上的修复。
研究表明静脉移植人UC-MSC能通过在损伤的肝组织中分化为肝细胞样细胞和内皮细胞,表达相关的细胞表面标志物,同时旁分泌多种细胞生长因子,促进损伤肝细胞的修复,且肝功能获得部分改善,证据表明UC- MSC可能是慢性肝脏损伤性疾病的治疗一种全新的选择。
1 Bell E1,Richardson GD,Jahoda CA,et al.Dermal stem cells can differentiate down an endothelial lineage[J].Stem Cells Dev,2012,21(16):3019-3030.
2 Karaoz E,Okcu A,Ünal ZS,et al.Adipose tissue-derived mesenchymal stromal cells efficiently differentiate into insulin-producing cells in pancreatic islet microenvironment both in vitro andin vivo[J].Cytotherapy,2013,15(5):557-570.
3 Lee HJ,Jung J,Cho KJ,et al.Comparison of in vitro hepatogenic differentiation potential between various placenta-derived stem cells and other adult stem cells as an alternative source of functional hepatocytes[J].Differentiation,2012,84(3):223-231.
4 Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
5 Gao Z,McAlister VC,Williams GM.Repopulation of liver endothelium by bone-marrow-derived cells[J].Lancet,2001,357(9260):932-933.
6 Lee KD,Kuo TK,Whang-Peng J,et al.In vitrohepatic differentiation of human mesenchymal stem cells[J].Hepatology,2004,40(6):1275-1284.
7 Russo FP,Alison MR,Bigger BW,et al.The bone marrow functionally contributes to liver fibrosis[J].Gastroenterology,2006,130(6):1807-1821.
8 Banas A,Teratani T,Yamamoto Y,et al.IFATS collection: in vivo therapeutic potential of human adipose tissue mesenchymal stem cells after transplantation into mice with liver injury[J].Stem Cells,2008,26(10):2705-2712.
9 Chien CC,Yen BL,Lee FK,et al.In vitrodifferentiation of human placenta-derived multipotent cells into hepatocytelike cells[J].Stem Cells,2006,24(7):1759-1768.
10 Zhao Q,Ren H,Li X,et al.Differentiation of human umbilical cord mesenchymal stromal cells into low immunogenic hepatocyte-like cells[J].Cytotherapy,2009,11(4):414-426.
11 Hong SH,Gang EJ,Jeong JA,et al.In vitrodifferentiation of human umbilical cord blood-derived mesenchymal stem cells into hepatocyte-like cells[J].Biochem Biophys Res Commun,2005,330(4):1153-1161.
12 Zeddou M,Briquet A,Relic B,et al.The umbilical cord matrix is a better source of mesenchymal stem cells (MSC) than the umbilical cord blood[J].Cell Biol Int,2010,34(7): 693-701.
13 Gupta TK,Toruner M,Chung MK,et al.Endothelial dysfunction and decreased production of nitric oxide in the intrahepatic microcirculation of cirrhotic rats[J].Hepatology,1998,28(4):926-931.
14 Namisaki T,Yoshiji H,Kojima H,et al.Salvage effect of the vascular endothelial growth factor on chemically induced acute severe liver injury in rats[J].J Hepatol,2006,44(3):568-575.
15 Elvevold K,Smedsrød B,Martinez I.The liver sinusoidal endothelial cell: a cell type of controversial and confusing identity[J].Am J Physiol Gastrointest Liver Physiol,2008,294(2):G391-400.
16 Ishikane S,Ohnishi S,Yamahara K,et al.Allogeneic injection of fetal membrane-derived mesenchymal stem cells induces therapeutic angiogenesis in a rat model of hind limb ischemia[J].Stem Cells,2008,26(10):2625-2633.
17 Raval AN.Therapeutic potential of adult progenitor cells in the management of chronic myocardial ischemia[J].Am J Cardiovasc Drugs,2008,8(5):315-326.
18 Panepucci RA,Siu fi JL,Silva WA Jr,et al.Comparison of gene expression of umbilical cord vein and bone marrowderived mesenchymal stem cells[J].Stem Cells,2004,22(7):1263-1278.
19 Lu LL,Liu YJ,Yang SG,et al.Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J].Haematologica,2006,91(8):1017-1026.
20 Patsenker E,Popov Y,Wiesner M,et al.Pharmacological inhibition of the vitronectin receptor abrogates PDGF-BB-induced hepatic stellate cell migration and activationin vitro[J].J Hepatol,2007,46(5):878-887.
21 Schwartz RE,Reyes M,Koodie L,et al.Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells[J].J Clin Invest,2002,109(10):1291-1302.
22 Shiota G,Wang TC,Nakamura T,et al.Hepatocyte growth factor in transgenic mice: effects on hepatocyte growth,liver regeneration and gene expression[J].Hepatology,1994,19(4):962-972.
Umbilical cord mesenchymal stem cell for chronic experimental liver injury
Zhao Qinjun,Ren Hongying,Chi Ying,Han Zhibo,Ma Fengxia,Chen Fang,Lu Shihong ,Han Zhongchao.Institute of Hematology and Blood Disease Hospital,Chinese Academy of Medical Sciences and Peking Union of Medical College,Tianjin,China
Han Zhongchao,Email:Han zhongcao,hanzhongchao@hotmail.com
ObjectiveRecent observations indicate that mesenchymal stem cells (MSC) derived from many tissues can differentiate into hepatocytes in vitro.It is also reported that MSC can be used to treat liver disease in animal models.However,there are different conclusions from different research groups,and the mechanisms are still not clear.MethodsFifty 7-weekold NOD / SCID mice were injected by carbon tetrachloride (CCL4) to induce chronic liver injury model.Mice were randomly divided into two groups: model group (25) and UC-MSC transplantation group (25).One,2,3 and 4 weeks after 1×106UC-MSC transplanted by tail vein infusion,liver tissue were collected.In addition,immunohistochemistry,RT-PCR and Western blot analysis were used to characterize pathophysiology of liver tissue.T-test and ANOVA was used for statistical analysis.ResultsLiver cell-specific human AFP,Alb,and endothelial cellspecific CD31,Flk-1 was expressed in liver tissue after UC-MSC infusion.Vascular density marked by vWF significantly increased at 4 weeks after cell infusion.And there is significant improvement in liver function.Furthermore,our results indicate that UC-MSC secreted severalimportant growth factors including HGF,FGF-2,and VEGF in liver tissue after cell infusion.ConclusionsHuman UC-MSC can differentiate into hepatocyte-like cells and endotheliallike cells in CCL4-induced chronic liver injury tissue.UC-MSC also paracrine a variety of cell growth factors to repair damaged liver cells,resulting in liver function improvement.UC-MSC infusion may become an important therapeutic option for liver damage in future.
Umbilical cord;mesenchymal stem cell;liver injury;hepatocyte;cell transplantation
2014-09-23)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2014.04.005
国家重点基础研究发展计划(973计划:2011CB964802);国家自然科学基金(81000196、81330015);天津市应用基础及前沿技术研究计划(12JCZDJC25000)
300020 天津,中国医学科学院北京协和医学院血液学研究所(血液病医院)实验血液学国家重点实验室
韩忠朝,Email:hanzhongchao@hotmail.com
赵钦军,任红英,池颖,等.脐带间充质干细胞移植对慢性试验性肝损伤的治疗作用[J/CD].中华细胞与干细胞杂志:电子版,2014,4(4):242-250.
