增强型绿色荧光蛋白标记兔间充质干细胞体外复合小肠黏膜下层的生长特性
2014-05-05宋焕瑾姬钢兰宾尚程斌王伟卓
宋焕瑾 姬钢 兰宾尚 程斌 王伟卓
增强型绿色荧光蛋白标记兔间充质干细胞体外复合小肠黏膜下层的生长特性
宋焕瑾 姬钢 兰宾尚 程斌 王伟卓
目的利用绿色荧光蛋白(EGFP)标记兔来源的骨髓间充质干细胞(BMSC),观察其作为种子细胞复合SIS基质体外培养的生长特性,为复合物回植体内时间提供参考。方法通过物理和化学方法制备小肠黏膜下层(SIS);取新西兰大白兔分离BMSC,体外培养增殖至P3代,行转染增强型EGFP,转染前后根据增殖速度,绘制生长曲线。然后将转染后的第3代间BMSC,以30×106的浓度接种于1 cm×1 cm大小的SIS支架材料上培养。观察细胞转染后的生长特性,检测复合后的细胞总数,荧光显微镜观察复合后细胞形态。结果BMSC经转染后生长增殖速度未受明显影响。细胞DNA检测显示复合物培养第7天培养结果显示细胞增殖状态最佳差异有统计学意义(P< 0.05)。荧光显微镜观察显示复合物培养7天细胞增殖良好差异有统计学意义(P< 0.05),第10天后呈现老化状态。结论增强型的EGFP转染不影响间充质干细胞传代以及增殖。间充质干细胞-SIS基质复合物体外培养7 d回植较为合适。
间充质干细胞;肠黏膜;绿色荧光蛋白质类
随着组织工程的发展,支架材料成为其研究的核心内容之一。小肠黏膜下层(the small intestinal submucosa,SIS)是从猪空肠黏膜下层分离出的无细胞胶原层,是天然的细胞外基质类材料,无免疫性,作为可吸收支架和基质材料已广泛应用于多种组织的修复,如肌腱、半月板和骨缺损的修复[1-3]。
骨髓间充质干细胞(bone marrow-derived mesenchymal stem cell,BMSC)具有较强的分化增殖和自我更新能力,能向不同类型肌肉组织分化[4-5],且来源广泛,获取条件相对容易,有望成为组织工程理想的种子细胞来源。本研究拟通过实验观察BMSC-SIS复合物体外生长的特性,为复合物回植体内提供时间的参考,同时通过增强型绿色荧光蛋白(enhanced green fl uorescent protein,EGFP)标记来显示BMSC在SIS上的生长情况。
材料与方法
一、材料
1.实验动物:2只26~28周龄新西兰兔(西安交通大学医学院动物实验中心),体重2.5~3.0 kg,雌、雄各半,单笼常规饲养。实验过程中对于动物的处置符合西安交通大学医学院伦理委员会的规定和要求。
2.主要试剂和仪器:MEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),Hoechest33258工作液(美国Sigma公司),EGFP(上海比昂生物医药科技有限公司),Polybrene(上海联科生物有限公司),荧光显微镜(日本Nikon公司)。
二、方法
(一)BMSC的原代分离培养
[6]改用胫骨骨髓穿刺获取全骨髓,利用密度梯度离心法获取原代BMSC并行增殖培养,传至第3代细胞。
(二)SIS 制备
1.物理方法处理:将体重200 kg以上、封闭饲养的健康长白系普通家猪小肠取出,立即置于冰中,清洁过程在猪死亡后4 h内完成,小肠的浆膜层和肌层用裹有纱布的刀柄去除,在去除黏膜和肌层过程中用40℃温水持续冲洗。
2.化学方法处理:按Abraham等[7]的方法制备。把用物理方法处理后的小肠纵行剖开,切成15 cm长后再经过一系列的化学方法处理。材料与溶液的体积比例保持在1:100,并且所有的处理过程均在室温下进行。步骤:(1)将机械方法制得的SIS浸泡在含有100 mmol/L EDTA和10 mmol/L NaOH 溶液中(pH = 11~12)16 h;(2)用去离子水将基质冲洗干净,在含有1 mmol/L HCl和1 mmol/L NaCl溶液中(pH = 0~1)浸泡6~8 h;(3)用去离子水冲洗基质,然后在1 mmol/L NaCl的PBS中浸泡16 h;(4)用去离子水冲洗基质,然后在PBS溶液中(pH = 7~7.4)浸泡2 h;(5)再用去离子水冲洗基质2 h(pH = 5.8~7.0);(6)杀菌,将SIS在含0.1﹪过氧乙酸的20﹪乙醇溶液中浸泡8 h,用含0.05﹪NaN3的PBS溶液清洗2 h,然后-70℃程序冻干后用γ射线照射(25~35 KGy)消毒。
(三)BMSC的EGFP标记
分离培养BMSC以1×106接种于10 cm2培养皿中,培养72 h后除去旧培养液,加入预先混好含MOI = 100的重组病毒上清液,用polybrene调整最终病毒质量浓度为8 mg/L,置37℃、体积分数为5﹪CO2孵箱中孵育12 h后换为新鲜培养液;继续培养72 h后在激光共聚焦显微镜下观测EGFP的表达,并继续传代培养。
1.转染后BMSC的生长曲线绘制:将转染前后的细胞制备成单细胞悬液,将细胞悬液浓度调整为2×106,接种于24孔板内,每孔接种1 ml,接种后第1~8天采用细胞计数板计数,绘制生长曲线。
2.BMSC-SIS复合物体外培养的增殖检测:将EGFP转染的第3代BMSC以30×106的浓度接种于1 cm×1 cm大小的支架材料上,接种后1,3,7,14 d 取样本做如下检测:(1)细胞总数检测:复合物碾碎后加入蛋白酶K溶液56℃水浴过夜,10 kg离心,收集上清液,加入Hoechest 33258工作液,荧光定量检测,激发波长为360 nm,发射波长486 nm,通过DNA含量计算细胞总数;(2)荧光显微镜观察复合1,4,7,10,13 d后细胞形态;(3)观察细胞转染后的生长特性,检测复合后的细胞总数,荧光显微镜观察复合后细胞形态。
三、统计学分析方法
采用SPSS13.0统计学软件进行分析。对BMSC-SIS复合物上的细胞进行细胞计数,然后对细胞数进行方差分析。以P< 0.05为差异有统计学意义。
结 果
一、SIS的鉴定结果(图1)
SIS通过物理化学方法处理以后细胞组织残留少,胶原纤维结构分布均匀,走形方向大致一致。HE染色后胶原纤维结构紧密,纤维空隙分布均匀,细胞残留不明显。
二、BMSC的培养和分子表面的表面鉴定
笔者利用密度梯度离心法获取原代BMSC并行增殖培养,大部分细胞为梭形的成纤维细胞样,很少一部分为大的扁平状。流式细胞仪检测细胞表面标记,发现表达间充质标记物(CD90,CD44),不表达造血干细胞标志物(CD45,CD14)(图2)。
三、EGFP转染的BMSC体外增殖检测结果
BMSC增殖能力强,传代后3、4 d即基本融合,转染后细胞形态良好图(图3,4)。生长曲线显示EGFP的转染不影响细胞的增殖(图4)。

图1 显微镜下观察SIS的鉴定结果
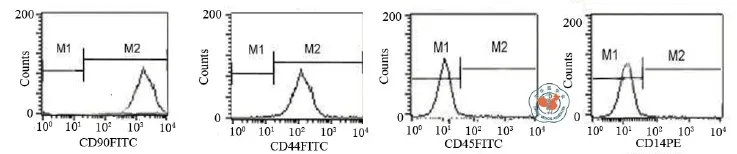
图2 BMSC的流式细胞仪鉴定
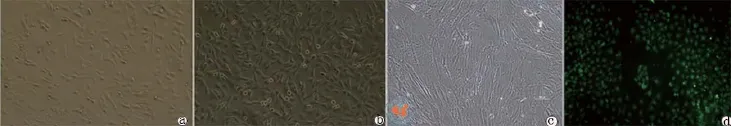
图3 显微镜下观察BMSC培养情况(×200)
四、BMSC-SIS复合物的体外增殖检测
DNA含量检测:细胞在SIS上增殖良好,7 d后增殖基本趋缓。BMSC与SIS有良好的生物相容性(图5)。
荧光显微镜观察:BMSC在SIS表面培养7 d时具有良好的细胞形态。第10天细胞数量逐渐减少,活性也逐渐降低(图6)。
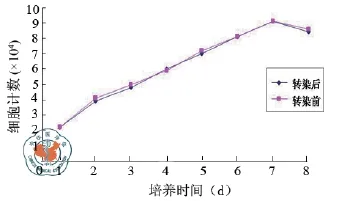
图4 EGFP转染前后的BMSC生长曲线
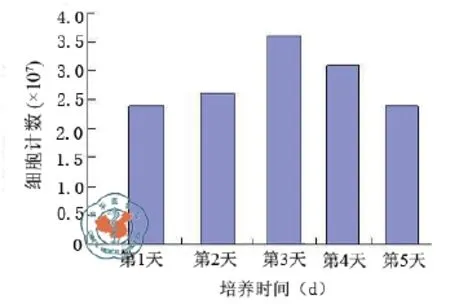
图5 BMSC-SIS复合物体外增殖柱状图
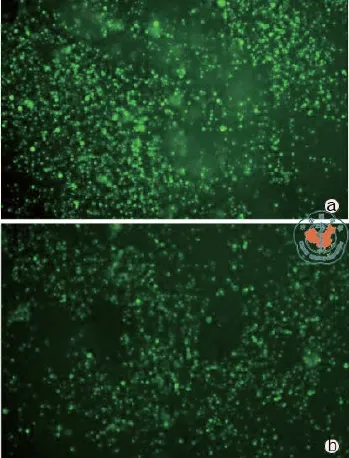
图6 荧光显微镜观察BMSC-SIS 复合物荧光鉴定(×400)
讨 论
有文献报道,从自体原有组织器官上取出成熟的体细胞作为种子细胞有许多不足之处,如:部分器官细胞取材困难;体外培养增殖速率过慢;体外培养后其原有功能会出现明显的退化[8]。干细胞具有高度增殖和自我更新能力,且能向不同类型组织细胞分化,是理想的种子细胞来源。BMSC因其来源广泛,获取简单,同样具有其他干细胞多向性分化的功能,因此越来越多地应用于组织工程研究中。
理想的支架材料必须具有细胞亲和性,适合细胞黏附、繁殖、扩增、分泌基质,并具有良好的重复操作性,植入后能保持原形。通过各种物理、化学等脱细胞方法脱去原组织中的细胞成分,得到的无细胞基质富含胶原、无免疫原性,并且能在体内被降解,因此该种胶原组织在组织工程中得到广泛应用。SIS具有良好的可操作性及拉伸率,保持了良好的生物相容性,无细胞毒性,并有一定的机械强度,已广泛应用于组织工程研究中[9]。本实验通过检测BMSC在SIS上体外增殖的生长变化规律,为细胞复合材料的回植时间提供依据。结果显示细胞与BAMG有良好的相容性,体外培养7 d后细胞进入平台期,10 d后共聚焦显微镜观察显示细胞形态变老,增殖减慢。因此初步认为BMSC复合SIS后,体外培养7 d后较适合回植体内。
EGFP作为细胞示踪标记已得到广泛应用[10-11]。细胞的示踪标记一直是进行组织工程作用机制研究的难点之一,尤其在种子细胞作用机制的研究中更为重要[12]。目前研究中所采用的DiI、Hoechst33342、荧光素等示踪标记方法存在不少缺陷,标记时间有限且污染周围组织。因此EGFP作为有效的标记工具越来越得到关注[13]。目前,常用的EGFP标记干细胞的方式有3种:质粒载体转染、病毒载体转染和EGFP转基因动物。EGFP质粒转染具有操作简便、对干细胞的免疫原性和毒性小等优点[14],但不十分稳定,容易丢失;病毒载体的优势是表达高效稳定,但存在免疫反应和致癌性等安全隐患[15];EGFP转基因动物虽然没有上述缺点,但应用范围较限制,EGFP转基因在小动物中如小鼠较为成熟[16],但应用范围有限,在稍大动物模型中应用较少。本实验中采用慢病毒转录的增强型EGFP,它能使编码EGFP的基因序列整合到靶细胞染色体中,EGFP将随细胞的生长而稳定持续的表达,表达时间更长。实验证明该类EGFP在胞内表达稳定,且对细胞的增殖没有明显影响,细胞传代不影响EGFP的表达,是组织工程研究中理想的细胞示踪工具。
参 考 文 献
1 Derwin K,Androjna C,Spencer E,et al.Porcine small intestine submucosa as a fl exor tendon graft[J].Clin Orthop,2004,423:245-252.
2 Muller-Rath R,Mumme T,Miltner O.Meniscus replacement:current aspects in the field of tissue engineering[J].Z Orthop Ihre Grenzgeb,2004,142(5): 540-545.
3 Lee SJ,Lee IW,Lee YM,et al.Macroporous biodegradable natural/synthetic hybrid scaffolds as small intestine submucosa impregnated poly (D,L-lactide-co-glycolide) for tissue-engineered bone[J].J Biomater Sci Polym Ed,2004,15(8):1003-1017.
4 Strem BM,Hicok KC,Zhu M,et al.Multipotential differentiation of adipose tissue-derived stem cells[J].Keio J Med,2005,54(3):132-141.
5 Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
6 徐成峰,胡大海,赵周婷,等.兔骨髓间充质干细胞体外分离培养及多向诱导分化[J].中国组织工程研究与临床康复,2010,14(6):1002-1005.
7 Abraham GA,Murray J,Billiar K,et al.Evaluation of the porcine intestinal collagen layer as a biomaterial[J].Biomed Mater Res,2000,51:442-452.
8 Becker C,Jakse G.Stem cells for regeneration of urological structures[J].Eur Urol,2007,51(5):1217-1228.
9 Kim BS,Atala A,Yoo JJ.A collagen matrix derived from bladdercan is used to engineer smooth muscle tissue[J].World J Urol,2008,26(4):307-314.
10 任高宏,刘晓静,杨磊,等.绿色荧光蛋白体外转染与体内示踪成骨细胞的研究[J].中华整形外科杂志,2004,20(6):439-442.
11 Fujimura J,Ogawa R,Mizuno H,et al.Neural differentiation of adipose-derived stem cells isolated from GFP transgenic mice[J].Biochem Biophys Res Commun,2005,333(1):116-121.
12 Cho SW,Kim SS,Rhie JW,et al.Engineering of volumestable adipose tissues[J].Biomaterials,2005,26(17):3577-3585.
13 Gerrard L,Zhao D,Clark AJ,et al.Stably transfected human embryonic stem cell clones express OCT4-speci fi c green fluorescent protein and maintain self-renewal and pluripotency[J].Stem Cells,2005,23(1):124-133.
14 Nakashima S,Matsuyama Y,Nitta A,et al.Highly efficient transfection of human marrow stromal cells by nucleofection[J].Transplant Proc,2005,37(5):2290-2292.
15 Asano T,Ageyama N,Takeuchi K,et al.Engraftment and tumor formation after allogeneic in utero transplantation of primate embryonic stem cells[J].Transplantation,2003,76(7):1061-1067.
16 Mothe AJ,Kulbatski I,van Bendegem RL,et al.Analysis of green fluorescent protein expression in transgenic rats for tracking transplanted neural stem/progenitor cells[J].J Histochem Cytochem,2005,53(10):1215-1226.
Growth characteristics of rabbit BMSCs labelled with EGFP on SIS invitro
Song Huanjin*,Ji Gang,Lan Binshang,Cheng Bin,Wang Weizhuo.*Department of Orthopedics,the Second Affiliated Hospital,Xi’an Jiao Tong University.Xi’an 710004,China
Song Huanji,Email: shjwnh@126.com
Objective To observe the growth characteristics of rabbit bone marrowderived mesenchymal stem cells (BMSC) with enhanced green fluorescent protein (EGFP) which were used as seeding cells for small intestinal submucosa (SIS)in vitro.MethodsThe SIS was prepared using physical and chemical methods.BMSC were isolated from New Zealand rabbits and transfected with EGFP by virus.The characteristics of BMSC before and after transfection were observed.Labeled BMSC were seeded at the concentration of 30×106on the 1 cm×1 cm SIS.The proliferation and morphology of EGFP labeled BMSC were observed with fluorescent microscope after 3,7,and 10 days’ co-culture.ResultsTransfection of BMSC with EGFP virus did not affect the proliferation and morphology of BMSC.DNA measurement of these cells was showed that labelled BMSC proliferated well on SIS at day 7; however these cells showed senescence at day 10.ConclusionThe EGFP has no effect on BMSC proliferation.The BMSCSIS should be used for transplantation at about day 7 after co-culture.
Mesenchymal stem cell;intestinal mucosa;green fluorescent proteins
2013-12-10)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2014.04.006
该课题由陕西省科技攻关项目资助(2011K12-72)
710004 西安,西安交通大学第二附属医院骨科(宋焕瑾、兰宾尚、程斌、王伟卓);西安市中心医院(姬钢)
宋焕瑾,Email:shjwnh@126.com
宋焕瑾,姬钢,兰宾尚,等.增强型绿色荧光蛋白标记兔间充质干细胞体外复合小肠黏膜下层的生长特性[J/CD].中华细胞与干细胞杂志:电子版,2014,4(4):251-255.
