脐带间充质干细胞治疗儿童重型免疫性血小板减少症的探索性研究
2014-05-05章波栾佐唐湘凤吴南海汪兆艳王倩杨印祥
章波 栾佐 唐湘凤 吴南海 汪兆艳 王倩 杨印祥
脐带间充质干细胞治疗儿童重型免疫性血小板减少症的探索性研究
章波 栾佐 唐湘凤 吴南海 汪兆艳 王倩 杨印祥
目的探讨脐带间充质干细胞(UC-MSC)输注治疗儿童重型免疫性血小板减少症(sITP)的疗效及安全性。方法采用UC-MSC治疗儿童sITP 3例。发病年龄为3个月至4岁,初治时血小板计数为(1~7)×109/L,3例均为sITP,均出现严重出血,激素及免疫抑制剂无效或依赖。后给予2~3次(1次/周)静脉输注非血缘UC-MSC,输注细胞量为(1~2)× 106/kg。输注后密切监测血象及肝肾功能等各项指标,观察疗效及不良反应。结果随访时间15~45个月,3例在输注细胞后渐显效:第1例在输注细胞后20 d血小板达到 65×109/L,随访4个月,血小板均维持在1×1011/L以上;第2例在输注细胞后41 d血小板达105×109/L,之后血小板一直维持正常;第3例在输注第2次细胞后血小板渐上升至2×1011/L以上。输注过程中1例出现面色发红,1例出现血压升高,随访至今无明显不良反应。结论UC-MSC对儿童重型ITP有一定的疗效,能提高儿童的生活质量;有必要扩大病例数,进一步研究UC-MSC治疗儿童ITP的疗效及机制。
血小板减少;间充质干细胞;免疫调节;治疗
免 疫 性 血 小 板 减 少 症(immune thrombocytopenic purpura,ITP)即“特发性血小板减少性紫癜”,国际ITP工作组现提出新的分期标准,即3个月内为“新诊断的ITP”,3~12个月为“持续性ITP”包括未取得自发缓解或停止治疗后不能维持完全缓解的患者,持续12个月以上称为“慢性ITP”。重型免疫性血小板减少症(severe Immune thrombocytopenia,sITP)是指血小板计数< 1×1010/L,且就诊时存在需要治疗的出血症状,或常规治疗中发生新的出血症状需加用其他升高血小板药物或增加现有治疗药物剂量[1]。研究表明ITP不仅存在体液免疫的紊乱也存在细胞免疫的紊乱,Semple[2]及Panitsas等[3]研究发现,ITP患者Th1细胞因子IL-2和IFN-γ明显增加,而Th2细胞因子IL-4和IL-10却显著降低,这些变化与血小板计数减少有显著相关性,使ITP患者倾向于一个新的Th1/Th2细胞因子平衡,最终导致ITP。间充质干细胞(mesenchymal stem cell,MSC)是一种来自中胚层的具有自我更新和多向分化潜能的低免疫原性多能干细胞,具有免疫调节作用。Aggarwal等[4]将骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)与Th1细胞或Th2细胞共培养时,发现MSC可以降低Th1细胞分泌IFN-γ,而相反地促进Th2细胞分泌IL-4。进一步研究表明MSC可以显著抑制ITP患者Th1细胞因子(IFN-γ、IL-2)的分泌,并且随着MSC的数量增多,其抑制作用增强;MSC可以促进ITP患者Th2细胞因子(IL-4、IL-10)的分泌,且随MSC数量的增加,促进作用增强。Hong等[5]利用人MSC治疗慢性移植物抗宿主(graft versus host disease,GVHD)所致硬皮病时也观察到MSC能改变Th1和Th2的比率。上述研究为MSC治疗ITP提供了一定的理论依据。
2008至2013年笔者团队先后用脐带间充质干细胞(umbilical cord mesenchymal stem cell,UC-MSC)治疗3例sITP,3例均为免疫球蛋白及激素治疗后反复的病例,血小板计数< 10×109/L,且就诊时存在需要治疗的出血症状,常规治疗中发生新的出血症状需加用其他升高血小板药物或增加现有治疗药物剂量,诊断为重型sITP。后经医院伦理委员会同意及家长的知情同意,给予静脉输注UC-MSC,输注后观察疗效,观察治疗前后患者病情的变化,现报道如下。
资料与方法
一、临床资料
例1,体重9 kg,患儿于3月龄出现自发性出血,以皮肤出现出血点为主要症状,血小板最低至(2~3)×109/L。骨穿结果示巨核细胞成熟障碍,抗血小板抗体PAIgG升高,抗自身抗体(-)及巨细胞病毒核酸定量(-),EB病毒核酸定量(-),人细小病毒B19核酸定量(-),诊断为ITP。给予免疫球蛋白(2 g/kg 分4 d)冲击治疗及强的松(15 mg/d,连续5 d),血小板升至1.51×1011/L,随着强的松减量至7.5 mg/d,血小板降至7×109/L。期间常有鼻大量出血及便血,需要输注血小板及大量免疫球蛋白(2 g/kg 分4 d)冲击治疗才能止血,停用几天后反复,诊断为重型ITP。
例2,体重9 kg,6个月龄时皮肤开始出现出血点,血小板最低7×109/L。骨髓形态学示:巨核细胞成熟障碍。抗自身抗体(-),巨细胞病毒核酸定量(-),EB病毒核酸定量(-),人细小病毒B19核酸定量(-)。抗血小板抗体PAIgG和PAIgM升高,诊断为ITP。给予免疫球蛋白(2 g/kg 分4 d)冲击,甲泼尼龙(2 mg・kg-1・d-1)静滴4 d及口服强的松(1 mg・kg-1・d-1)3 d序贯治疗,血小板最高至2.12 ×1011/L,停药后血小板降至1×109/L。复给予免疫球蛋白(2g/kg 分4 d)冲击、甲泼尼龙(1 mg・kg-1・d-1,连续4 d)静滴治疗,血小板最高至3.77×1011/L,但强的松后续治疗(1 mg・kg-1・d-1,连续5 d)无效,改为静滴甲泼尼龙(2 mg・kg-1・d-1,连续5 d)治疗效差,血小板2×109/L。期间出现严重鼻出血,给予甲泼尼龙冲击(2 mg・kg-1・d-1,连续5 d)治疗无效,需给予输注血小板及大量免疫球蛋白(2 g/kg 分2 d)治疗才能止血,停用几天后反复,诊断为重型ITP。
例3,体重15 kg,2012年6月查β-葡糖脑苷酶缺乏确诊为戈谢病,2013年3月因巨脾、脾功能亢进行脾切除术。2013年5月9日在我科行非血缘脐血造血干细胞移植治疗,输注成功,输注后13 d行骨穿查嵌合率为完全供者型,输注后29 d β-葡糖脑苷酶恢复正常。移植后3个月患儿出现血小板减少,血小板最低1×109/L,其他两系正常。查骨髓形态学示:巨核细胞成熟障碍。给予大量免疫球蛋白(2 g/kg 分4 d)及甲泼尼龙(2 mg・kg-1・d-1连续5 d)冲击治疗血小板最高至1.09×1011/L,停用后血小板降至9.00×109/L。给予口服强的松(1 mg/kg 连续2周)治疗效果不佳。期间出现多次鼻出血,且出血性休克1次,给予积极治疗后好转,后血小板仍在1.00×1010/L以下,一直口服环孢素(2.5 mg・kg-1・d-1),血小板未见上升,诊断为重型ITP。
二、方法
1.UC-MSC培养:取足月健康产新生儿脐带组织(中国人民解放军海军总医院有符合生物治疗要求的GMP标准实验室,其培养条件及资质均符合国家标准),置于75﹪酒精浸泡30 s以消毒除菌,无菌PBS液冲洗后剪切脐带组织至约1 cm的小组织块并移至离心管中。向离心管中加入5~6倍体积的0.2﹪的Ⅱ型胶原酶,37℃过夜消化13~15 h。后向离心管中加入含10﹪胎牛血清的DMEM培养基洗涤细胞,离心半径13.5 cm,1600 r/min离心5 min。离心后加入适量生长培养基重悬细胞,对细胞进行细胞计数。按2.0×104/cm2的密度接种于细胞培养瓶,放入含5﹪CO2的细胞培养箱中培养。3~4 d换液,当细胞贴壁生长至70﹪~80﹪汇合后,以0.25﹪胰蛋白酶- 0.02﹪EDTA消化液消化,收集所得到细胞悬液,离心半径13.5 cm,1600 r/min离心5 min,弃上清,用培养液按1:3传代,收集3~4代细胞。利用流式细胞仪鉴定显示UC-MSC高表达CD29、CD13、CD44、CD90、CD105,低表达CD34、CD45和HLA-DR。输注前行细胞培养液污染检测和细胞活性鉴定。
2.UC-MSC输注:输注细胞数为(1.0~2.0)× 106/kg,1次/周,共2~3次。输注前给予异丙嗪预防过敏,输注后观察疗效及不良反应,平均随访15~45个月,主要随访症状及血小板计数及输注前后肝肾功能等指标变化(表1)。

表1 3例sITP患者一般资料
结 果
疗效:例1停用一切药物后血小板计数在输注第1次UC-MSC后稍有上升,第2天最高至3.9×1010/L,后血小板有下降趋势,第8天最低下降至1.7×1010/L,后逐渐上升且在输注后20 d达到6.5×1010/L,输注后随访4个月,血小板均维持在1.0×1011/L以上(图1),未出现皮肤出血点及其他出血倾向;例2停用一切药物后血小板计数在第2次UC-MSC输注后血小板最高达5.9×1010/L(第1次细胞后第14天),第15天稍有下降(4.2×1010/L),第16天给予输注第3次UC-MSC,第18天血小板上升至9.0×1010/L,之后血小板有下降趋势,第24天血小板最低至2.3×1010/L,后逐渐上升,第41天血小板达1.05×1011/L,之后血小板均维持在> 1.0×1011/L(图2),未出现皮肤出血点及其他出血倾向;例3停用一切药物后在输注第1次UC-MSC后血小板下降至20×109/L后上升,输注第2次UC-MSC后血小板渐上升至2.0×1011/L以上(图3)。不良反应:例1输注后出现面部发红,观察一段时间后正常;例2在输注第2次UC-MSC后血压升高,最高至130/100 mmHg(1mmHg = 0.133 kPa),给予对症支持治疗后降至正常,未出现其他不良反应;例3在输注UC-MSC未出现明显不良反应。以上3例随访至今未见肝肾功能损害及严重感染等其他不良反应(表2)。
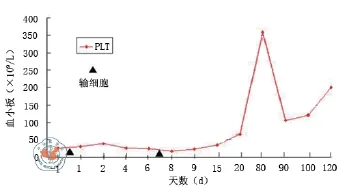
图1 患者1血小板趋势

图2 患者2血小板趋势
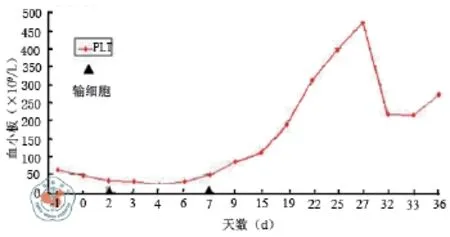
图3 患者3血小板趋势

表2 3例sITP患者间充质干细胞输注情况
讨 论
ITP的一线治疗方法为:抗-Rh(D)免疫球蛋白,糖皮质激素,丙种球蛋白;二线治疗方法有:脾切除术(指成人)、达那唑、硫唑嘌呤、环孢素、环磷酰胺、氨苯砜、骁悉、美罗华、长春新碱、血小板受体激动剂包括Romiplostim和Eltrombopag;一二线治疗药物失败的患者是可以应用联合化疗药物治疗、Campath-1H、造血干细胞移植等[6]。以上方法治疗ITP疗效不一,且儿童正处于生长发育时期,长期的激素及免疫抑制药物在一定程度上影响患儿的身体健康,以上患儿均为重型ITP,常出现大量出血,一般免疫抑制剂疗程长,疗效不一。
MSC具有免疫调节作用,近年来国内外MSC已用于临床治疗各种疾病,包括GVHD、多种自身免疫性疾病,系统性红斑狼疮、再生障碍性贫血、多发性硬化、克罗恩病等。国内孙凌云等[7]报道应用异体骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)治疗9例难治性SLE患者,输注MSC细胞数为1×106/kg,输注后患者的SLEDAI积分降低,短期内能降低ANA,抗ds-DNA滴度和24 h尿蛋白定量水平,升高补体C3,肾功能好转,狼疮病情好转。Le等[8]的临床研究显示:应用异体BMSC治疗激素无效的55例严重急性GVHD,其中30例患者获得完全反应,9例显示出症状缓解,未显示明显的副作用。至今已有许多移植机构先后报道了用MSC治疗GVHD的临床研究。Osiris公司已将MSC的临床应用开始进行了三期临床实验,包括激素无效的难治性GVHD,新诊断的急性GVHD和克罗恩病[9]。Bassem等[10]用自体BMSC治疗7例多发性硬化病,7例移植患者EDSS评分中5例病情缓解,1例病情未得到改善,1例患者症状恶化。Marjolijn等[11]报道了10例应用自体BMSC治疗难治性克罗氏病,3例在治疗6星期后出现临床效果,3例在病情加重后进行手术治疗,其中进行输注的患者中除了1例出现过敏,其他均未出现不良反应。上述MSC在治疗各种疾病显示出无明显不良反应,其应用于临床治疗疾病是安全的。
从以上临床研究可以看出MSC治疗自身免疫性疾病已有初步的疗效,而ITP也是一种自身免疫性疾病,故有学者尝试应用MSC治疗ITP。Fang等[12]应用脂肪来源间充质干细胞(adipose tissue-derived mesenchymal stem cell,AMSC)治疗7例成人ITP,移植的细胞量为2.0×106/kg,未见明显的副作用。所有患者血小板均有所升高,4例(57.1﹪)出现持续的反应,且移植后Th1/Th2细胞因子趋向平衡。MSC的来源多种,有自身骨髓来源、异体骨髓来源、脐带来源、脂肪来源等等。UC-MSC来源广泛且容易培养,且有研究表明UC-MSC与BMSC、AMSC有相似的特性和免疫调节作用[13-16],故可以用UC-MSC来治疗ITP。Ma等[17]利用UC-MSC治疗2例成人ITP,应用的细胞量均为4×105/kg,一例在62 d达到最高82× 109/L,后又下降至29×109/L,但未出现各种出血症状;另一例在30 d血小板达到最高112×109/L,后一直处于缓解状态,未出现各种出血症状。从以上可以看出AMSC及UC-MSC在治疗成人ITP上有一定疗效,且无明显不良反应。本文报道了3例应用UC-MSC治疗儿童重型ITP,3例在输注后血小板渐升至正常,均未再出现出血症状,输注过程中患儿对UC-MSC耐受好未出现明显副作用,随访至今均未出现不良反应,说明此种治疗是较安全的,但其治疗的安全性仍需延长随访时间及扩大病例数进一步观察。
1 卢新天.美国血液学会免疫性血小板减少症基于证据的实践指南(儿童)[J].中国小儿血液与肿瘤杂志,2011,16(5):232-236.
2 Semple JW.T cell and cytokine abnormalities in patients with autoimmune thrombocytopenic purpura[J].Transfus Apher Sci,2003,28(3):237-242.
3 Panitsas FP ,Theodoropoulou M,KouraklisA,et al.Adult chronic idiopathic thrombocytopenic purpura ( ITP) is the manifestation of a type-1 polarized immune response[J].Blood,2004,103(7):2645-2647.
4 Aggarwal S,Pittenger MF.Human mesenchymal stem cells modulate allogeneic immune cell responses[J].Blood,2005,105(4):1815-1822.
5 Zhou H,Guo M,Bian C,et al.Ef fi cacy of bone marrowderived mesenchymal stem cells in the treatment of sclerodermatous chronic graft-versus-host disease: clinical report[J].Biol Blood Marrow Transplant,2010,16(3):403-412.
6 Provan D,Stasi R,Newland AC,et al.International consensus report on the investigation and management of primary immune thrombocytopenia[J].Blood,2010,115(2):168-186.
7 孙凌云.间充质干细胞治疗系统性红斑狼疮的机制和应用[J].内科理论与实践,2008,13(3):158-161.
8 Le Blanc K,Frassoni F,Ball L,et al.Mesenchymal stem cells for treat-ment of steroid-resistant,severe,acute graftversus-host disease: a phase II study[J].Lancet,2008,371(9624):1579-1586.
9 Salem HK,Thiemermann C.Mesenchymal stromal cells: current understanding and clinical status[J].Stem Cells,2010,28(3):585-596.
10 Yamout B,Hourani R,Salti H,et al.Bone marrow mesenchymal stem cell transplantation in patients with multiple sclerosis: a pilot study[J].J Neuroimmunol,2010,227(1-2):185-189.
11 Duijvestein M,Vos AC,Roelofs H,et al.Autologous bone marrow-derived mesenchymal stromal cell treatment for refractory luminal Crohn's disease:results of a phase I study[J].Gut,2010,59(12):1662-1669.
12 Fang B,Mai L,Li N,et al.Favorable response of chronic refractory immune thrombocytopenic purpura to mesenchymal stem cells[J].Stem Cells Dev,2012,21(3):497-502.
13 Wang M,Yang Y,Yang D,et al.The immunomodulatory activity of human umbilical cord blood derived mesenchymal stem cellsin vitro[J].Immunology,2009,126(2):220-232.
14 Cho PS,Messina DJ,Hirsh EL,et al.Immunogenicity of umbilical cord tissue derived cells[J].Blood,2008,111(1):430-438.
15 吕璐璐,宋永平,魏旭东,等.人脐带和骨髓源间充质干细胞生物学特征的对比研究[J].中国实验血液学杂志,2008,16(1):140-146.
16 Yoo KH,Jang IK,Lee MW,et al.Comparison of immunomodulatory properties of mesenchymal stem cellsderived from adult human tissues[J].Cell Immunol,2009,259(2):150-156.
17 Ma L,Zhou Z,Zhang D,et al.Immunosuppressive function of mesenchymal stem cells from human umbilical cord matrix in immune thrombocytopenia patients[J].Thromb Haemost,2012,107(5):937-950.
Exploratory research of umbilical cord mesenchymal stem cell to treat severe immune thrombocytopenia in children
Zhang Bo,Luan Zuo,Tang Xiangfeng,Wu Nanhai,Wang Zhaoyan,Wang Qian,Yang Yinxiang.People's Liberation Army Navy General Hospital,Beijing 100048,China
Luan Zuo,Email:35769154@qq.com
ObjectiveTo explore the efficacy and safety of umbilical cord mesenchymal stem cells (UC-MSC) infusion for children with severe immune thrombocytopenia (sITP).MethodsChildren aged 4 months to 4 years with severe immune thrombocytopenia (sITP) were enrolled.The platelet count before treatment was (1-7) ×109/ L.All patients have severe hemorrhagic symptoms.Treatment included corticosteroids and immunosuppressants.2-3 doses of (1-2)× 106UC-MSC/kg were given intravenously to each of the patients.After infusion the platelet count and biochemical parameters were closely monitored.Side effects were recorded.The literature was reviewed for the diagnosis and treatment of sITP ,as well as the effect and theoretical basis of UC-MSC infusion for sITP.ResultsDuring the follow-up of 15 and 45 months,platelet count in 3 cases has increased.In the first case,the platelet count rose to 65×109/L by 20 days after cell insusion and maintained above 1×1011/L for 4 months.In the second case,platelet count progressively rose to 105×109/L at 41 days after cell infusion,and that remained normal afterwards.In the process of infusion,the face of one patient became red due to allergic reaction possibly.Another patient suffered from high blood pressure.All cases had no obvious side effect after infusion.CloclusionThe preliminary results suggest that UC-MSC iseffective for sITP in children.It can enhance the patients’ quality of life.It is necessary to further explore the effect and mechanism of UC-MSC transplantation for sITP in large clinical trials.
Thrombocytopenia;mesenchymal stem cell;immunoregulation;treatment
2014-06-29)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2014.04.004
100048 北京,中国人民解放军海军总医院儿科
栾佐,Email:35769154@qq.com
章波,栾佐,唐湘凤,等.脐带间充质干细胞治疗儿童重型免疫性血小板减少症的探索性研究[J/CD].中华细胞与干细胞杂志:电子版,2014,4(4):236-241.
