MicroRNA-181a对人宫颈癌细胞的铂类药物敏感性的调节作用
2014-05-04李巧云
李巧云
(河北省唐山市妇幼保健院妇科,河北 唐山 063000)
鳞状细胞癌是宫颈癌最主要的病理类型,占80% ~85%[1]。目前,化学治疗(简称化疗)是治疗宫颈癌的重要手段,以铂类为基础的化疗结合放射治疗(简称放疗)是治疗原位晚期宫颈癌的主要方法。但近年来发现,许多晚期宫颈癌患者在治疗过程中逐渐产生对化疗药物的耐药性,导致治疗失败。因此,对化疗药物耐药性的研究已成为宫颈癌患者治疗的热点。microRNA(miRNA)是一种短链非编码RNA,是重要的转录后调控因子[2]。近几年的研究已经证明,miRNA同多种肿瘤的化疗耐药性有关,影响药物的传递与代谢[3]。故推论miR-181a的上调表达或许也同宫颈癌细胞化疗药物的耐药性相关。本研究中分析了miR-181a在人宫颈鳞状细胞癌细胞系及裸鼠移植瘤模型中的功能及其对化疗药物敏感性的影响,为提高宫颈癌的药物治疗提供理论依据。
1 材料与方法
1.1 材料
病例与肿瘤标本:肿瘤标本取自70例经组织病理学诊断为宫颈鳞状细胞癌Ⅲb期的患者,此前未进行过化疗,患者全身情况良好,无严重的器官功能不全,未合并其他器官/血液的恶性肿瘤。入院后对研究对象采用标准化疗方案,每周40 mg/m2顺铂,在完成化疗6个月后,进行组织病理学诊断,如果肿瘤坏死大于50%为敏感,否则认为肿瘤对药物不敏感(耐药)。共有75例患者符合研究要求,其中9例对化疗药物有耐药性。所有标本贮存温度为-80℃。用于组织病理学诊断的组织至少包含70%的肿瘤细胞。在取标本前,所有患者均签署知情同意书。
细胞系与小鼠:SiHa与Me180人宫颈癌细胞系(购自中国典型培养物保藏中心),培养于含10%胎牛血清的Egale′s Minimum Essential(EMEM)培养基或 McCoy′s 5a改良培养基,加入适量抗生素,培养在 37℃、5%CO2的培养箱中。雌性 BALB/c裸鼠(4~6周龄),购自河北医科大学动物实验中心,饲养在无病原菌房间内。试验期间动物管理符合国家动物管理条例,所有试验均经医院伦理委员会批准。
1.2 试验方法
RNA提取与实时定量聚合酶链式反应:将病理标本送至上海生物科技公司,病理标本中的RNA提取采用凯基miRNA抽取试剂盒(批号为217004),用安捷伦公司miRNA微阵列芯片分析基因谱,具体方法参照试剂盒说明书。细胞中的总RNA提取采用Trizol法,用 Prime Script RT试剂盒(TaKaRa,中国大连),根据试剂盒说明书进行反转录。SYBR Premxi Ex Taq用于实时定量PCR试验。用特异性引物对RNA进行反转录。TaqMan探针检测miRNA的表达。采用U6核小RNA(美国AB公司)为内参进行均一化。
质粒转染:miR-181a抑制因子-PRKCD干扰 RNA(siRNA)及阴性质粒作为非特异性对照,其miRNA/siRNA由Gene Pharma(中国上海)合成。miR-181a抑制因子为序列特异、最优化的单链RNA分子,靶向互补于目的RNA,从而下调相关靶向分子表达。hsa-miR -181a序列为 5′ACUCACCGACAGCGUUGAAUGUU -3′,抑制因子 NC 序列为 5′-CAGUACUUUUGUGUAGUACAA -3′。siPRKCD敲除PRKCD miRNA与蛋白质的表达,Me180或SiHa细胞种植于 6孔板中(2×105个细胞 /孔),用 Lipofectamine2000(Invitrogen公司)试剂转染,miRNA与 siRNA转染量为100 pmol,具体操作方法根据试剂盒说明书进行转染,时间为48 h。为了分析 miR-181a与 PRKCD对宫颈癌细胞系的影响,将几个不同miRNA序列构建到载体中,建立稳定转染 Me180与 SiHa细胞系,最后用 qRT-PCR与 Western blot检测稳定转染细胞系中miR-181a或PRKCD的表达。
CCK-8试验分析细胞的活性:用 Cell Counting Kit(CCK-8)试剂盒(Dojindo,中国上海)分析SiHa与 Me180的细胞活性。直接或转染后48 h,将细胞种植于96孔板中(5×103个细胞/孔)。孵育过夜后,加入新鲜配制好的不同浓度的化疗药物,例如顺铂或吉西他滨(Sigma公司)。细胞用药处理48 h后,加入正常培养基,含有WST-8底物,37℃孵育2 h。随后,细胞活力用分光光度计,在450 nm波长下测定吸光度值。
体内化疗敏感性试验:稳定转染miR-181a表达载体或阴性对照载体(2×106个细胞 /老鼠)的Me180细胞收集后,皮下注射到6周龄BALB/c裸鼠(每组7只)右侧背部。每隔2周测量1次肿瘤体积,肿瘤体积计算公式,V(mm3)=A×B2/2,A为最大直径,B为垂直直径。在14 d时,肿瘤体积最大直径约为8 mm,体积为100 mm3,表达 miR-181a或对照载体细胞的荷瘤小鼠,随机分成两组。一组每周皮下注射5 mg/kg顺铂,共4次。另一组以0.9%氯化钠注射液作为对照。
1.3 统计学处理
2 结果
2.1 病理标本筛选结果
共对5例化疗敏感与5例化疗不敏感(耐药)的肿瘤样本进行了RNA mircoarray基因谱的分析与筛选,这10例患者的临床特点、病理分期均相近,当两组差异表达数超过2倍且 P<0.05时,结果有意义。结果显示,化疗敏感的肿瘤miR-181a表达下调(图 1),P =0.021。

图1 基因分析miR-181a在化疗耐药与敏感患者组织中的表达
2.2 宫颈癌细胞系中miR-181a表达与药物敏感性的关系
在宫颈癌细胞系SiHa与Me180中,发现miR-181a表达量同化疗敏感性呈反比关系。由图2 A可见,Me180细胞miR-181a的表达量比SiHa低65%,Me180对顺铂与吉西他滨比SiHa要敏感(图 2 B及图 2 C)。说明 miR-181a表达在有化疗耐药性的肿瘤样本比化疗敏感的样本显著升高。
为提高监测系统续航能力,电源采用锂电池结合太阳能充电形式[7],同时为防止阴天太阳能无法给电池充电造成锂电池供电不足,预留了外电源接口,设计了电源切换电路。电源切换电路原理图如图3所示。当外部电源供电时MOS管原极为高电平,MOS管无法导通,锂电池供电被切断,反之由锂电池供电。在锂电池接口处加了二极管防止外电源电流灌入锂电池中。
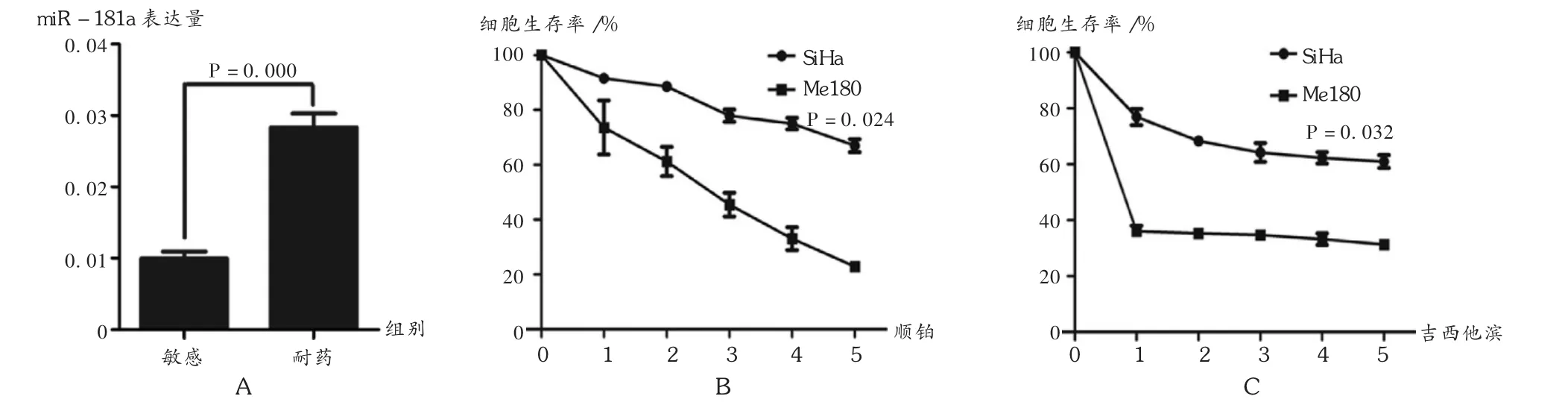
图2 有化疗耐药性的宫颈鳞状细胞癌中miR-181a高表达
2.3 miR-181a过表达在体内、体外对顺铂耐药性的作用
为了分析miR-181a的表达对肿瘤细胞药物敏感性的影响,用稳定转染 miR-181a或阴性质粒的 Me180细胞,以及转染miR-181a抑制因子或阴性对照miRNA的SiHa细胞进行研究。结果表明,上调 miR-181a的表达,增加了Me180细胞的耐药性;而用miR-181a抑制因子转染SiHa细胞后,增强了其对顺铂的敏感性。体外试验结果也表明,miR-181a表达增加,肿瘤细胞化疗耐药性增强(图3 A)。动物试验证实,miR-181a增强了化疗耐药性。由图3 B至图3 D可见,肿瘤在有或无miR-81a的情况下,在无化疗药物处理时,生长情况类似,体积与瘤重大致相等。当用顺铂处理后,miR-181a的增强表达显著促进了肿瘤体积与瘤重的增加,表明miR-181a的上调表达,增强了体内宫颈癌细胞的化疗耐药性。
3 讨论
宫颈癌为我国女性患者一种常见肿瘤,但不同患者对化疗药物的反应不同,表现为接受相关剂量的药物后产生不同的生物学效应,如肿瘤的生长与缩小程度等,这一过程受到多种因素的影响,是目前抗癌治疗中的研究热点问题。本研究中通过比较化疗敏感与化疗耐药性患者miRNA微阵列谱的差异,了解人宫颈鳞状细胞癌化疗耐药性的生物学机制,以找到可解决肿瘤化疗耐药性的治疗方式。国外相关研究发现,miR-378,miR-181a,miR-21,miR-221可能同化疗耐药性有关[4]。本研究主要研究了其中最为重要的miR-181a,结果发现,该miRNA在有化疗耐药性的宫颈癌细胞中高表达。所以推论,miR-181a是一种宫颈癌化疗耐药性的关键因子。为进一步了解宫颈癌与化疗敏感性的关系,试验中选择了2种宫颈癌细胞,通过克隆转染技术及PCR检测这2种细胞中的miR-181a的表达。结果证实了此结论,即在有药物耐药性的SiHa细胞中miR-181a高表达,而对化疗药物敏感的Me180细胞中miR-181a明显降低,这同人体的病理标本结论是一致的。通过基因转染技术发现,在转染miR-181a后肿瘤细胞对药物敏感明显下降,而转染其抑制因子后敏感性升高;裸鼠模型也显示转染了miR-181a后,肿瘤对药物的反应不敏感,体积与瘤重明显增加,从而在体内外试验中都证实了miR-181a能抑制肿瘤对化疗药物的敏感。
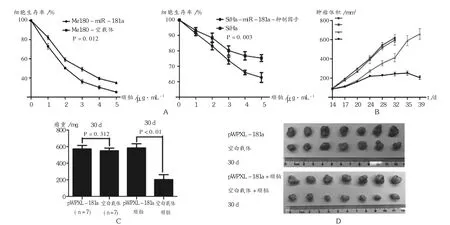
图3 体外与体内miR-181a对宫颈癌细胞化疗药物敏感性的影响
寻找肿瘤特异的miRNA分子,以及他们的靶基因,是了解miRNA在肿瘤产生过程作用机制的关键,也是一种新的肿瘤治疗靶点[5]。miR-181a既可作为原癌基因,也可作为肿瘤抑制因子。miR-181a可以下调癌基因RalA的表达,促进细胞凋亡,并抑制慢性骨髓性白血病的发展[6]。同时,miR-181a也是影响治疗反应的一种介导因子。在A549非小细胞肺癌细胞系中,miR-181a能减少顺铂诱导的细胞凋亡[7]。这些发现同miR-181a参与调控线粒体或后线粒体内源性凋亡途径有关,包括caspase-3/9蛋白成熟、线粒体跨膜势能的消失及Bax的寡聚化[8]。本研究证明了异源表达miR-181a表达能够增加宫颈鳞状细胞癌在体内/外的化疗耐药性。据此可认为,miR-181a能作为原癌基因增强人宫颈癌鳞状细胞化疗耐药性。子宫内膜表达miR-181a影响了许多子宫内膜细胞的活动,并参与子宫内膜细胞从正常状态向肿瘤状态的改变过程[9]。
对于miR-181a增强耐药性的研究,目前一般认为是通过降低PRKCD的表达来实现的。试验证明,PRKCD是miR-181a一种可能的靶基因,miR-181a通过靶向于PRKCD的3′-UTR区,负调控PRKCD mRNA与蛋白质的表达,PRKCD在调控化疗敏感性中发挥作用,稳定表达PRKCD mRNA与蛋白的SiHa细胞,对顺铂更敏感。当转染PRKCD表达载体后,抑制了miR-181a的作用,恢复了肿瘤细胞对化疗的敏感性[10]。这些研究证实,miR-181a在调控肿瘤细胞化疗耐药性中功能与机制的协调作用。目前,基因治疗是肿瘤治疗过程的一个重要方法,得到了越来越多的认可,miRNA可成为肿瘤治疗一个重要方面,在宫颈癌的治疗中,如能成功导入化疗敏感性的miRNA或去掉产生耐药性的miRNA(miR-181a)将极大地改善晚期宫颈癌的预后,同时降低药物的剂量,减少不良反应。
本研究发现,在人宫颈癌细胞中miR-181a的异常表达对化疗敏感性有影响,miR-181a是一种通过靶向于PRKCD的化疗耐药性增强因子[11]。故 miR-181a-PRKCD的相互作用或许可以作为标志物来预测宫颈鳞状细胞癌对顺铂的化疗敏感性。
[1]Hwang YJ, Chung ML, Sohn UD, et al.Cytotoxicity and Structure - activity Relationships of Naphthyridine Derivatives in Human Cervical Cancer,Leukemia, and Prostate Cancer[J].Korean J Physiol Pharmacol,2013,17(6):517-523.
[2]常 靓,吕雅蕾,王玉栋.miRNA-200b在上皮来源恶性肿瘤中的研究进展[J].中国肿瘤临床,2012,39(17):1 329-1 331.
[3]Ji J, Yamashita T, Wang XW.Wnt/beta - catenin signaling activates microRNA -181 expression in hepatocellular carcinoma[J].Cell Biosci,2011, 1(1):4.
[4]Sun C, Li N, Yang Z, et al.miR -9 Regulation of BRCA1 and Ovarian Cancer Sensitivity to Cisplatin and PARP Inhibition[J].J Natl Cancer Inst,2013,105(22):1 750 - 1 758.
[5]郭建新,袁光波,陈 蜜,等 .SGC-7901/DDP胃癌细胞中 MDR1 miRNA干扰载体构建及靶点筛选[J].肿瘤学杂志,2012,18(7):520-523.
[6]Chen J, Qin Z, Pan S, et al.Genetic variants in RAN, DICER and HIWI of microRNA biogenesis genes and risk of cervicalcarcinoma in a Chinese population[J].Chin J Cancer Res,2013,25(5):565 - 571.
[7]Song MK, Park YK, Ryu JC.Polycyclic aromatic hydrocarbon(PAH)-mediated upregulation of hepatic microRNA-181 family promotes cancer cell migration by targeting MAPK phosphatase-5,regulating the activation of p38 MAPK[J].Toxicol Appl Pharmacol,2013,273(1):130 - 139.
[8]Zhang L, Pickard K,Jenei V,et al.miR -153 supports colorectal cancer progression via pleiotropic effects that enhance invasion and chemotherapeutic resistance[J].Cancer Res,2013,73(21):6 435 - 6 447.
[9]王淑芳,冯玉珍,霍新龙.MicroRNA在子宫内膜癌发生、发展及临床诊治中的研究[J].中国医药导报,2013,10(6):30-32.
[10]Pekarik V, Gumulec J, Masarik M, et al.Prostate cancer, miRNAs,metallothioneins and resistance to cytostatic drugs[J].Curr Med Chem,2013,20(4):534 - 544.
[11]Li JP, Zheng JY, Du JJ, et al.What is the relationship among microRNA -181,epithelial cell-adhesion molecule (EpCAM)and betacatenin in hepatic cancer stem cells[J].Hepatology,2009,50(6):2 047-2 048.
