杂多酸催化氧化脱除柴油中的硫化物
2014-05-03李瑞丽
李瑞丽,李 波,张 平
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
柴油中的含硫化合物会影响柴油的安定性,缩短发动机的工作寿命,燃烧后生成的SOx排放到空气中形成酸雨,造成环境污染[1-4]。因此很多国家和地区对柴油中硫含量的标准要求日益严格。2013年,我国发布了GB19147—2013标准[5],要求柴油中的硫含量不高于5×10-5(w)[6-7],因此生产低硫或超低硫柴油成为一种必然趋势[8]。
目前工业上常用的加氢脱硫工艺可除去大部分的含硫化合物,但脱除二苯并噻吩及其衍生物较困难,且需在高温、高压等苛刻条件下进行,增加了操作成本。因此,研究者们开始寻求一些经济高效的非加氢替代方法[9-11],如萃取脱硫法、氧化脱硫法、吸附脱硫法和生物脱硫法等,其中氧化脱硫法反应条件温和、脱硫率高且绿色环保,近年来受到广泛关注[12-14]。常用的氧化体系有H2O2-有机酸、H2O2-杂多酸和H2O2-光催化氧化,由于杂多酸具有结构独特、“假液相”行为及多功能催化作用(酸、氧化和光电催化)等优点,使得H2O2-杂多酸体系备受关注[15-17],同时在该体系中加入表面活性剂,可降低油水两相的界面张力,大幅提高氧化脱硫效率,达到超深度脱硫的目的[18-19]。
本工作以磷钨酸(HPW)、磷钨酸季胺盐[HPW][CTAB]2(CTAB为十六烷基三甲基溴化铵)和过氧磷钨酸季胺盐 [H2O2][HPW][CTAB]2为催化剂,以H2O2为氧化剂,对柴油进行了脱硫性能的研究,筛选了萃取剂,考察了氧化反应条件,探索了氧化脱硫机理。
1 实验部分
1.1 主要试剂及仪器
FCC柴油:中国石化北京燕山分公司,硫含量3 647 mg/L;N,N-二甲基甲酰胺和30%(w)H2O2溶液:分析纯,北京化工厂;二甲基亚砜、N-甲基吡咯烷酮:分析纯,天津市福晨化学试剂厂;糠醛、乙腈和CTAB:分析纯,天津市光复精细化工研究所;HPW:分析纯,天津市津科精细化工研究所。
ANTEK7000型硫氮分析仪:ANTEK公司;DF-101S型集热式磁力搅拌器:金坛市正基仪器有限公司。
1.2 催化剂的制备
[HPW][CTAB]2催化剂的制备:称取2.884 0 g(1 mmol)HPW溶于20 mL去离子水中,制得HPW溶液;称取0.729 1 g(2 mmol)相转移剂CTAB溶于40 mL无水乙醇中,制得CTAB乙醇溶液;将CTAB乙醇溶液滴加到剧烈搅拌的HPW溶液中,立即有白色沉淀生成;CTAB滴加完后,继续搅拌1 h,过滤白色悬浮液,并用去离子水洗涤;将得到的白色固体在100 ℃下干燥3 h,得到[HPW][CTAB]2催化剂。
[H2O2][HPW][CTAB]2催化剂的制备:称取2.884 0 g(1 mmol)HPW溶于20 mL去离子水中,加入几滴30%(w)H2O2溶液制得的黄色过氧磷钨酸溶液;称取0.729 1 g(2 mmol)CTAB溶于40 mL无水乙醇中,制得CTAB乙醇溶液;将CTAB乙醇溶液滴加到剧烈搅拌的过氧磷钨酸溶液中,立即有白色沉淀生成;CTAB滴加完后,继续搅拌1 h,过滤黄色悬浮液,并用去离子水洗涤;将得到的白色固体在80 ℃下干燥2 h,得到[H2O2][HPW][CTAB]2催化剂。
1.3 催化剂的表征
采用Bruker公司D8 Advance型X射线衍射仪对试样进行XRD表征,扫描范围2θ=5°~50°;采用Nicolet公司MAGNA-IR 560 E.S.P型傅里叶变换红外光谱仪对试样进行FTIR表征,分辨率0.35 cm-1,扫描范围400~4 000 cm-1。
1.4 实验步骤
取一定体积的FCC柴油加入到圆底烧瓶中,加入适量的催化剂,将烧瓶置于恒温水浴中,待达到反应温度后,加入一定量的30%(w)H2O2溶液,在磁力搅拌、恒定的反应温度下反应一定时间。待反应结束后,静置,取上层油相,加入等体积的萃取剂,在30 ℃下萃取30 min,用分液漏斗分液,水洗,干燥,两次萃取后测定柴油中的硫含量。
2 结果与讨论
对于Keggin结构的多金属氧酸盐,其FTIR谱图在700~1 100 cm-1指纹区会出现4个特征吸收峰,分别为:WO(980 cm-1附近),W—Ob—W(890~850 cm-1),W—Oc—W(800~760 cm-1),P—O(1 079 cm-1附近)[20-21]。催化剂的FTIR谱图见图1。
2.1 催化剂的表征
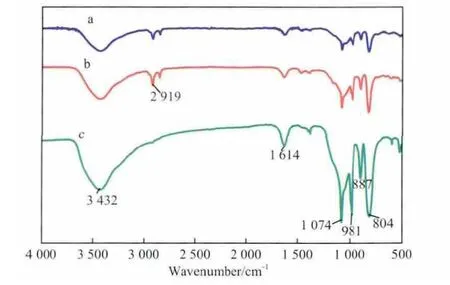
图1 催化剂的FTIR谱图Fig.1 FTIR spectra of catalysts.
由图1可见,3种催化剂均保持了Keggin结构。3 432,1 614 cm-1处的吸收峰是由HPW分子中所含有的结晶水引起的;2 919 cm-1处的吸收峰归属于季铵盐的特征峰。因此,[H2O2][HPW][CTAB]2和[HPW][CTAB]2均为磷钨酸季铵盐[22]。
催化剂的XRD谱图见图2。由图2可见,[H2O2][HPW][CTAB]2和[HPW][CTAB]2的衍射峰位置与HPW的衍射峰位置略有不同,但主要特征峰均出现在2θ=7°~10°内,根据文献[23]报道的内容可知,该范围内的衍射峰可归属于Keggin结构的磷钨酸盐,表明合成的催化剂[H2O2][HPW][CTAB]2和[HPW][CTAB]2与HPW同样具有Keggin结构,该结果与FTIR表征结果一致。但衍射峰强度较纯HPW衍射峰的强度减弱,峰尖锐度有所下降,半高宽变大,表明HPW的结晶程度减小,这可能是由于HPW与CTAB混合后,破坏了HPW的晶体结构或HPW晶体被CTAB包埋所致。

图2 催化剂的XRD谱图Fig.2 XRD spectra of the catalysts.
2.2 催化剂的活性评价
考察3种催化剂HPW,[HPW][CTAB]2,[H2O2][HPW][CTAB]2及HPW和CTAB分批次加入反应体系时的脱硫效果,实验结果见图3。由图3可见,HPW,[HPW][CTAB]2,[H2O2][HPW][CTAB]2催化剂的脱硫率分别为85.9%,92.2%,93.4%。CTAB的加入使催化剂脱硫率明显提高,HPW和CTAB分批次加入反应体系时的脱硫效果优于HPW,[HPW][CTAB]2,[H2O2][HPW][CTAB]2的脱硫效果,脱硫率达94.2%。原因分析:该反应是一个油-水两相反应体系,CTAB具有亲油性,它的加入增加了氧化剂与反应物分子的接触几率,脱硫效果好[24]。同时,加入CTAB后,体系在搅拌状态下形成乳状液,增大了油水接触面积,氧化反应速率加快,提高了脱硫率[11]。催化剂[HPW][CTAB]2和[H2O2][HPW][CTAB]2的脱硫效果比HPW和CTAB分批次加入反应体系时的脱硫效果差。这是因为:在[HPW][CTAB]2和[H2O2][HPW][CTAB]2的合成过程中,CTAB的加入导致HPW结晶度下降,同时,CTAB与小晶粒的HPW可能发生不定团聚,降低了CTAB的表面活性作用,导致脱硫率降低。另外,季铵盐的长烷基链具有一定的空间位阻,阻碍了含硫化合物与催化活性中心的接触,从而影响了脱硫率[25]。与[HPW][CTAB]2催化剂相比,[H2O2][HPW][CTAB]2催化剂的脱硫效果略好,可能的原因是磷钨酸季铵盐只是催化剂的前体,而[H2O2][HPW][CTAB]2会直接氧化含硫化合物。

图3 不同催化剂的脱硫性能Fig.3 Desulfurization performances of the catalysts.
2.3 反应条件的考察
2.3.1 萃取剂的选择
萃取剂种类对脱硫率的影响见表1。由表1可见,以糠醛为萃取剂时的脱硫效果最好。其可能的原因是糠醛的极性与柴油氧化后砜类的极性相似,根据相似相容原理,糠醛的脱硫效果较好。

表1 萃取剂种类对脱硫率的影响Table 1 Effect of extraction agent types on sulfur removal
2.3.2 反应时间的影响
反应时间对脱硫率的影响见图4。由图4可见,脱硫率随反应时间的延长呈现先增大后趋于稳定的趋势;当反应时间为90 min时脱硫率达到最大值。这是因为反应初期,随反应时间的延长,H2O2分解出大量的具有强氧化性的·OH自由基,反应速率加快,脱硫率提高;但反应时间过长,H2O2大部分已分解完毕,氧化反应达到平衡,脱硫率基本不变。因此,选择反应时间为90 min较适宜。

图4 反应时间对脱硫率的影响Fig.4 Effect of reaction time on the sulfur removal.
2.3.3 反应温度的影响
反应温度对脱硫率的影响见图5。

图5 反应温度对脱硫率的影响Fig.5 Effect of reaction temperature on the sulfur removal.
由图5可见,随反应温度的升高,脱硫率呈现先增大后降低的趋势;当反应温度为60 ℃时脱硫率达到最大值。这主要是因为:反应初期随温度的升高,H2O2分解速率加快,据文献[26]报道,反应温度每升高10 ℃,H2O2的分解速率提高2~3倍,且在催化剂存在下,更加快了H2O2的分解。H2O2分解生成大量的·OH自由基,催化剂活性提高。同时,反应温度升高,分子扩散速率加快,反应体系接触更充分,脱硫率提高。又因为硫化物氧化为砜或亚砜的反应为吸热反应,升高反应温度使平衡向正反应方向移动,氧化反应更彻底。但反应温度太高,H2O2容易分解,降低了反应活性,影响了脱硫效果。因此,选择反应温度为60 ℃较适宜。
2.3.4 H2O2用量的影响
H2O2用量对脱硫率的影响见图6。由图6可见,在一定范围内增加H2O2用量可大幅提高脱硫率。这是因为一定量的H2O2分解产生的·OH自由基使氧化反应充分完全。当n(H2O2)∶n(S)=3.5时,再继续增加H2O2用量,脱硫率先下降后趋于平稳,这是因为H2O2用量太多,分解产生的大量·OH自由基来不及反应,或与其他组分发生副反应,或自行结合为氧气逸出反应体系,降低了H2O2的利用效率。同时H2O2用量过多,导致水相体系增加,在CTAB存在下,油以水包油的形式存在于水相,造成脱硫率降低。因此,选择n(H2O2)∶n(S)=3.5较适宜。

图6 H2O2用量对脱硫率的影响Fig.6 Effect of H2O2 dosage on the sulfur removal.
2.3.5 HPW用量的影响
HPW用量对脱硫率的影响见图7。由图7可见,随HPW用量的增加,脱硫率呈现先增大后略有降低的趋势;当HPW用量为1.00%(占柴油的质量)时,脱硫率达到最大值。这是因为随HPW用量的增加,催化活性中心增多,提高了氧化剂的利用效率,加快了反应速率,脱硫率提高。在H2O2用量一定时,如果HPW用量过大,H2O2在单位时间内反应产生的·OH自由基过多,加剧副反应的发生,导致脱硫率的增幅趋缓或下降。因此,选择HPW用量为1.00%(w)较适宜。
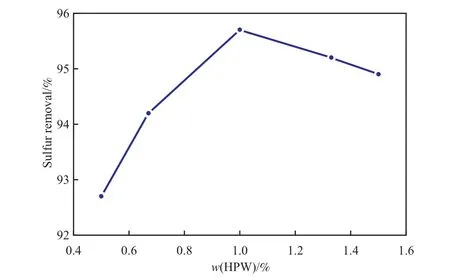
图7 HPW用量对脱硫率的影响Fig.7 Effect of HPW dosage on the sulfur removal.
2.3.6 CTAB用量的影响
CTAB用量对脱硫率的影响见图8。由图8可见,随CTAB用量的增加,脱硫率先增大后略有下降最后趋于恒定;当CTAB用量为0.25%(占柴油的质量)时脱硫率达到最大值。其可能的原因是:CTAB是一种双亲型催化剂,能与柴油和水形成亚稳态的乳滴,为柴油中的含硫化合物与氧化剂的接触提供更大的表面积,提高了油水接触效果,脱硫率增大;如果CTAB用量过多,会降低氧化剂与反应物的相对有效浓度,导致脱硫率降低。因此,选择CTAB用量为0.25%(w)较适宜。

图8 CTAB用量对脱硫率的影响Fig.8 Effect of CTAB dosage on the sulfur removal.
2.3.7 最佳条件下的脱硫实验
在20 mL柴油中加入1.00%(w)的HPW,将烧瓶置于60 ℃的恒温水浴中,然后加入n(H2O2)∶n(S)=3.5的30%(w)H2O2溶液和0.25%(w)的CTAB,反应90 min,取出烧瓶,静置,用与柴油等体积的糠醛在30 ℃下萃取30 min,两次萃取后测得柴油中的硫含量为155 mg/L,脱硫率达95.7%。
2.4 氧化脱硫的机理
结合前面的实验结果和讨论,对萃取氧化脱硫过程的反应机理进行分析。首先,HPW的加入增强了H2O2的酸性;同时,在H2O2的作用下,HPW的阴离子[PW12O40]3-(记为PW12)被氧化分解为[PO4{WO(O2)2}4]3-(记为PW4)和一些含钨的游离物质,PW4起到氧化作用,它将噻吩、苯并噻吩等一些含硫化合物氧化为亚砜或砜,同时自身还原为PW12,氧化后的亚砜或砜的极性增强,利用相似相容原理,采用极性的萃取剂将其萃取脱除[27]。当加入CTAB后,CTAB与过氧磷钨酸形成过氧磷钨酸季铵盐,它既有亲油性又有亲水性,增加了相际间的传质,因此脱硫率提高。
3 结论
1)FTIR和XRD表征结果显示,催化剂[HPW][CTAB]2和[H2O2][HPW][CTAB]2仍保持了HPW的Keggin结构,并具有一定的活性。
2)柴油在3种催化剂HPW,[HPW][CTAB]2,[H2O2][HPW][CTAB]2作用下的脱硫率分别为85.9%,92.2%,93.4%。当HPW和CTAB分批次加入反应体系时,氧化脱硫效果最佳,脱硫率为94.2%。
3)H2O2-HPW-CTAB体系脱硫的最佳条件为:以糠醛为溶剂,反应温度60 ℃,反应时间90 min,n(H2O2)∶n(S)=3.5,HPW用量1.00%(w),CTAB用量0.25%(w)。氧化萃取脱硫后,柴油中硫含量由3 647 mg/L降至155 mg/L,脱硫率达95.7%。
4)H2O2与HPW结合为过氧酸起催化作用,相转移剂CTAB的加入增加了油水有效接触,脱硫率提高。
[1]王亮,李春虎,冯丽娟,等.用于FCC柴油氧化萃取脱硫的负载型磷钨酸催化剂和复合萃取剂[J].石油学报:石油加工,2012,28(1):33-38.
[2]Qiu Jianghua,Wang Guanghui,Zeng Danlin,et al.Oxidative Desulfurization of Diesel Fuel Using Amphiphilic Quaternary Ammonium Phosphomolybdate Catalysts[J].Fuel Process Technol,2009,90(12):1538-1542.
[3]方海翔,蒋博龙,宋华.油品氧化脱硫技术进展[J].当代化工,2010,39(2):150-155.
[4]关涛.催化裂化柴油脱硫研究[D].天津:天津大学,2007.
[5]全国石油产品和润滑剂标准化技术委员会.GB19147—2013车用柴油(Ⅳ)[S].北京:中国标准出版社,2013.
[6]岳欣,庞媛,马遥.我国车用汽油、柴油有害物质和环保指标研究[J].环境工程技术学报,2012,2(4):233-240.
[7]周永生,赵彦,黄开胜,等.柴油国家标准GB19147和GB252的对比[J].中国石油和化工标准与质量,2013(4):12-17.
[8]葛建华,周钰明,高良敏,等.离子液体中季铵型六聚钨酸盐相转移催化氧化脱硫性能[J].石油化工,2013,42(8):858-864.
[9]李瑞丽,刘瑛,李波.氧化法脱除重油催化裂化柴油中的硫化物[J].化工进展,2013,32(8):1813-1817.
[10]Zhang Hongxing,Gao Jiajun,Meng Hong,et al.Removal of Thiophenic Sulfurs Using an Extractive Oxidative Desulfurization Process with Three New Phosphotungstate Catalysts[J].Ind Eng Chem Res,2012,51(19):6658-6665.
[11]Zhang Boyu,Jiang Zongxuan,Li Jun,et al.Catalytic Oxidation of Thiophene and Its Derivatives via Dual Activation for Ultra-Deep Desulfurization of Fuels[J].J Catal,2012,287:5-12.
[12]吕宏缨.液氧化-萃取法用于柴油的超深度脱硫[D].大连:中国科学院大连化学物理研究所,2007.
[13]Abu Bakar W A W,Ali R,Kadir A A A,et al.Effect of Transition Metal Oxides Catalysts on Oxidative Desulfurization of Model Diesel[J].Fuel Process Technol,2012,101:78-84.
[14]赵春艳.柴油脱硫技术进展[J].化学与生物工程,2012,29(2):18-20.
[15]刘淑芝,孙兰兰,张晓丽,等.柴油氧化脱硫技术研究进展[J].化工进展,2007,26(2):212-215.
[16]戴群和.双模型介孔SiO2负载磷钨酸催化剂的制备,表征及催化性能[D].北京:北京工业大学,2012.
[17]祁广.Keggin结构磷钼酸盐的制备表征及氧化脱硫研究[D].大连:大连理工大学,2008.
[18]黄丹,王玉军,骆广生.表面活性剂强化氧化萃取脱硫过程的实验研究[J].过程工程学报,2006,6(3):384-387.
[19]赵地顺,马四国,刘翠微.FCC汽油选择性氧化脱硫的实验室研究[J].石油炼制与化工,2006,7(1):31-34.
[20]王恩波,胡长文,许林.多酸化学导论[M].北京:化学工业出版社,1998:22-23.
[21]Chen Yuanzhe,Zhang Fengwei,Fang Yiyun,et al.Phosphotungstic Acid Containing Ioin Liquid Immobilized on Magetic Mesoporous Silica Rod Catalyst for the Oxidation of Dibenzothiophene with H2O2[J].Catal Commun,2013,38(5):54-58.
[22]宋华,李国忠,李正光.磷钨酸季铵盐催化氧化汽油深度脱硫[J].燃料化学学报,2012,38(4):439-444.
[23]Zhang Xia,Li Jing,Chen Yang,et al.Heteropolyacid Nanoreactor with Double Acid Sites as a Highly Ef fi cient and Reusable Catalyst for the Transesteri fi cation of Waste Cooking Oil[J].Energy Fuels,2009,23(9):4640-4646.
[24]Huang Dong,Wang Yujue,Yang Lumeng,et al.Chemical Oxidation of Dibenzothiophene with a Directly Combined Amphiphilic Catalyst for Deep Desulfurization[J].Ind Eng Chem Res,2006,45(6):1880-1885.
[25]He Lining,Li Huaming,Zhu Wenshuai,et al.Deep Oxidative Desulfurization of Fuels Using Peroxophosphomolybdate Catalysts in Ionic Liquids[J].Ind Eng Chem Res,2008,47(18):6890-6895.
[26]吴洪达,郭敏.Keggin结构铜单取代硅钨酸钾催化过氧化氢分解[J].精细石油化工,2003,20(1):8-11.
[27]张红星.模型油中噻吩类硫化物的氧化和吸附脱硫方法研究[D].北京:北京化工大学,2012.
